环境化学 2008_第三章 化学污染物的转化行为
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化知识交流

之,pE越大,电子浓度越低,体系接受电子的倾向就越强。
(2)氧化还原电位E和pE的关系
Ox +ne→Red
(1)
根据Nernst方程
E=E0-(2.303RT/nF)lg[Red]/[Ox] (2) 当反应达平衡时,定义
E0=(2.303RT/nF) lgK
(3)
从上述化学方程式(1),可写出
K= [Red]/{[Ox][e]n }
如果考虑到羟基配合作用,那么金属氧化物或氢氧化物的 溶解度(MeT)表征为:
MeT = [ Mez+ ] +∑[ Me(OH)nz-n ]
固体的氧化物和氢氧化物具有两性的特征,它们和质子或 羟基离子都发生反应,存在一个pH值,在该值下溶解度为最 小值。在碱性或酸性更强的pH值区域内,溶解度都会变得更 大。
因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子 的饱和浓度为: [Me2+]=Ksp/[S2-]=Ksp [H+]2/Ksp´ =Ksp [H+]2/(0.1K1K2)
3、碳酸盐
——多相平衡,pH通过控制碳酸根浓度影响沉淀平衡
封闭体系: 只考虑固相和液相,把 H2CO3* 当作不挥发酸类处理。
吸附量随粒度增大而减少,并且当溶质浓度范围固定 时,吸附量随颗粒物浓度增大而减少。
温度变化、几种离子共存(竞争作用)等。
3、沉积物中重金属的释放——属于二次污染问题
诱发释放的主要因素有: (1)盐浓度升高:碱金属和碱土金属阳离子可将被吸附在固体颗
粒上的金属离子交换出来。
(2)氧化还原条件的变化:有机物增多,产生厌氧环境、铁锰氧 化物还原溶解,使结合在其中的金属释放出来。
2、它在中性表面甚至在与吸附离子带相同电荷符号的表面 也能进行吸附作用。
第三章水环境化学水中无机污染物的迁移转化

胶体微粒的吸附和聚沉对污染物的影响
④吸附和聚沉对污染物的影响
有人研究某入海河口铬、铜、汞的迁 移机制,测定了该河口底层水和表层底 泥中铬、铜、汞的含量及它们在底泥中 的富集系数(相对底层水),发现多年来 该河口水中铬、铜、汞含量,基本稳定 在标准以下,而部分站位表层底泥中有 时出现超标的情况;而且在表层底泥中 铬、铜、汞的平均富集系数很大,分别 为980~1100、164~500、18~45,呈 现明显的富集能力,其中对铬尤为显著。
第二节 水中无机污染物的迁移转化
无机污染物主要通过沉淀-溶解、氧化-还原、配合作 用、胶体形成、吸附-解吸等一系列物理化学作用进行 迁移转化,参与和干扰各种环境化学过程和物质循环 过程,最终以一种或多种形态长期存留在环境中,造 成永久性的潜在危害。
实际上微量污染物在水体中的浓度和形态分布,在 很大程度上取决于水体中各类胶体的行为。胶体微粒 作为微量污染物的载体,它们的絮凝沉降、扩散迁移 等过程决定着污染物的去向和归宿。在天然水体中, 重金属在水相中含量极微,而主要富集于固相中,在 很大程度上与胶体的吸附作用有关。因此,胶体的吸 附作用对水环境中重金属的过程转化及生物生态效应 有重要影响。
27
胶体微粒的吸附和聚沉对污染物的影响
②不同吸附剂对金属离子的吸附有较大
的差别
P.A.Krenkel和E.B.Shin等研究了各种天然 和人工合成的吸附剂对HgCl2的吸附作用, 其吸附能力大致顺序是:含硫的沉积物(还 原态的)>商业去污剂(硅的混合物、活性 碳)>三维黏土矿物(伊利石、蒙脱石)>含 蛋白去污剂>铁、锰氧化物及不含硫的天 然有机物>不含硫但含胺的合成有机去污 剂、二维黏土矿物和细砂。
26
补充:胶体微粒的吸附和聚沉对污染物的 影响
环境化学

一、名词解释:1、环境化学:环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。
它既是环境科学的核心组成部分,也是化学科学的一个新的重要分支。
2、污染物的迁移:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程;污染物的转化:污染物在环境中通过物理化学或生物的作用改变存在形式或转变为另一种物质的过程3、一次污染物():是指由一次污染物经化学反应式形成的污染物质。
二次污染物():是指直接从污染物源排放的污染物质。
4、垂直递减率():随温度升高气温的降低率为大气垂直递减率。
干绝热垂直递减率():干空气在上升是温度降低值与上升高度之比。
5、光化学烟雾现象:含有氮氧化合物和碳氢化合物第一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象。
硫酸烟雾型污染:是由燃烧煤而排放出来的so2,颗粒物以及由so2氧化所形成的硫酸盐颗粒物所造成的大气污染现象。
6、一次颗粒物():直接由污染源排放出来的二次颗粒物():大气中某些污染组分之间或这些组分与大气成分之间发生反应而产生的颗粒物。
7、干沉降():是指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
湿沉降():是指通过降雨降雪等使颗粒物从大气中去除的过程。
8、雨除():是指一些颗粒物可作为形成云得凝结核,成为云滴中心,通过凝结过程和碰撞过程使其增大为雨滴,进一步长大而形成雨降落到地面,颗粒物也随之从大气中被去除。
冲刷():降雨时在云下面的颗粒物与降下来的雨滴发生惯性碰撞或扩散,吸附过程从而使颗粒物去除。
9、分配系数:非离子性有机物可通过溶解作用分配到土壤有机质中并经过一定时间达到分配平衡,此时有机物在土壤有机质和水中含量的比值称分配系数。
标准化的分配系数:即有机碳为基础表示的分配系数。
辛醇——水分配系数:即化学物质在辛醇中质量和在水中质量的比值。
【环境化学】环境污染物在环境各圈的迁移转化过程简介

环境化学第一章绪论第一节环境化学一、环境问题二、环境化学第二节环境污染物一、环境污染物的类别二、环境效应及其影响因素三、环境污染物在环境各圈的迁移转化过程简介表1-1环境化学分支学科划分注:①“环境生态学也可列为平行的另一个分支学科第二章大气环境化学第一节大气中污染物的迁移一、大气温度层结和密度层结二、辐射逆温层三、气块的绝热过程和干绝热递减率四、大气稳定度五、影响大气污染物迁移的因素第二节大气中污染物的转化一、光化学反应基础1 光化学反应过程 2 量子产率 3 大气中重要吸光物质的光离解二、大气中重要自由基的来源1.大气中HO和HO2自由基的浓度2.大气中HO和HO2的来源3.R、RO和RO2等自由基的来源三、氮氧化物的转化1 大气中含氮化合物2 氮氧化物的气相转化四、碳氢化合物的转化1 大气中主要的碳氢化合物2 碳氢化合物在大气中的反应表2-3 HO、O与烷烃反应的速度常数五、光化学烟雾1 光化学烟雾2 光化学烟雾形成的简化机制3 光化学烟雾的控制对策六、硫氧化物的转化及硫酸烟雾型污染 1 二氧化硫的气相氧化2 二氧化硫的液相氧化 3 硫酸烟雾型污染表2-6 伦敦型烟雾与洛杉矶烟雾的比较七、酸性降水 1 降水的PH 2 降水PH的背景值 3 降水的化学组成4 酸<a name=baidusnap0></a>雨的</B>化学组成5 影响酸雨形成的因素表2-7 世界某些降水背景点的pH值表2-8 国外部分地区降水化学成分(μmol/L) 注:本表摘自唐孝炎,1990。
表2-9 国内部分城市降水化学成分(μmol/L) 表2-9 国内部分城市降水化学成分(μmol/L) 注:本表摘自唐孝炎,1990。
表2-15 我国部分地区降水酸度和主要离子含量(μmol/L)表2-16 降水中离子浓度比较注:本表摘自王晓蓉,1993。
①北京和天津城区数据平均值。
②重庆铜元局和贵阳喷水池数据平均值。
环境化学教案 第三节水中无机污染物的迁移转化(氧化还原2)
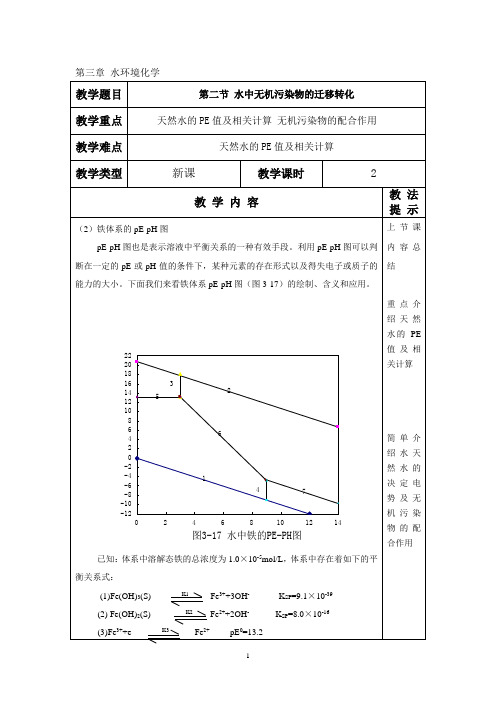
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
环境化学水环境化学第三节讲解

例:某有机分子量为192,溶解在含有悬浮物的水体中, 若悬浮物种85%为细颗粒,有机碳含量为5%,其余 粗颗粒有机碳含量为1%,已知该有机物在水中溶解 度为0.05mg/L,那么其分配系数(Kp)如何计算?
lgKow=5.00-0.670×lg(0.05×103/192 ) Kow=2.46×105 由公式Koc=0.63Kow Koc=0.63×2.46×105=1.55×105 由公式Kp= Koc[ 0.2(1-f) Xocs + f Xocf ] Kp =1.55×105 [ 0.2(1-0.85) ×0.01 + 0.85×0.05 ] Kp =6.63×103
解;烷ቤተ መጻሕፍቲ ባይዱ芳基磺酸盐LAS,含磷,泡沫减少,可生物降解) 有机农药(有机氯农药DDT、六六六等毒性大,难分解,
禁用,有机磷农药含杀虫剂与除草剂,毒性大,难降解)
取代苯类化合物(苯环上的氢被硝基、胺基取代后生成的芳 香族卤化物,主要来自染料、炸药、电器、塑料、制药、 合成橡胶等工业)。
六、水体的污染小结
四、光解作用
光解作用是有机污染物真正的分解过程,因为它不可逆 的改变了反应分子,强烈的影响水环境中某些污染物 的归趋。
光解过程可分为三类: 1、直接光解:化合物本身直接吸收了光能而进行分解反
应。
2、敏化光解:水体中存在的天然物质被阳光激发后,又 将其激发态的能量转移给化合物而导致的分解反应。
3、氧化反应:天然物质被辐照而产生自由基获纯态氧等 中间体,这些中间体又与化合物作用而生成转化的产 物。
许多有机毒物可以像天然有机化合物那样作为 微生物的生长基质。只要用这些有毒物质作为 微生物培养的唯一碳源便可鉴定是否属于生长 代谢。在这种代谢过程中微生物对这些有毒物 质可以进行较彻底的降解或矿化,因而是解毒 生长基质。
污染物在环境中的转化

Cl • O3 ClO • O2
卤代烃在平流层中的转化
O3 h O2 O •
O • ClO• Cl • O2
❖在上述链式反应中除去了两个臭氧分子后, 又再次提供了除去另外两个臭氧分子的氯原子。
Cl • CH 4 HCl •CH 3
❖ 汞的甲基化既可在厌氧条件下发生,也可在好氧 条件下发生。在厌氧条件下,主要转化为二甲基 汞。在好氧条件下,主要转化为一甲基汞。
汞在环境中的转化及危害
三、甲基汞脱甲基化与汞离子还原
❖ 湖底沉积物中甲基汞可被某些细菌降解而转化为 甲烷和汞。也可将Hg2+还原为金属汞。 CH 3 Hg 2H Hg CH 4 H HgCl 2 2H Hg 2HCl
汞在环境中的转化
一、环境中汞的来源、分布与迁移:
❖ 来源:汞在自然界的浓度不大,但分布很广。19 世纪以来,随着工业的发展,汞的用途越来越广, 生产量急剧增加,从而使大量的汞由于人类活动 而进入环境。
汞在环境中的转化
❖ 分布:能以零价形态存在于大气、土壤和天然水中。 由于汞具有很高的电离势,故转化为离子的倾向小 于其他金属。
最初用来作为工业去油剂和干洗剂从1950年以来排放到大气中的量逐年增加现在每年的排放速率是cfc11和cfc12的二倍多平均每年增长16clcfc22人工合成的卤代烃是一种主要的工业氟利昂产品主要用作制冷剂和发泡剂
污染物在环境中的转化过程
LOGO
班级:XX 姓名:XX 学号:XX
污染物在环境中的转化过程
❖ 例如4,CHF2Cl(CFC-22) 人工合成的卤代烃,是一种主要的工业氟利昂产品,主要 用作制冷剂和发泡剂。
卤代烃在环境中的转化及危害
大气环境化学大气中污染物的转化

大气环境是人类生存的基础,提供氧 气、调节气候等重要功能。
生态系统平衡的维护
大气环境是生态系统中不可或缺的一 部分,对维持生态平衡起着重要作用 。
大气污染物的来源和影响
工业排放
工业生产过程中产生的废气、烟尘 等是大气污染物的主要来源之一, 对环境和人体健康造成严重影响。
交通运输
汽车、飞机等交通工具排放的尾气 是大气污染物的重要来源,包括一 氧化碳、氮氧化物等有害物质。
限制机动车尾气排放
加强机动车尾气排放标准,推广新能源汽车,鼓励公共交通出行, 减少私家车使用。
控制生活污染源
提倡绿色生活方式,减少一次性塑料制品的使用,加强垃圾分类和 资源回收利用。
改善能源结构
增加清洁能源比重
大力发展太阳能、风能、水能等 可再生能源,逐步减少对化石能
源的依赖。
提高能源利用效率
推广节能技术和设备,加强能源管 理和监测,减少能源浪费。
包括水溶性离子、痕量元 素、碳元素等,这些组分 决定了颗粒物的物理和化 学性质。
PART 03
大气中污染物的转化过程
REPORTING
WENKU DESIGN
光化学转化
光化学转化是指大气中的污染物在阳 光的作用下,通过吸收光能发生化学 反应,从而改变其化学性质的过程。
光化学转化在大气污染物的转化中起着 重要的作用,特别是对于一些持久性有 机污染物,如多环芳烃和二噁英等。
PART 06
结论
REPORTING
WENKU DESIGN
大气环境化学的重要性和挑战
重要性
大气环境化学研究污染物在大气中的迁移、转化、归宿和影响,对于环境保护和 人类健康具有重要意义。
挑战
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、空气中硫氧化物的转化和硫酸烟雾型污染
Transformation of Sulfur Oxides in Air and Pollution of Sulfuric Acid Aerosol 1. 硫的来源 人为来源: 含硫矿物燃料燃烧 煤 (0.5-6%)占60%
n MeT [Me ] [Me(OH)z n ] z 1 n
PbO (s) + 2H PbO (s) + H
+
+
Pb2++H2O Pb(OH)+ Pb(OH)2 Pb(OH)3- +H+
lgKs0=12.7 lgKs1=5.0 lgKs2=-4.4 lgKs3=-15.4
PbO (s) + H2O PbO (s) + 2H2O
四、配合平衡
重要的无机配位体有:OH-、Cl-、CO32-、HCO3-、F-、S2-等。 有机配位体:天然水体中有动植物组织的天然降解产物,如氨 基酸、糖、腐殖酸;生活废水中有洗涤剂、清洁剂、EDTA、 农药和大分子环状化合物等。这些有机物相当一部分具有配合 能力。 (1) 配合物在溶液中的稳定性
对眼睛和呼吸道有强刺激作用。 O3等氧化剂
臭氧浓度 出现时间 毒 性
严重时可导致死亡。
注:本表摘自王晓蓉,1993。
有强氧化破坏作用,严重时可导致死亡。
三、溶解-沉淀
1. 金属类污染物可能发生的迁移和转化过程
动物摄取
植物摄取 溶解
食物链迁移
生物富集
沉淀 吸附 作用
烷基化 作用
挥发 作用
氧化 还原 配合作用 (与有机物相 互作用)
Me2 3OH Me(OH) 3 Me2 4OH Me(OH) 3
( 1 K 1 ) ( 2 K1 K 2 ) ( 3 K1 K 2 K 3 ) ( 4 K1 K 2 K 3 K 4 )
四、配合平衡
[Me]T [Me2 ] [MeOH ] [Me(OH)2 ] [Me(OH)3 ] [Me(OH)4 ]
SO2 + hv
2. SO2的气相氧化
(1) 直接光氧化
M SO2 + M
1SO2
(290-340 nm)
M
3SO2
(340-400 nm) O2 SO2 2SO3
石油(0.5-3%)占30%
天然来源:
SO4
火山喷发,10%
SO3 + O
二、空气中硫氧化物的转化和硫酸烟雾型污染
(2) SO2被自由基氧化
第三章 化学污染物的转化行为
Transformation of Chemical Pollutants
Sorption Desorption Partition Photolysis Photodegradation Photolysis Photodegradation
KOA, PL
Volatilization Deposition
R1 R3 O O R3 C C R 4 O R1 R2 O O C R3 R4
O3 + C C R2 R4
R1 R2
C O +
二元活性自由基
二、空气中硫氧化物的转化和硫酸烟雾型污染
3. 硫酸烟雾型污染 硫酸烟雾也称为伦敦 烟雾,最早发生在英国伦
敦。它主要是由于燃煤而
排放出来的SO2、颗粒物 以及由SO2氧化所形成的 硫酸盐颗粒物所造成的大 气污染现象。
• 水和土壤中:微生物发挥重要作用。
• 在实际天然水或污水体系中,许多氧化还原反应非常缓慢。
五、氧化-还原
2. 氧化-还原反应趋势的表征 (1) 电子活度和氧化还原电位 定义:电子活度 酸碱反应:
pH = -lg(aH+)
aH+____ 氢离子在水溶液中的活度,它衡量溶液接受或迁移 质子的相对趋势; 还原剂和氧化剂可以定义为电子供体和电子接受体, 可定义pε为:pε = -lg(ae)
2
NH3 Zn(NH3 ) 2
2
2
[ Zn(NH3 ) 2 ] 2 K2 2 . 1 10 2 [ ZnNH3 ][NH3 ] Zn2 2 NH3 Zn(NH3 ) 2
2 2
[ Zn(NH3 ) 2 ] 4 2 K K 8 . 2 10 1 2 [ Zn2 ][NH3 ]2
五、氧化-还原
pε的严格热力学定义是由Stumm和Morgan提出的,基于下
列反应:
2H+(aq) + 2e H2 (g)
当H+(aq)在1单位活度与1.013×105Pa的H2平衡(同样活度为 1)的介质中, 电子活度为1.00, pε = 0.0。 pε越小,电子浓度越高, 体系提供电子的倾向越强; pε越大, 电子浓度越低,体系 接受电子的倾向越强 pε增大方向
配合物在溶液中的稳定性是指配合物在溶液中离解成中心
离子和配位体,当离解达到平衡时离解程度的大小。 配合物的逐级生成常数(或逐级稳定常数)和积累稳定常数 (积累生成常数)是表征配合物在溶液中稳定性的重要参数。
四、配合平衡
以 Zn为例, Zn2 NH3 ZnNH3
2 2
[ ZnNH3 ] 2 K1 3 . 9 10 [Zn2 ][NH3 ] ZnNH3
四、配合平衡
1. 配合作用 由具有电子给体性质的配体与具有接受电子空位的离子或
原子形成配合物的过程。金属离子可与含电子给体的物质结合,
形成配位化合物。 水中金属,大部分以配合物形态存在,其迁移、转化及生 物毒性等均与配合作用密切相关。 毒性:自由铜离子的毒性大于配合态铜,而甲基汞的毒性
远大于无机汞。
3
0
[Me(OH) 3 ] Me(OH) 2 OH Me(OH) ( K 3 ) 0 [Me(OH)2 ][OH ]
Me(OH)-3 OH Me(OH)2 4
[Me(OH)4 ] (K3 ) [Me(OH) 3 ][OH ]
பைடு நூலகம்
2
Me2 OH MeOH Me2 2OH Me(OH) 0 2
n 0 n [OH ]n
四、配合平衡
1.0 0.8
Cd2+
Cd(OH)42-
比 0.6 例
0.4
0.2
Cd(OH)2
CdOH+
Cd(OH)3-
0.0 -10
4
-8 6
-6 8
-4 10
-2 12
0
lg[OH-]
14 pH
Cd2+ - OH- 配合离子在不同pH值下的分布(陈 静生编,1987)
这里将K1,K2称为逐级生成常数(或逐级稳定常数),称β1、β2为 积累稳定常数。
四、配合平衡
2. 羟基对重金属离子的配合作用
Me2 OH MeOH
[MeOH ] ( K1 ) 2 [Me ][OH ]
0
MeOH OH Me(OH)2
0
[Me(OH)2 ] (K2 ) [Me(OH) ][OH ]
二、空气中硫氧化物的转化和硫酸烟雾型污染
伦敦型烟雾与洛杉矶烟雾的比较
项 概 目 况 伦敦型
发生较早(1873年),至今已多次出现
洛杉矶型
发生较晚(1946年),发生光化学反应
污 染物
燃 料
颗粒物、SO2、硫酸雾等
煤
碳氢化合物、Nox、O3、PAN、醛类等
汽油、煤气、石油
气象条件 季 气 湿 日 节 温 度 光 冬 低(4℃以下) 高 弱 低 白天夜间连续 对呼吸道有刺激作用, 夏、冬 高(24℃以上) 低 强 高 白天
-lg[Men+] = -lgKsp - nlg[H+] + nlgKw
pC = pKsp – npKw + npH
合物,在固-液平衡体
系中,一般用溶度积 来表征溶解能力。
三、溶解-沉淀
氢氧化物金属离子饱和浓度对数值与pH值的关系
三、溶解-沉淀
溶解度应该考虑多种因素,例如羟基的配合作用:
金属硫化物是
比氢氧化物溶度积 更小的一类难溶沉 淀物,只要水环境 中存在S2-,几乎所 有的重金属均可以 从水体中除去。
HS- H+ + S2- , K2 = 1.3 × 10-15 H2S 2H+ + S2-
[S2-][H+]2=K1,2[H2S] [S2-]=K1,2[H2S]/[H+]2 [Me2+][S2-]=Ksp [Me2+]=Ksp/[S2-]=Ksp[H+]2/K1,2[H2S] [Me2+]=Ksp[H+]2/K1K2[H2S]
[Pb(II)T=Ks0[H+]2+Ks1[H+]+Ks2+Ks3[H+]-1
三、溶解-沉淀
pH
PbO的溶解度(James F. Pankow, Aquatic Chemistry Concepts, 1991)
三、溶解-沉淀
(2) 硫化物 H2S H+ + HS- , K1 = 8.9 × 10-8
SO2 + HO
M
HOSO2 M O2 NO HO + NO2
