第三章水环境化学.pptx
合集下载
《水环境化学》课件

水环境化学的重要性 和应用
水环境化学对于保护水资 源、维护环境、促进可持 续发展具有重要的意义。
水的物理化学性质
溶解度溶解度是指单位体Fra bibliotek溶液中 最多能溶解多少物质,它是 表征物质在水中溶解程度的 重要参数。
离子强度
水中的离子强度是所有阴离 子和阳离子的浓度之和和它 们的电荷平方和之比的平方 根。
pH值
水环境监测方法
通过水质监测,及时发现水体 污染的情况,采取有效的技术 措施来防治和修复水体污染。
水环境化学的未来
1 水环境化学的发展趋势
未来水环境化学将逐渐转向绿色、可持续和低碳化发展。
2 水环境化学的应用前景
水环境化学需求将继续增长,未来将更多地应用于水资源保护、净化和开发领域。
3 水环境化学的挑战与机遇
水环境化学
水是地球上最珍贵的资源之一,水环境化学是研究水体的化学性质、污染及 其净化和水质监测的学科。
水环境化学简介
什么是水环境化学?
水环境化学是研究水及其 体系在自然界和生产生活 中的各种过程所涉及到的 化学现象的学科。
水环境化学的研究对 象和内容
研究水环境中各种物质的 迁移、转化和去除,以及 不同水环境对生态环境的 影响。
3
物理污染物
有些物理污染物如悬浮物、浮游生物、颗粒物或沉积物都会影响水的质量和可用性。
水的净化与处理
常见水污染物的去除方法
颗粒物、悬浮物主要通过过滤 和沉淀去除,生物污染物主要 通过消毒去除,化学污染物主 要依靠氧化、还原、沉淀和离 子交换等方法除去。
常见水处理技术及其原理
如生物处理、深度处理、反渗 透等技术,利用技术手段将水 中的污染物清除或降低到符合 生产和生活需求的标准。
第三章水环境化学

第三章水环境化学
18
第七节 有机污染物的水环境化学
7.1 有机物污染程度的指标
▪ 溶解氧 DO (dissolved oxygen) 水中溶解的氧的量。
耗氧作用:使 DO 下降,如耗氧有机物分解,生物 呼吸等。
复氧作用:使 DO 增加,如空气中氧的溶解,水生 植物的光合作用。
有机物的氧化分解需要消耗大量的氧,若有机物过多, 会造成水中 DO 量不断减少,可导致有机物缺氧分解而产生 腐败现象。
第三章 水环境化学
第三章水环境化学
1
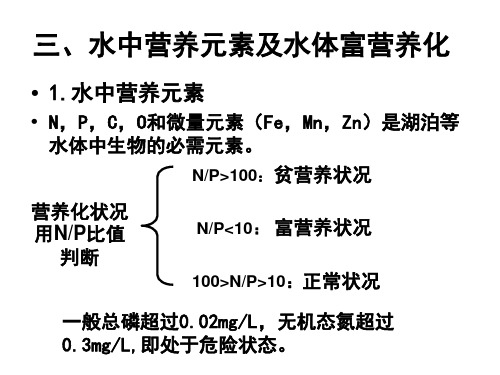
第六节 水体的氮、磷污染和富营养化
水体营养物增加导致水生植物(主要是浮游植 物和各种藻类)大量繁殖,水体溶解氧下降,水质 恶化,鱼类及其它生物大量死亡的现象。
在湖泊、水库、河口、港湾等水流缓慢的地 区最容易发生,是由氮、磷等化合物过多排入水 体所引发的二次污染现象。
第三章水环境化学
3
在适当的温度、光照和环境酸度下,天然水体中的藻 类进行光合作用,合成本身的藻类原生质。
106 CO2 + 16 NO3- + HPO42- + 122 H2O + 18 H+ + 能量 + 微量元素
C106H263O116N16P (藻类原生质) + 138 O2
藻类的繁殖中成为控制性因பைடு நூலகம்的是无机态的氮 和磷营养物。
第三章水环境化学
8
受蓝藻污染的太湖水
工作人员在打捞蓝藻
第三章水环境化学
9
第三章水环境化学
10
云南滇池的蓝藻污染
第三章水环境化学
11
云南滇池的蓝藻污染
第三章水环境化学
12
赤潮
第三章-水环境化学(第一次课)

次要离子:Fe2+、CO32-、HSiO3-、NO2-、 HPO42-、H2PO4-、PO43-
ii 表示方法
总含盐量(Total Dissolved Solids-TDS),也称总矿化度: 水中所含各种溶解性矿物盐类的总量称为水的总含盐量。
总含盐量=Σ阳离子+Σ阴离子
iii 测定
重量法
总含盐量=溶解固形物
cT
[H
2 CO
* 3
](1
K1 [H
]
K1K 2 [H ]2
)
0
[H2CO*3
]
1
cT
(1
K1 [H ]
K1K 2 [H ]2
) 1
说明pH决定它们的 含量多少
1
[HCO
3
]
cT
[H ] (
K1
1
K2 [H
) ]
1
2
[CO32 ] cT
([H ]2 K1K 2
[H ] 1)1 K2
lg c2 H • ( 1 1 ) 15.59103 ( 1 1 ) c1 2.303R T1 T2 2.3038.314 298.15 273.15
c2 8.289 1.778 14.74mg / L
0 ℃时的含量14.74mg/L 20 ℃时为9.227mg/L
2.在一个标准大气压下,25℃时CO2在水中的溶解度。已知 CO2在干空气中的含量为0.0314%(体积)。
氧气的分压为
0.9813105 20.95% 0.2056105 Pa
[G(O2) ] KH PG 1.26108 0.2056105 2.590104 mol / L
[G(O2) ] 2.590104 32 8.289mg / L
ii 表示方法
总含盐量(Total Dissolved Solids-TDS),也称总矿化度: 水中所含各种溶解性矿物盐类的总量称为水的总含盐量。
总含盐量=Σ阳离子+Σ阴离子
iii 测定
重量法
总含盐量=溶解固形物
cT
[H
2 CO
* 3
](1
K1 [H
]
K1K 2 [H ]2
)
0
[H2CO*3
]
1
cT
(1
K1 [H ]
K1K 2 [H ]2
) 1
说明pH决定它们的 含量多少
1
[HCO
3
]
cT
[H ] (
K1
1
K2 [H
) ]
1
2
[CO32 ] cT
([H ]2 K1K 2
[H ] 1)1 K2
lg c2 H • ( 1 1 ) 15.59103 ( 1 1 ) c1 2.303R T1 T2 2.3038.314 298.15 273.15
c2 8.289 1.778 14.74mg / L
0 ℃时的含量14.74mg/L 20 ℃时为9.227mg/L
2.在一个标准大气压下,25℃时CO2在水中的溶解度。已知 CO2在干空气中的含量为0.0314%(体积)。
氧气的分压为
0.9813105 20.95% 0.2056105 Pa
[G(O2) ] KH PG 1.26108 0.2056105 2.590104 mol / L
[G(O2) ] 2.590104 32 8.289mg / L
环境化学课件第三章 水环境化学

水环境可根据其范围的大小分为区域水环境(如流域水环境、城市 水环境等)、全球水环境。对某个特定的地区而言,该区域内的各 种水体如湖泊、水库、河流和地下水等是该水环境的重要组成部分 ,因此,水环境又可分为地表水环境和地下水环境。地表水环境包 括河流、湖泊、水库、池塘、沼泽等;地下水环境包括泉水、浅层 地下水和深层地下水等。
图 水环境体系(水体)
<返回>
水环境化学是研究化学物质在天然水体中的存在形态、反应机制 、迁移转化和归趋的规律及其化学行为对生态环境的影响。水环 境化学是环境化学的重要组成部分,为水污染控制和水资源的保 护提供了科学依据。
水环境化学研究的领域包括河口、海洋、河流、湖泊等。
研究的特点是: (1)体系非常复杂 离子、分子、胶体微粒 (2)界面现象突出、重要 重金属、有机物附着在胶体微粒面
海湾 海
大洋 海洋沉积物间隙水
DP Dg K
P 0
水循环 Water cycle
1.水的自然循环: 特点:①由降雨量自然循环的大致尺度
②水的性质基本不变 2.水的社会循环 特点:①工业与生活污水的产生与排放是主
要的污染源 ②水的性质不断变化
水资源的主要问题
●我国水资源人均和亩均水量少; ●水资源在地区分布上很不均匀,水土资源 组合不平衡 ●水量年内及年际变化大,水旱灾害频繁 ●水土流失严重,许多河流含沙量大; ●我国水资源开发利用各地很不均衡
第三章 水环境化学 Aquatic chemistry
知识点:认识天然水的基本特征和污染物的分布形 态,掌握水中污染物的迁移转化规律,学 会建立水质模型
重 点:水中污染物的迁移和转化规律 难 点:水质模型的建立
水圈:Hydrosphere 1978年.R.A.Horne
图 水环境体系(水体)
<返回>
水环境化学是研究化学物质在天然水体中的存在形态、反应机制 、迁移转化和归趋的规律及其化学行为对生态环境的影响。水环 境化学是环境化学的重要组成部分,为水污染控制和水资源的保 护提供了科学依据。
水环境化学研究的领域包括河口、海洋、河流、湖泊等。
研究的特点是: (1)体系非常复杂 离子、分子、胶体微粒 (2)界面现象突出、重要 重金属、有机物附着在胶体微粒面
海湾 海
大洋 海洋沉积物间隙水
DP Dg K
P 0
水循环 Water cycle
1.水的自然循环: 特点:①由降雨量自然循环的大致尺度
②水的性质基本不变 2.水的社会循环 特点:①工业与生活污水的产生与排放是主
要的污染源 ②水的性质不断变化
水资源的主要问题
●我国水资源人均和亩均水量少; ●水资源在地区分布上很不均匀,水土资源 组合不平衡 ●水量年内及年际变化大,水旱灾害频繁 ●水土流失严重,许多河流含沙量大; ●我国水资源开发利用各地很不均衡
第三章 水环境化学 Aquatic chemistry
知识点:认识天然水的基本特征和污染物的分布形 态,掌握水中污染物的迁移转化规律,学 会建立水质模型
重 点:水中污染物的迁移和转化规律 难 点:水质模型的建立
水圈:Hydrosphere 1978年.R.A.Horne
《水环境化学》PPT课件

总含盐量(TDS):
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO 24
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
常把CO2和H2CO3合并为H2CO3*。
H2CO3*— HCO3-—CO32-体系可用下面 的反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO323
pK0 = 1.46 pK1 = 6.35
pK2 = 10.3
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
(Adsorption Isotherms and Isothermal Equation)
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO 24
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
常把CO2和H2CO3合并为H2CO3*。
H2CO3*— HCO3-—CO32-体系可用下面 的反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO323
pK0 = 1.46 pK1 = 6.35
pK2 = 10.3
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
(Adsorption Isotherms and Isothermal Equation)
第3章:水环境化学

➢湖水中:Na+、Cl-、SO42-占优势; ➢地下水主要离子成分受地域变化影响很大,一般说地下水硬度 高,就是其中Ca2+、Mg2+含量高,对于一些苦水或咸水地区, 地下水中Na+、HCO3-含量较高; ➢河水中所含有的部分Na+和大部分的Ca2+主要分别来源于硅酸 盐和碳酸盐的风化、溶解;水中所含有的SO42-主要来自硫化物矿 物和硫酸盐矿物(如石膏)的溶解。
第3章:水环境化学
举例:水中可溶性金属离子可以多种形态存在。例如,铁可以
Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+、Fe3+等形态存在。这些 形态在中性(pH=7)水体中的浓度可以通过平衡常数加以计算:
Fe3++H2O=Fe(OH)2++H+ [Fe(OH)2+][H+]/[Fe3+]=8.9×10-4
代入亨利定律即可求出氧在水中的摩尔浓度为:
[O2(aq)]= KH·=1.26×10-8×0.2056×105=2.6×10-4 mol/L 氧的分子量为32,因此其溶解度为8.32mg/L。
气 体 溶 解 度 随 温 度 升 高 而 降 低 , 这 种 影 响 可 由 Clausius-Clapeyron (克拉帕龙)方程式显示出:
CO2在水中离解部分可产生等浓度的H+和HCO3-。H+及HCO3-的浓度可 从 CO2的酸离解常数(K1)计算出: CO2+H2O CO2·H2O 亨利常数 KH [C=OP23CO H.232O 4]×10-7molL-1Pa-1
第3章:水环境化学
CO2·H2O HCO3-+H+ 一级电离
第3章:水环境化学
举例:水中可溶性金属离子可以多种形态存在。例如,铁可以
Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+、Fe3+等形态存在。这些 形态在中性(pH=7)水体中的浓度可以通过平衡常数加以计算:
Fe3++H2O=Fe(OH)2++H+ [Fe(OH)2+][H+]/[Fe3+]=8.9×10-4
代入亨利定律即可求出氧在水中的摩尔浓度为:
[O2(aq)]= KH·=1.26×10-8×0.2056×105=2.6×10-4 mol/L 氧的分子量为32,因此其溶解度为8.32mg/L。
气 体 溶 解 度 随 温 度 升 高 而 降 低 , 这 种 影 响 可 由 Clausius-Clapeyron (克拉帕龙)方程式显示出:
CO2在水中离解部分可产生等浓度的H+和HCO3-。H+及HCO3-的浓度可 从 CO2的酸离解常数(K1)计算出: CO2+H2O CO2·H2O 亨利常数 KH [C=OP23CO H.232O 4]×10-7molL-1Pa-1
第3章:水环境化学
CO2·H2O HCO3-+H+ 一级电离
环境化学第三章__水环境化学(PPT)

氧的分压为(1.0130-0.03167)×105×0.2095 =0.2056×105 Pa
第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
水环境化学 ppt课件
(2)金属水合氧化物:
褐铁矿:Fe2O3﹒nH2O
水化赤铁矿:2Fe2O3﹒H2O 得到具有重要胶体作用的:
针铁矿:Fe2O3﹒H2O 水解 [FeOOH]∞聚合无机高分子
水铝石:Al2O3﹒H2O
[Al(OH)3]∞聚合无机高分子
三水铝石:Al2O3﹒3H2O
[MnOOH]∞聚合无机高分子
二氧化硅凝胶:SiO2﹒nH2O
水环境中发现的腐殖质大部分为富里酸这一 类,原因在于易溶于水,来源有二:一部分是水 生植物的分泌物和降解产物;另一部分来自土壤, 由土壤淋溶液和泾流带入水体。河水中腐殖质平 均含量在10~15mg/L,但起源于沼泽地带的河流 其含量要丰富的多。
水体污染
由于人类活动排放的污染物进入河流、湖泊、 海洋或地下水等水体,使水和水体底泥的物理、 化学性质或生物群落组成发生变化,从而降低了 水体的使用价值,这种现象称为水体污染。
水体的自净作用 污水排入水体后,一方面对水体产生污染,
另一方面水体本身有一定旳净化污水能力,即经 过水体的物理、化学与生物的作用,使污染物浓 度逐渐降低,经过一段时间后,水体往往能恢复 到受污染前的状态,并在微生物的作用下分解, 从而使水体由不洁恢复为清洁,这一过程称为水 体的自净过程。
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
藻类疯长; 藻类尸体分解引起水体溶氧下降; 水体发臭; 水生生物死亡; 绿藻和硅藻由蓝藻取代产生藻毒素。
▪举例:触目惊心的赤潮中毒事件
➢赤潮区域内,某些赤潮生物分泌赤潮毒素,污染鱼、贝 类等生物,生物毒素可在这些生物体内蓄积,当毒素的蓄 积量超过人体可接受的水平时,人一旦食用了这些生物, 就会导致疾病发生,甚至会爆发传染病。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常把CO2和H2CO3合并为H2CO3*。
H2CO3*— HCO3-—CO32-体系可用下面的 反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO32-
pK0 = 1.46 pK1 = 6.35 pK2 = 10.33
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32- ]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
带负电荷的高分子弱电解质,多含有– COOH、–OH等。在pH高,离子强度低条 件下,羟基、羧基大多离解,负电荷相互排 斥,构型伸展,亲水性强。
2、水环境中颗粒物的吸附作用
(Adsorption of Particals in Water Environmen) 表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
第一节 天然水的基本特征及污染物的存在形态
一、天然水体的基本特征 (Basic Character of Natural Waters)
1、天然水的组成(Constitution of Natural Waters)
八大离子:
K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-和SO42-
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
3、沉积物中重金属的释放
(Release of Heavy Metals in Sediment)
沉积物中的重金属可能重新进入水 体,这是产生二次污染的主要原因。 不仅对于水生生态系统,而且对于饮 用水的供给都是很危险的。
诱发释放的主要因素:
(1)盐浓度升高; (2)氧化还原条件的变化; (3)降低pH值; (4)增加水中配合剂的含量。
总含盐量(TDS):
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
(Transport and Transformation of inorganic Pollutants)
一、颗粒物与水之间的迁移 (Transport Between Particles and Water)
1、水中的颗粒物的类别
矿物微粒和黏土矿物 金属水合氧化物 腐殖质 悬浮沉积物 其他
腐殖质(Humic Substances)
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
(Adsorption Isotherms and Isothermal Equation)
吸附是指溶质在界面层浓度升高的现象, 水体中颗粒物对溶质的吸附是一个动态 平衡过程。
在一定的温度下,当吸附达到平衡时,颗粒物 表面上的吸附量(G)与溶液中溶质平衡浓度 (C) 之间的关系用吸附等温式表达。
H型( Henry)等温式(直线型)
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
(2)天然水中的碱度和酸度
(Acidity and Alkalinity in Natural Waters)
碱度(Alkalinity)
指水中能与强酸发生中和作用 的全部物质,即接受质子的物质总 量,包括强碱、弱碱及强碱弱酸盐。
测定方法:
酸碱滴定,双指示剂法
H+ + OH- = H2O H+ + CO32- = HCO3H+ + HCO3- = H2CO3
(酚酞终点) (甲基橙终点)
总碱度 = [ HCO3-] + 2[CO32-] + [ OH-] – [H+] 酚酞碱度=[OH-]+[CO32-]-[H2CO3*] – [H+] 苛性碱度= [OH-]- [ HCO3-] - 2[CO32-] – [H+]
酸度 (Acidity)
是指水中能与强碱发生中和作用的全 部物质,亦即放出H+或经过水解能产生H+ 的物质的总量。
二、水中颗粒物的聚集
(Aggregation of Particals in Water)
胶体颗粒的聚集亦可称为凝聚或絮凝。
凝聚:由电介质促成的聚集。
絮凝:由聚合物促成的聚集。
胶体颗粒凝聚方式
(Flocculation Way of Cห้องสมุดไป่ตู้lloid Particulate)
1、压缩双电层的聚集 2、专属吸附凝聚
G kC
式中:K——分配系数
F型(Freundlich)等温式
1
G kC n
用对数表示:
lg G lg k 1 lg C n
L型(Langmuir)等温式
G G0C /( A C)
1/ G 1/ G0 ( A / G0 )(1/ C)
G0—单位表面上达到饱和时的最大吸附量 A—常数
H2CO3*— HCO3-—CO32-体系可用下面的 反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO32-
pK0 = 1.46 pK1 = 6.35 pK2 = 10.33
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32- ]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
带负电荷的高分子弱电解质,多含有– COOH、–OH等。在pH高,离子强度低条 件下,羟基、羧基大多离解,负电荷相互排 斥,构型伸展,亲水性强。
2、水环境中颗粒物的吸附作用
(Adsorption of Particals in Water Environmen) 表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
第一节 天然水的基本特征及污染物的存在形态
一、天然水体的基本特征 (Basic Character of Natural Waters)
1、天然水的组成(Constitution of Natural Waters)
八大离子:
K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-和SO42-
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
3、沉积物中重金属的释放
(Release of Heavy Metals in Sediment)
沉积物中的重金属可能重新进入水 体,这是产生二次污染的主要原因。 不仅对于水生生态系统,而且对于饮 用水的供给都是很危险的。
诱发释放的主要因素:
(1)盐浓度升高; (2)氧化还原条件的变化; (3)降低pH值; (4)增加水中配合剂的含量。
总含盐量(TDS):
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
(Transport and Transformation of inorganic Pollutants)
一、颗粒物与水之间的迁移 (Transport Between Particles and Water)
1、水中的颗粒物的类别
矿物微粒和黏土矿物 金属水合氧化物 腐殖质 悬浮沉积物 其他
腐殖质(Humic Substances)
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
(Adsorption Isotherms and Isothermal Equation)
吸附是指溶质在界面层浓度升高的现象, 水体中颗粒物对溶质的吸附是一个动态 平衡过程。
在一定的温度下,当吸附达到平衡时,颗粒物 表面上的吸附量(G)与溶液中溶质平衡浓度 (C) 之间的关系用吸附等温式表达。
H型( Henry)等温式(直线型)
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
(2)天然水中的碱度和酸度
(Acidity and Alkalinity in Natural Waters)
碱度(Alkalinity)
指水中能与强酸发生中和作用 的全部物质,即接受质子的物质总 量,包括强碱、弱碱及强碱弱酸盐。
测定方法:
酸碱滴定,双指示剂法
H+ + OH- = H2O H+ + CO32- = HCO3H+ + HCO3- = H2CO3
(酚酞终点) (甲基橙终点)
总碱度 = [ HCO3-] + 2[CO32-] + [ OH-] – [H+] 酚酞碱度=[OH-]+[CO32-]-[H2CO3*] – [H+] 苛性碱度= [OH-]- [ HCO3-] - 2[CO32-] – [H+]
酸度 (Acidity)
是指水中能与强碱发生中和作用的全 部物质,亦即放出H+或经过水解能产生H+ 的物质的总量。
二、水中颗粒物的聚集
(Aggregation of Particals in Water)
胶体颗粒的聚集亦可称为凝聚或絮凝。
凝聚:由电介质促成的聚集。
絮凝:由聚合物促成的聚集。
胶体颗粒凝聚方式
(Flocculation Way of Cห้องสมุดไป่ตู้lloid Particulate)
1、压缩双电层的聚集 2、专属吸附凝聚
G kC
式中:K——分配系数
F型(Freundlich)等温式
1
G kC n
用对数表示:
lg G lg k 1 lg C n
L型(Langmuir)等温式
G G0C /( A C)
1/ G 1/ G0 ( A / G0 )(1/ C)
G0—单位表面上达到饱和时的最大吸附量 A—常数
