高中化学电化学专题复 习三池比较1
电化学复习
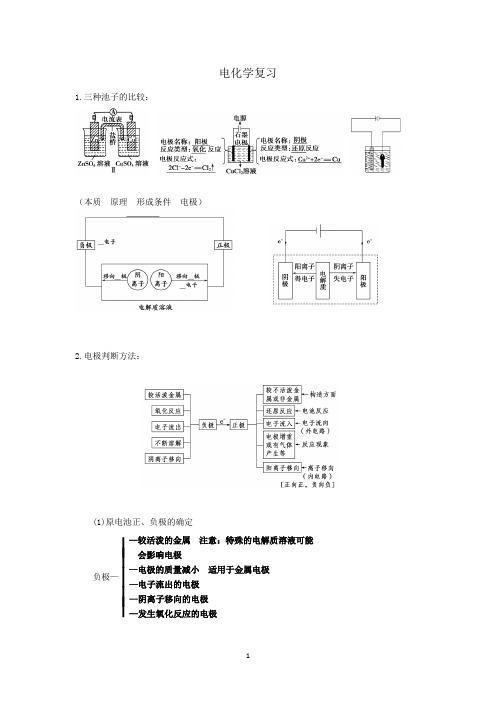
电化学复习1.三种池子的比较:(本质 原理 形成条件 电极)2.电极判断方法:(1)原电池正、负极的确定负极—⎪⎪⎪⎪⎪—较活泼的金属 注意:特殊的电解质溶液可能会影响电极—电极的质量减小 适用于金属电极 —电子流出的电极—阴离子移向的电极—发生氧化反应的电极(2)电解池阴、阳极的确定阴极—⎪⎪⎪⎪⎪—与电源负极相连的电极—电子流入的电极—阳离子移向的电极—质量增加的电极 适用于金属阳离子放电的 电解过程—发生还原反应的电极例1 如图是一个化学过程的示意图。
已知甲池的总反应式为2CH 3OH +3O 2+4KOH===2K 2CO 3+6H 2O请回答:(1)甲池是________池,通入O 2的电极作为________极,电极反应式为___________。
(2)乙池是________池,A 电极名称为________极,电极反应式为________,乙池中的总反应离子方程式为__________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g 时,甲池中理论上消耗O 2________mL(标准状况下);此时丙装置中________(填“c”或“d”)电极析出0.60 g 金属,则丙装置中的某盐溶液可能是________(填序号)。
a .MgSO 4溶液b .CuSO 4溶液c .NaCl 溶液d .AgNO 3溶液3.电极反应式的书写:铅蓄电池 -----------充电接法甲烷燃料电池(酸性 碱性 固体电解质(高温下能传导O 2-) 熔融碳酸盐(如:熔融K 2CO 3)环境 ) ---------弄清正极写法惰性电极电解电解质溶液的规律: (四种类型及复原方法)规律: (1) 原电池电极反应式的书写(2)电解池电极反应式的书写步骤例2一种碳纳米管能够吸附氢气,可作二次电池(如下图所示)的碳电极。
该电池的电解质溶液为6 mol·L-1的KOH溶液,下列说法正确的是A.充电时阴极发生氧化反应B.充电时将碳电极与电源的正极相连C.放电时碳电极反应为H2-2e-===2H+D.放电时镍电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-例3用惰性电极电解一定浓度的CuSO 4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。
电化学专题复习

电化学专题复习考点分析(1)了解原电池原理。
初步了解化学电源。
了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
(2)理解电解原理。
了解铜的精炼、镀铜、氯碱工业反应原理。
典型例析例1、[2004高考江苏] 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO 2(s)+H 2O(l)==Zn(OH)2(s)+Mn 2O 3(s)下列说法错误..的是 A .电池工作时,锌失去电子B .电池正极的电极反应式为:2MnO 2(s)+H 2O(1)+2e —=Mn 2O 3(s)+2OH —(aq)C .电池工作时,电子由正极通过外电路流向负极D .外电路中每通过O.2mol 电子,锌的质量理论上减小6.5g解析:根据电池总反应式,锌发生氧化反应,失去电子作电池的负极,电子经外电路流向正极。
两极的电极反应式为:负极:Zn (s )+2OH -(ag )-2e -=Zn (OH )2(s )正极:2MnO 2(s )+H 2O (l )+2e-=Mn 2O 3(s )+2OH -(ag )电极 放电时,1mol Zn 失去2mol 电子,所以当通过0.2mol 电子时,消耗Zn 的物质的量为0.1mol ,锌的质量减小6.5g 。
答案: C例2.(2005江苏)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为 3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确...的是 A .放电时负极反应为:Zn —2e — +2OH —= Zn(OH)2B .充电时阳极反应为:Fe(OH)3 —3e — + 5 OH — = FeO24 + 4H 2OC .放电时每转移3 mol 电子,正极有1mol K 2FeO 4被氧化D .放电时正极附近溶液的碱性增强【分析】本题属于基本概念与理论的考查,落点在原电池反应的机理及原电池电极反应式书写、简单的氧化还原计算。
电化学复习总结专题-----几种比较

电化学复习专题-----几种比较台州一中吴君磊【高考趋向】关于电化学的内容是历年高考的重要知识点之一,主要以选择题的形式出现,已成高考的常考题。
考查的内容有:原电池、电解池、电镀池的电极名称及电极反应式;根据原电池、电解池的电极变化判断金属活泼性强弱;根据电解时电极变化判断电极材料或电解质种类;新型电池的简单应用;有关电解产物的判断和简单计算。
其中原电池的工作原理、电解产物判断是高考命题的热点。
【教学目标】知识目标:1、通过比较掌握原电池、电解池和电镀池装置的判断。
2、通过比较学会正确判断原电池和电解池的电极。
3、通过比较学会正确书写电极方程式。
能力目标:1、通过主动参与讨论、探究问题,培养分析、概括、表达能力和综合归纳能力。
2、培养学生灵活运用知识的能力。
情感目标:树立矛盾的对立统一等辩证唯物主义观点。
【教学重难点】原电池和电解池的综合判断。
【教学方法】比较法、归纳法。
【教学过程设计】(探究一)原电池与电解池的判断比较1、判断下图是原电池、电解池还是电镀池,为什么?2、判断下图中各装置是原电池还是电解池?[思维延伸一]:下式是爱迪生蓄电池分别在充放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2下列有关蓄电池的叙述中错误的是()A、放电为原电池原理,充电为电解池原理B、放电时,铁是负极,NiO2是正极C、充电时,阴极上的电极反应为Fe(OH)2+2e—=Fe+2OH—D、放电时,电解质溶液中的阴离子是向正极方向移动[思维延伸二]:有人将2Ag + 2HCl = 2AgCl + H2 ↑的反应变为现实,则下列说法正确的是()A、Ag粉撒入稀盐酸中B、Ag、C作电极用导线连接插入稀盐酸中形成原电池C、Ag、Fe作电极,用导线连接插入稀盐酸中D、Ag接电源正极,Fe接电源负极,插入稀盐酸中小结与反思:原电池、电解池判定规律:(1)根据装置判断:若无外接电源,可能是原电池,然后依据原电池的形成条件分析判定;若有外接电源,两极插入电解质溶液中,则可能是电解池。
化学反应与电能 三池(原电池、电解池、电镀池)的辨析比较-高二化学(人教版2019选择性必修1)

[提升1] 如图所示:
锌
(1)当K1、K2断开时,________片上有气泡产生,生成气体对应
+===Zn2++H ↑
Zn+2H
2
的离子方程式为___________________。
铜
(2)仅K 闭合时,________片上有气泡。生成气体对应的反应式为
1
+
-
2H +2e ===H2↑
发生氧化反应为负极(a极),氧气为7正极(b极),电子流向从负
-
到正(a→b),电流方向与电子流动方向相反,C项正确;2Cl
-
-2e ===Cl2↑,为氧化反应,故为阳极反应,D项错误。
C
)
[提升3]组成不同要求条件下的原电池和电解池对下图中两极进行必要的
连接并填空。
A
B
(1)在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫
(2)仅K1闭合时,Zn、Cu和盐酸构成原电池,Cu为正极,电极反应为2H++2e-===H2↑,因此铜片
上产生气体。
(3)此时为电解池,Cu为阳极,失电子,电极反应为Cu-2e-===Cu2+,H+在锌片上得电子产生H2,
通电
总电极反应为Cu+2HCl==CuCl2+H2↑。
[提升2]观察下列几个装置示意图,有关叙述正确的是 (
在某些装置中根据电极反应或反应现象可判断电极,并由此判断电
池类型。如图所示:若C极溶解,D极上析出Cu,B极附近溶液变红,
A极上放出黄绿色气体,则可知乙是原电池,D是正极,C是负极;
甲是电解池,A是阳极,B是阴极。B、D极发生还原反应,A、C极
发生氧化反应。
[典例3] 按如图所示装置进行实验,并回答下列问题:
高三电化学复习专题【教学PPT课件 高中化学优质课】

类型 放O2生酸型 放H2生碱型 电解电解质型
电解H2O型
化学物质
CuSO4、AgNO3、 Cu(NO3)2
KCl、CaCl2` NaCl
CuCl2 HCl
NaNO3、Na2SO4、 K2SO4 KOH
电化学一轮复习
电解池和原电池比较
一、能量转换
原电池 化学能
电解池
电能
二、形成条件
A
Zn
Cu
Pt Pt
CuSO4
NaCl
⑴两种活动性不同的金属作 ⑴两电极接外电源 电极(或金属和能导电的非
金属等)
⑵电解质溶液中(电极插入 ⑵电极插入电解质溶
其中,活泼的金属和电解质 液中
溶液自发的氧化还原反应)
⑶形成闭合回路
④海水电池
负极材料为铝,正极材料为石墨。溶有 氧气的海水作电解质溶液。 负极 4Al-12e- =4Al3+
正极 3O2+6H2O+12e- =12OH-
4Al+3O2+6H2O=4Al(OH)3
⑤锂电池
锂电池的负极反应均为常用 于心脏起搏器的一种微型锂 电池,石墨作正极,电解质 溶液由四氯化铝锂(LiAlCl4) 溶解在亚硫酸氯(SOCl2)中 组成 。
HNO3
pH变化 降低
升高 —
升高 不变 升高 降低
电解池的应用--电解工业
⑴氯碱工业
⑵铝的冶炼
(1)原料的选择 (2)电极反应的书写
原料:Al2O3,Na3AlF6 阳极:6O2--12e-=3O2↑ 阴极:4Al3++12e-=4Al
高中化学电化学知识点总结

电化学复习(一)原电池一、原电池装置特点:化学能转化为电能。
形成条件:①、2个活泼性不同的电极,一般情况下,较活泼者作负极,较不活泼者作正极;②、电解质溶液(一般与活泼性强的电极发生氧化还原反应);③、形成闭合回路(或在溶液中接触)基本概念:负极:用还原性较强的物质作负极,负极失电子;发生氧化反应。
正极:用氧化性较强的物质正极,正极得电子,发生还原反应。
反应原理:铜锌原电池(Cu—Zn)(-):Zn-2e-=Zn2+(+):2H++2e-=2H2↑电解质溶液(如在(NH4)2SO4中)负极(锌)Zn-2e-=Zn2+正极(石墨)2NH4++2e-=2NH3+H2↑二、常见的几种电池①、普通锌—锰(Zn—Mn)干电池:总反应:Zn+2NH4+=Zn2++2NH3+H2↑电解质溶液:糊状的NH4Cl ②、铅蓄电池正极:PbO2+SO42-+4H++2e-=PbSO4+2H2O负极:Pb+SO42--2e-=PbSO4总反应:PbO2+Pb+2H2SO4=2PbSO4+2H2O电解液:H2SO4③、银—锌纽扣电池正极:Ag2O+2e-+H2O=2Ag+2OH-负极:Zn-2e-+2OH-=Zn(OH)2总反应:Ag2O+Zn+H2O=2Ag+Zn(OH)2④、镍—镉电池正极:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-负极:Cd+2OH--2e-=Cd(OH)2总反应:2NiO(OH)+2H2O+Cd=2Ni(OH)2+ Cd(OH)2三、特殊的原电池①、Al与Mg组成的原电池(溶质为NaOH)特殊:Mg的活泼性强于Al却作正极正极:2H2O+2e-=2H2↑+2OH-负极:Al+4OH--3e-=AlO2-+2H2O总反应:2Al+2OH-+2H2O=3H2↑+2AlO2-②、Fe与Cu组成的原电池特殊:Fe的活泼性强于Cu却作正极正极:NO3-+2H++e-=NO2↑+H2O负极:Cu-2e-=Cu2+总反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O四、燃料电池与普通电池的区别:①、不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时电极反应产物不断排出电池。
高三化学一轮复习:电化学专题

高三化学一轮复习:电化学专题高中化学中的电化学部分是一个重点和难点,在高考中占有重要地位。
在高三一轮复习中,我们需要对电化学的知识进行系统梳理和深入理解,为后续的复习和考试打下坚实的基础。
一、电化学的基本概念1、氧化还原反应氧化还原反应是电化学的基础。
在氧化还原反应中,电子发生转移,导致元素的化合价发生变化。
理解氧化还原反应的本质,对于掌握电化学原理至关重要。
2、原电池原电池是将化学能转化为电能的装置。
它由两个半电池组成,通过导线和盐桥相连。
在原电池中,发生氧化反应的一极为负极,发生还原反应的一极为正极。
3、电解池电解池是将电能转化为化学能的装置。
它与电源相连,在阳极发生氧化反应,在阴极发生还原反应。
二、原电池的工作原理1、电极反应以铜锌原电池为例,锌作为负极,失去电子发生氧化反应:Zn 2e⁻= Zn²⁺;铜作为正极,溶液中的氢离子得到电子发生还原反应:2H⁺+ 2e⁻= H₂↑。
2、电子和离子的移动在原电池中,电子从负极经导线流向正极,形成电流。
溶液中的阳离子向正极移动,阴离子向负极移动。
3、原电池的构成条件(1)两个不同的电极,其中一个能与电解质溶液发生自发的氧化还原反应。
(2)电解质溶液。
(3)形成闭合回路。
三、电解池的工作原理1、电极反应以电解氯化铜溶液为例,阳极发生氧化反应:2Cl⁻ 2e⁻= Cl₂↑;阴极发生还原反应:Cu²⁺+ 2e⁻= Cu。
2、电解池的构成条件(1)直流电源。
(2)两个电极(惰性电极或活性电极)。
(3)电解质溶液。
(4)形成闭合回路。
四、电化学中的电极判断1、原电池电极判断(1)根据电极材料的活泼性判断,较活泼的金属为负极。
(2)根据电子流动方向判断,电子流出的一极为负极。
(3)根据氧化还原反应判断,发生氧化反应的一极为负极。
2、电解池电极判断(1)与电源正极相连的为阳极,与电源负极相连的为阴极。
(2)根据发生的反应判断,发生氧化反应的为阳极,发生还原反应的为阴极。
2021-2022高考化学备考专项汇编——专题精讲-电化学基础

近几年全国卷高考化学试题中均涉及电化学知识,并且试题的背景较为新颖,对考生分 析问题的能力提出了较高要求。
本专题知识在高考题型中选择、填空都有,考查知识点集中。
预测在 2021 年的高考命题中该部分仍是命题的热点,在题型上仍以传统题型为主,其中原 电池的工作原理及其电极反应式的书写,电解产物的判断及电池反应方程式的书写,离子的 移动方向,溶液 pH 的变化是高考命题的热点,特别需要注意的是原电池、电解池装置的绘 图,金属的腐蚀和绿色能源的开发。
1.“三池”的判断技巧: 原电池、电解池、电镀池判定规律:若无外接电源,可能是原电池,然后依据原电池的 形成条件分析判定,若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。
当 阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其他情况为电解池。
2.用惰性电极电解电解质溶液时,若使电解后的溶液恢复原状态,应遵循“缺什么加什 么,缺多少加多少”的原则。
一般加入阴极产物与阳极产物的化合物。
3.三个相等: ①同一原电池的正、负极的电极反应得、失电子数相等。
②同一电解池的阴极、阳极电极反应中得、失电子数相等。
③串联电路中的各个电极反应得、失电子数相等。
4.四个对应: ①正极和负极对应。
②阳极和阴极对应。
③失电子和得电子对应。
④氧化反应和还原反应对应。
5.电解时电极产物的判断——“阳失阴得”,即1.【2020•新课标Ⅰ卷】科学家近年发明了一种新型 Zn−CO2 水介质电池。
电池示意图 如图,电极为金属锌和选择性催化材料,放电时,温室气体 CO2 被转化为储氢物质甲酸 等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( ) A.放电时,负极反应为 Zn-2e-+4OH-=Zn(OH)42+ B.放电时,1 mol CO2 转化为 HCOOH,转移的电子数为 2 mol C.充电时,电池总反应为 2Zn(OH)42+=2 Zn+O2↑+4OH-+2H2O D.充电时,正极溶液中 OH−浓度升高8.【参考答案】D 【试题解析】由题可知,放电时,CO2 转化为 HCOOH,即 CO2 发生还原反应, 故放电时右侧电极为正极,左侧电极为负极,Zn 发生氧化反应生成 Zn(OH)42+;充电 时,右侧为阳极,H2O 发生氧化反应生成 O2,左侧为阴极,Zn(OH)42+发生还原反应 生成 Zn。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
煌敦市安放阳光实验学校电化学专题复习:三池比较
所谓“三池”,就是指“原电池”、“电解池”和“电镀池”。
1.原电池
(1)概念将化学能转化成电能的装置
(2)构成的条件
①能自发地发生氧化还原反;②形成闭合回路(方式有:直接接触、导线相连接);
③电解质溶液(参与或支持反同时还兼导电作用);④两个电极(一般是活动性不同的两金属)
(3)电极的名称
负极:较活泼的金属(电子流出的电极或者是电解质溶液中的阴离子流向的电极);
正极:较不活泼金属或者是能导电的非金属(电子流入的电极或者是电解质溶液中的阳离子
流向的电极)
(4)电极上发生的化学反
负极:发生氧化反,金属失去电子;
正极:发生还原反,溶液中的阴离子得到电子或者是氧气得电子(发生吸氧腐蚀)
(5)装置中的电子流向负极正极
2. 电解池
(1)概念:将电能转化为化学能的装置
(2)构成的条件
①形成闭合回路;②两电极插入电解质溶液中;③两电极连接直流电源(3)电极的名称
阳极:与直流电源正极相连的电极;
阴极:与直流电源负极相连的电极
(4)电极上发生的化学反
阳极:电解质溶液中的阴离子(或者是金属电极)失去电子发生氧化反;阴极:电解质溶液中的阳离子得到电子发生还原反
(5)装置中的电子流向
电源的负极→阴极→电解质溶液→阳极→电源的正极(离子移动的方向:阳离子向阴极移动;阴离子向阳极移动)
3.电镀池
(1)概念:利用电解原理在某些金属表面镀上一层其它金属或者合金的装置(2)构成的条件
①镀层金属连接电源正极,待镀金属连接电源负极;②电镀液必须含有镀层金属的离子
(名称与电解池相同,但有限制条件)
(3)电极的名称
阳极:必须是镀层金属;
阴极:镀件
(4)电极上发生的化学反
阳极:金属电极失去电子;
阴极:电镀液中的阳离子得到电子
(5)装置中的电子流向与电解池相同
备注:(1)同一原电池的正、负极的电极反得失电子数相。
(2)同一电解池的阳极、阴极的电极反中得失电子数相。
(3)串联电路中的各个电极反得失电子数相。
***铜的电解精炼原理:粗铜作阳极,纯铜作阴极。
思考阳极泥?
常见的电池反:
1.氢氧燃料电池:其电池总反方程式不随电解质的状态和电解质溶液的酸碱性
变化而变化,即2H2+O2=2H2O。
(酸性介质)(中性介质)(碱性(KOH)介质)
负极:2H2 - 4e- = 4H+负极:2H2 - 4e- = 4H+ 负极(Ni):2H2-4e+4OH-=4H2O
正极:4H+ + O2 = 2H2O 正极:O2 + 4e- + 2H2O = 4OH- 正极(Ni):O2+2H2O+4e-=4OH-
总反:2H2+ O2= 2H2O 总反:2H2+ O2= 2H2O 总反: 2H2+O2=2H2O 2. 一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
(稀硫酸作电解液)(KOH作电解液)负极:2CH3OH+2H2O-12e-=2CO2↑+12H+负极:CH4+10OH--8e-=CO32-+7H2O 正极:3O2+12H++12e-=6H2O 正极:O2+2H2O +4e-=4OH-总反:2CH3OH+3O2=2CO2+4H2O 总反:CH4+2OH-+2O2=CO32-+3H2O
3. 某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。
负极:2C4H10+26CO32--52e-=34CO2+10H2O
正极:O2+2CO2 +4e-=2CO32-
总反:2C4H10+13O2=8CO2+10H2O
4. 铅蓄电池充、放电化学反的原理方程式
(放电过程)(充电过程)负极:Pb-2e- +SO42-=PbSO4阴极:PbSO4 +2e- = Pb+ SO4 2-
正极:PbO2+2e-+SO42-+4H+= PbSO4+2H2O 阳极:PbSO4+2H2O-2e-= PbO2+S O42-+4H+
总反:PbO2+2H2SO4+Pb = 2PbSO4+2H2O 总反:2PbSO4+2H2O= PbO2+2H2SO4+ Pb
5. 海水电池负极材料:Al;正极材料:石墨能导电的惰性材料或活泼性比铝弱的金属材料。
负极:4Al -12e-=4Al3+
正极:3O2 + 6H2O +12e- = 12OH-
总反为:4Al +3O2 + 6H2O=4Al(OH)3
针对练习:
1. 能够使反Cu+2H2O=Cu(OH)2↓+H2↑发生的是
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠水溶液
D.用铜片作阴、阳电极,电解硫酸铜水溶液
2. 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为1︰1。
用石墨
做电极电解该溶液时,下列叙述不正确
...的是
A.阴极只析出H2B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水D.溶液pH不断增大,最后为7
3. 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂一KNO3的U型管)构成—个原电池(如图)。
以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反为:Ag+ + e- = Ag
③过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反与该原电池反相同
A.①② B.②③ C.②④ D.③④
4. 一种型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化
钆(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。
下列对燃料电池说法正确的是()点燃
A.在熔融电解质中,O2—由负极移向正极 B.电池的总反是:2C4H10+13O 2 8CO2+10H2O
C.通入空气的一极是正极,电极反为:O2+4e—=2O2—
D.通入丁烷的一极是正极,电极反为:2C4H10+26e-+13O2-=4CO2+5H2O 5.LiFePO4电池具有稳性高、安全、对环境优点,可用于电动。
电池反为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。
下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性 B放电时电池内部Li+向负极移动.
C.充电过程中,电池负极材料的质量减少
D.放电时电池正极反为:FePO4+Li++e-=LiFePO4
6.将镁片、铝片平行插入到一浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是 ( )
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即
有白色沉淀生成
C.该装置的内、外电路中,均是电子的向
移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
7.按右图的装置进行电解,A极是铜锌合金,B极是纯铜。
电解质溶液中含有足量的Cu2+。
通电一段时间后,若A极恰好溶解,此时B 极质量增加7.68g,溶液质量增加0.03g,A极合Cu、Zn的原子个数比为A. 4:1 B 3:1 C. 2:1 D.5:3
8.用惰性电极电解一浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。
则电解过程中转移的电子数为( )
放电
充电
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
9.下列叙述不正确
...的是
A.Fe(OH)3体进行电泳,阴极附近颜色加深
B.在熔融态能导电的物质,该物质中一含有离子键
C.用渗析的方法可以除去蛋白质溶液中混有的少量NaCl
D.铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜
10. 以Pt为电极,电解含有0.10 mol Cu2+和0.10 mol M3+的溶液,阴极析出
固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见图示。
则离
子的氧化能力由大到小排列正确的是
A.Cu2+>M3+>H+;
B.Cu2+>H+>M3+;
C.M3+>H+>Cu2+;
参考答案:
1. C
2. D
3.C
4.C
5.D
6.D
7.B
8.D
9.B 10. B。
