高考热点专题测试卷 无机推断题(附答案)
高中化学10道无机推断练习题(附答案)

高中化学10道无机推断练习题_一、推断题1.某课外学习小组对日常生活中不可缺少的调味品M进行探究。
已知C可在D中燃烧发出苍白色火焰。
M与其他物质的转化关系如下图所示(部分产物、反应条件已略去):(1)常温下,用惰性电极电解M溶液(足量)发生反应的离子方程式为___________________,电解一段时间后,让溶液复原的方法为______________________,若M溶液为0.5L,电解一段时间后,两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH为________(忽略溶液的体积变化)。
(2)若A是一种常见的难溶于水的酸性氧化物,可用于制造玻璃,则E溶液的俗称是_____________。
(3)若A是CO2气体,将一定量的A通入B溶液,得到溶液W,再向溶液W中滴入盐酸,相关量如图所示,则溶液W中的溶质及其物质的量分别为__________________、______________________。
(4)若A是一种化肥。
A和B反应可生成气体E,E与D相遇产生白烟,工业上可利用E与D的反应检查输送D的管道是否泄漏,是因为E与D可发生反应:____________________(写化学方程式)。
2.已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是_____________________,化学方程式为______________________。
(3)A和水反应生成B和C的离子方程式为_______________,列出A的一种重要用途_________。
(4)反应①的离子方程式为________________________。
3.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F 为红褐色沉淀。
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:(1)写出下列物质的化学式:B 、丙、乙。
(2)写出下列反应的化学方程式:反应①;反应⑤;反应⑥。
【答案】(1) Al HCl Cl2[(2) ① 2Na+2H2O=2NaOH+H2↑⑤2FeCl2+Cl2=2FeCl3⑥3NaOH+FeCl3=Fe(OH)3↓+3NaCl【解析】由金属A焰色反应为黄色知A为钠,则甲为氢气,D为氢氧化钠,B为铝,乙为黄绿色气体,则乙为氯气,丙为氯化氢,E为稀盐酸,H为黄褐色沉淀氢氧化铁,所以C为铁,F为氯化亚铁,G为氯化铁。
所以,(1)B:Al、乙:Cl2、丙:HCl;(2)反应①的方程式:2Na+2H2O=2NaOH+H2↑反应⑤方程式:2FeCl2+Cl2=2FeCl3反应⑥方程式:3NaOH+FeCl3=Fe(OH)3↓+3NaCl【考点】考查物质的推断、化学式、化学反应方程式的书写2.在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
回答下列问题:(1)写出反应②的化学反应方程式,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。
则反应①的化学方程式是。
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种无色的气体,且B遇盐酸产生无色无味的气体。
在加热条件下,当A过量时,反应①的离子方程式是。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。
则A过量时反应①的离子反应方程式是。
【答案】(1)2Na2O2+2H2O=4NaOH+O2↑(2分) 0.2mol(2分)(2)Cl2+2NaOH=NaCl+NaClO+H2O(2分)(3)NH4++HCO3-+2OH-NH3↑+CO32-+2H2O(2分)(4)AlO2-+4H+=Al3++2H2O(2分)【解析】E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.(1)设该反应转移电子的物质的量xmolNa2O2+2H2O="4NaOH" + O2↑转移电子数22.4L 2mol2.24L x x=0.2mol,(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,A是氯气,与碱反应,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O(3)B是一种酸式盐,且B遇盐酸有无色无味气体产生,所以B是碳酸氢盐, D是一种气体,强碱与酸式盐反应生成气体,该气体是氨气,所以A、B的反应是强碱和碳酸氢铵的反应,故答案为:2OH-+NH4++HCO3-=NH3↑+2H2O+CO32-(4)B是一种含有两种金属元素的盐,所以B是偏铝酸钠,A是一种强酸,酸先和偏氯酸钠反应生成氢氧化铝,氢氧化铝和过量的酸反应生成铝离子,故答案为:AlO2-+4H+=Al3++2H2O.【考点】考查阿伏伽德罗常数、气体体积等相关知识。
高考化学无机化学常考题型:无机化学推断题精选【答案+解析】

高考高高高高高高高高高高高高高高高高高高精选一、单选题(本大题共20小题,共40分)1.甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是()A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸C. 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色2.甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),如表各组物质中不能按图示关系转化的是()选项物质转化关系甲乙丙丁A NaOH NaHCO3Na2CO3CO2B C CO CO2O2C Fe Fe(NO3)3Fe(NO3)2HNO3D AlCl3NaAlO2Al(OH)3NaOHA. AB. BC. CD. D3.元素A、B、C、D分别位于三个不同短周期,且原子序数依次增大.只有D为金属元素,它们可形成x、y、z、w四种常见的二元化合物及p、q两种常见三元化合物,它们之间存在如下转化关系;,,其中z 为液体、w为气体,其余均为固体.下列有关说法正确的是()A. 原子半径大小顺序:D>C>B>AB. y、p 中均只含有离子键C. B、D两元素最高价氧化物对应水化物分别为强酸、强碱D. p能抑制水的电离而q能促进水的电离4.A、B、C、D、E五种物质均含有同一元素,且A为单质,有如图所示的转化关系.则下列判断不正确的是()A. 若ABCDE中同一元素的价态均不相同,则A为气态单质B. 若A 为金属钠,则由ImolD 完全反应生成C 时,一定有1mol 电子转移C. 若A 为非金属硫,则④的反应类型既可以是氧化还原反应又可以是复分解反应D. 若A 为金属铁,则化合物C 和D 均可以由化合反应生成5. A 、B 、C 、D 是中学化学常见物质,其中A 、B 、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )A. 若D 为H 2O ,A 为碳,则A 和C 反应生成1 mol B 转移的电子数为N AB. 若D 为Fe ,A 为CI 2,则B 溶液蒸干后可得到纯净的B 固体C. 若D 为O 2,A 为碱性气体,则以上转化只涉及两个氧化还原反应D. 若D 为HCl ,A 为Na 2CO 3,则B 溶液中c(Na +)=c(HCO 3−)+2c(CO 32−+c(H 2CO 3)6. 在给定的条件下,下列选项所示的物质间转化均能实现的是( ) A.漂白粉 B.C. Al →NaOH 溶液NaAlO 2→过量盐酸Al(OH)3D. 饱和NaCl 溶液→NH 3,CO 2NaHCO 3→△Na 2CO 37. 工业上用铝土矿(主要成分为Al 2O 3,含SiO 2、Fe 2O 3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是( )A. 试剂X 为稀硫酸,沉淀中含有硅的化合物B. 反应II 中生成Al(OH)3的反应为:CO 2+AlO 2−+2H 2O =Al(OH)3↓+HCO 3−C. 结合质子(H +)的能力由弱到强的顺序是OH −>CO 32−>AlO 2−D. Al 2O 3熔点很高,工业上还可采用电解熔融AlCl 3冶炼Al。
高中化学无机推断题带答案
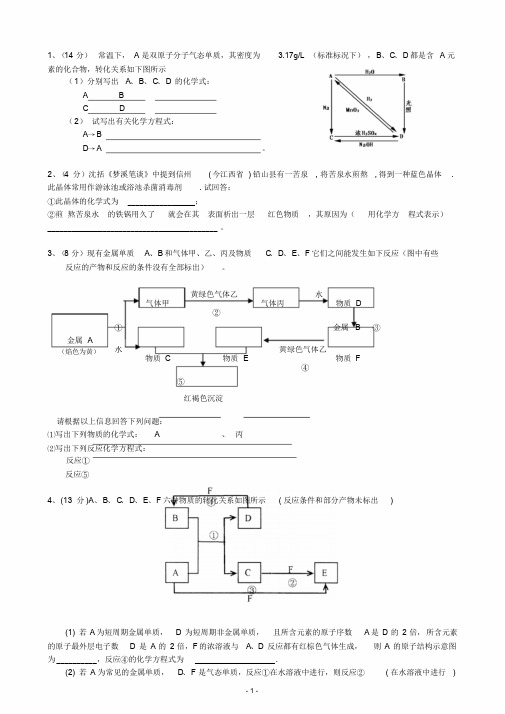
1、(14 分)常温下, A 是双原子分子气态单质,其密度为 3.17g/L (标准标况下),B、C、D 都是含 A 元素的化合物,转化关系如下图所示(1)分别写出A、B、C、D的化学式:A BC D(2)试写出有关化学方程式:A→BD→A 。
2、(4 分)沈括《梦溪笔谈》中提到信州(今江西省) 铅山县有一苦泉, 将苦泉水煎熬, 得到一种蓝色晶体. 此晶体常用作游泳池或浴池杀菌消毒剂. 试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________ 。
3、(8 分)现有金属单质A、B 和气体甲、乙、丙及物质C、D、E、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙水气体甲气体丙物质 D②①金属 B ③金属 A(焰色为黄)水黄绿色气体乙物质 C 物质 E 物质 F④⑤红褐色沉淀请根据以上信息回答下列问题:⑴写出下列物质的化学式: A 、丙⑵写出下列反应化学方程式:反应①反应⑤4、(13 分)A、B、C、D、E、F 六种物质的转化关系如图所示( 反应条件和部分产物未标出)(1) 若A 为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数 A 是D的2 倍,所含元素的原子最外层电子数D是A的2 倍,F 的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________.(2) 若A 为常见的金属单质,D、F 是气态单质,反应①在水溶液中进行,则反应②( 在水溶液中进行)- 1 -的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________ .(3) 若A、D、F 都是短周期非金属元素单质,且A、D所含元素同主族,A、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5. (10 分)短周期常见元素形成的纯净物A、B、C、D、E 的转化关系如下图所示,物质 A 与物质 B 之间的反应不在溶液中进行( E 可.能.与A、B两种物质中的某种相同)。
[实用参考]高中化学无机推断题带答案.doc
![[实用参考]高中化学无机推断题带答案.doc](https://img.taocdn.com/s3/m/cfa3aa29561252d380eb6e88.png)
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式: A B C D(2) 试写出有关化学方程式:A →BD →A 。
2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些⑴写出下列物质的化学式:A 、 丙⑵写出下列反应化学方程式:反应①反应⑤4、(13分)A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________.(3)若A 、D 、F 都是短周期非金属元素单质,且A 、D 所含元素同主族,A 、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5.(10分)短周期常见元素形成的纯净物A 、B 、C 、D 、E 的转化关系如下图所示,物质A 与物质B 之间的反应不在溶液中进行(E 可能..与A 、B 两种物质中的某种相同)。
高中化学无机推断试题附答案

无机推断1、根据以下反响框图填空,反响①是工业上生产化合物D的反响,反响⑤是实验室鉴定化合物 E 的反响。
1〕单质L是_______________。
2〕化合物B是_____________。
3〕图中除反响①外,还有两个用于工业生产的反响是___ ___和_____ __〔填代号〕化学反响方程式分别是_____________ ___和_______ _____________。
2、物质的转化关系如以下列图所示〔有的反响可能在水溶液中进行〕。
其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
〔1〕假设A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中参加HNO3酸化的AgNO3溶液有白色沉淀生成。
那么①工业上反响II 在中进行〔填设备名称〕,工业上反响III 用于吸收E的试剂是。
②D的水溶液呈性〔填“酸〞、“碱〞或“中〞〕③反响I的化学方程式是。
〔2〕假设甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液,并使它们接近,有大量白烟生成。
那么①金属乙的原子结构示意图。
②写出B和甲反响的离子方程式:。
③写出A与O2反响的化学方程式:。
3、X、Y、Z为三种由短周期元素构成的粒子,每mol粒子都有10mol电子,其结构特点如下:X Y Z原子核数单核四核双核粒子的电荷数1个单位正电荷0 1个单位负电荷物质A由X、Z构成,B、C、D、K都是单质,反响①~⑤都是用于工业生产的反响,各有关物质之间的相互反响转化关系如以下列图所示:(1)A的化学式为;D的名称为。
(2)完成以下反响的离子方程式:反响①。
反响④。
〔3〕假设J气体浓度过高可导致高铁血红蛋白血症,且污染大气等。
但J也有不少的用途,如〔举出一例〕。
高中4、无机框下中学化学中几种常物的化关系〔局部物已略去〕 。
:A 、C 、D 是常的气体,F 气体极易溶于水,且液常做致冷。
A①AFBCG电解③B 溶液D②④EF〔1〕写出F 的化学式,G 的的水溶液呈 性〔填“酸〞、“碱〞或“中〞〕2〕定G 中阳离子的方法和象__________________________________;〔3〕D 和E 溶液反,生成一种常的消毒和漂白的有效成分,写出D+E 溶液反的离子方程式和③的化学方程式、。
全国高考化学无机非金属材料的推断题综合高考真题分类汇总及答案解析

全国高考化学无机非金属材料的推断题综合高考真题分类汇总及答案解析一、无机非金属材料练习题(含详细答案解析)1.对于足球烯C60的认识错误的是()A.是分子晶体B.含有非极性共价键C.存在同素异形体D.结构稳定,难以发生化学反应【答案】D【解析】【分析】【详解】A.C60之间的相互作用力是范德华力,属于分子晶体,A正确;B.足球烯中既有双键又有单键,化学键是共价键,且是非极性共价键,B正确;C.金刚石、石墨、足球烯都是碳的同素异形体,所以足球烯存在同素异形体,C正确;D.足球烯是属分子晶体,在常温下,碳碳之间键能大,也比较稳定,但其易发生加成反应,D错误;答案选D。
2.下面关于硅的叙述中,正确的是( )A.硅的非金属性比碳强,只有在高温下才能跟氢气起化合反应B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位C.硅的化学性质不活泼,在自然界中可以以游离态存在D.硅在电子工业中,是重要的半导体材料【答案】D【解析】【分析】【详解】A.硅的非金属性比碳弱,A项错;B.硅在地壳中的含量在所有的元素中居第二位,排名前四位的是O、Si、Al、Fe,所以B 项错;C.硅在自然界中是以化合态存在的,所以C项也错;答案应选D。
3.下列说法不正确的是A.氧化镁熔点很高,可作为优质的耐高温材料B.有色玻璃就是某些胶态金属氧化物分散于玻璃中制成C.溴化银可用于感光材料,也可用于人工降雨D.分子筛可用于物质分离,还能作干燥剂和催化剂【答案】C【解析】【分析】【详解】A.氧化镁是离子化合物,离子键很强,所以氧化镁熔点高,可作耐高温材料,故A正确;B.某些金属氧化物呈现特殊的颜色,分散于玻璃中即可制得有色玻璃,故B正确;C.溴化银不稳定,见光易分解,可用于制感光胶卷,碘化银可用于人工降雨,故C错误;D.分子筛中有许多笼状空穴和通道,具有强吸附性,可用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等,故D正确;故答案:C。
高中化学无机推断题带答案

。
(3) 反应④的化学方程式为:
。
(4) 写出离子方程式分别为:反应②
;
反应⑤
。
(5) 反应①中,每 1.00g C 与足量的 F 作用,恢复到 25℃放出 55.6kJ 热量,写出反应①的热化学方程
式。
。
7、下图是由短周期元素组成的物质之间的转化关系。其中,
A 的相对分子质量为 144,反应①中生成 C、D
物质的量之比为 3 : 1, D 是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,
F、 G 是气态
非金属单质, K 是一种常见的非极性有机溶剂,密度比水大。 (某些生成物和反应条件已略去)
-2-
H 2O A
①
电解 B溶液 ②
F
C
③
K
D
H
E
④
F
I
G
⑤
H
J
D
⑥
⑦
( 1) A 的化学式是
;
( 2) E 中金属阳离子的检验方法
14.( 8 分)已知 A 为常见金属, X、 Y 为常见非金属, X、E、 F、 G常温下为气体, C为液体, B 是一种盐,
受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)
。现用 A 与石墨作电极, B 的浓溶
液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物
10.16g 固体
12、( 10 分)有下列物质之间的相互转化
D
红棕色气体 O2
NaOH E
O 2、△
B
F
A
催化剂
金属
刺激性
C
气体
无色液体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考热点专题测试卷:专题五 无机推断题说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.第Ⅰ卷(共83分)一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中. 1.1995年美国教授Lagow 报道,他制得了碳的第四种同素异形体——链式炔碳:ΛΛC C C C C C 该物质的一个分子中含300-500个碳原子,性质很活泼.据此判断链式炔碳的熔点,估计比石墨( )A .高B .低C .相等D .无法判断2.过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾、硫酸锰、水和氧气.如果过氧化氢中的氧原子是示踪原子(O 18),当反应完全后,含有示踪原子的物质是( )A .硫酸钾B .硫酸锰C .氧气D .水3.在含有不同离子的四种溶液中,加过量盐酸得到了白色沉淀,过滤,在滤液中加过量氨水又得到白色沉淀,过滤,在滤液中加入3NaHCO 溶液仍得到白色沉淀的是( ) A .+Ag 、+2Cu、+2CaB .+Ag 、+2Ba、+2CaC .+2Ba、+Ag 、-2AlO D .+3Al、+2Mg、+2Ba4.欲同时对农作物施用含N 、P 、K 三种元素的化肥,现有:( )①32CO K ②KCl ③242)PO Ca(H ④424SO )(NH ⑤氨水,最适合的组合是 A .①③④ B .②③④ C .①③⑤ D .②③⑤ 5.下列各组物质中,两者互为同分异构体的是( )①O 5H CuSO O 3H CuSO 2424⋅⋅和 ②224)CO(NH CNO NH 与③COOH CH NH NO H C 22252和 ④342]Cl )O [Pu(H 与Cl O 2H ]Cl )O [Pu(H 2222⋅⋅ A .①②③ B .②③④ C .②③ D .③④二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中. 6.右图示为白磷在空气中充分燃烧后,生成物分子的结构示意图.其中圆圈表示原子,实线表示化学键.下列关于该生成物的叙述中不正确的是( )A .生成物的化学式为104O PB .分子中磷原子排列成正四面体型C .单实线表示的化学键为极性键,双实线表示的为非极性键D .分子中每个磷原子都处于一个正四面体的中心7.最近,科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是( ) A .硬度比生铁低 B .在潮湿的空气中放置不易生锈C .与1L mol 4-⋅盐酸的反应速率比生铁快 D .在冷的浓42SO H 中可钝化8.某白色固体可能由①Cl NH 4 ②3AlCl ③NaCl ④3AgNO ⑤KOH 中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成.对原固体的判断不正确的是( )A .肯定存在①B .至少存在②和⑤C .无法确定是否有③D .至少存在①、④、⑤ 9.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性 ②使用时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣物.其有效成分可能是( )A .2ClB .2SOC .NaClOD .4KMnO 10.某溶液中加入过量稀42SO H 后,有S 和32SO H 生成,则原溶液中可能含有:( )A .322O S NaB .32SO Na 和S Na 2且物质的量比值小于21C .32SO Na 和S Na 2且物质的量比值大于21D .322O S Na 和S Na 2且物质的量比值小于2111.在一种酸性溶液中可能存在+3Fe 、-3NO 、-Cl 、-I 中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )A .一定含有-I ,不能确定是否含有-ClB .可能含有-3NO 、-Cl 和-I C .可能含有-3NO D .不含有+3Fe12.向明矾溶液中滴入2)Ba(OH 溶液,当-24SO 恰好沉淀完全时,铝元素主要存在形式是( ) A .3)Al(OH 和+3Al,且3)Al(OH 较多 B .-2AlO 和+3Al,且-2AlO 较多C .3)Al(OH 和-2AlO 且3)Al(OH 较多 D .3)Al(OH 和-2AlO 且-2AlO 较多 13.下列分子结构中,原子最外层电子不能都满足8电子结构的是( )A .3PClB .2NOC .2CSD .)(2COCl 光气三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.14.硫酸铜晶体(O 5H CuSO 24⋅)在t ℃时可部分失水得到O 3H CuSO 24⋅和O H CuO 24⋅现将一定质量硫酸铜晶体,加热到t ℃一段时间后,冷却、称量,质量减轻21.6%.若所得固体只由两种成分组成,则这两种成分不可能的一组是( )A .O 5H CuSO 24⋅;O 3H CuSO 24⋅B .O 3H CuSO 24⋅;O H CuSO 24⋅C .O 5H CuSO 24⋅;O H CuSO 24⋅D .O 3H CuSO 24⋅;4CuSO15.某氮的气态氧化物15.6L 和过量的氢气混合,在一定条件下反应,使之生成液态水及无公害气体,恢复到原状态,反应后气体体积比反应前气体体积缩小了46.8 L ,则原氮的氧化物的化学式为( ) A .2NO B .32O N C .NO D .O N 216.已知反应:---+=+I ])[Ag(CN 2CN AgI 2,把3KNO 、3)Al(OH 、3BaCO 、CuS 和AgI 的混合物按加入试剂的先后顺序,将其逐一溶解,最适宜的一组试剂是( ) A .O H 2、3NaHCO 溶液、盐酸、氨水、硝酸 B .氨水、32CO Na 溶液、稀硫酸、稀硝酸、KCN 溶液 C .3NaHCO 溶液、稀硫酸、KCN 溶液、NaOH 溶液、氨水 D .O H 2、NaOH 溶液、盐酸、KCN 溶液、硝酸17.在下图的甲、乙两个装置的烧瓶中盛有同一种红棕色气体M ,用弹簧夹夹住橡皮管,烧杯中盛有水.向甲烧杯中加入X ,甲烧瓶中气体颜色变浅;向乙烧杯中加入Y ,乙烧瓶中气体颜色变深;下列关于气体M 与X 、Y 的组合正确的是( )ABCDM 2NO2NO2Br2BrXNaOH 固体硝铵固体冰块碱石灰Y 无水乙醇 生石灰 浓硫酸 醋酸铵18.为了实现我国政府在1997年12月31日前对淮河流域环境的治理,某甲、乙两相邻的工厂做了横向联合.已知两厂排放的污水经初步处理后,只溶有+Ag 、+2Ba、+3Fe 、+Na 、-Cl 、-24SO 、-3NO 、-OH 中的各不同的4种离子(设各离子浓度比较大),若单独排放仍会造成环境污染,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的硝酸钠溶液排出,则污染程度会大为降低.你认为下列分析判断正确的是( ) A .-24SO 和-3NO 可存在于一工厂 B .-Cl 和-3NO 一定在不同的工厂 C .+Ag 和+Na 可能在同一工厂 D .+Na 和-3NO 来自同一工厂19.有一种混合气体,它可能由CO 、2CO 、2SO 、HCl 中的一种或多种气体组成.该气体依次通过下列物质的现象如下:通过澄清石灰水无白色沉淀析出;通过品红溶液,溶液红色褪去;通过炽热的CuO ,固体变为红色;通过澄清石灰水,出现白色沉淀.该混合气体组成的各说法中,正确的是( ) A .肯定不含有2CO B .只含有2SO 和COC .含有2SO 、CO 和2CO ,可能含HClD .含HCl 、2SO 和CO ,可能含2CO20.某铁的氧化物,用7 mol/L 的盐酸100 mL 在一定条件下恰好完全溶解,所得溶液再通入0.56 L 标准状况下的氯气时,刚好使溶液中+2Fe 完全转化为+3Fe .则该氧化物的化学式可表示为( ) A .FeO B .43O Fe C .54O Fe D .75O Fe21.有A 、B 、C 三种气体分别是2Cl 、HCl 、HI 中的一种,但不知道它们具体是什么气体.将A 、B 混合不反应,则下面正确的判断是( )A .A 、B 能确定 B .C 肯定不是HCl C .C 可能是HClD .C 不是2Cl 也不是HI 22.某种混合气体,可能含有2N 、HCl 、CO .把混合气体依次通过足量的3NaHCO 溶液的灼热CuO ,气体体积都没有变化.再通过足量的22O Na 固体,气体体积减小.最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体.以下对混合气体组分的判断,正确的是( )A .一定没有2N ;CO 和HCl 中至少有一种B .一定有2N 、HCl 和COC .一定有2N ;CO 和HCl 中至少有一种D .一定有2N 和HCl ;没有CO答题卡第Ⅱ卷(共67分)四、本题包括2小题共13分23.(6分)贮气袋中存有有色气体,可能是2NO 、4CH 、2CO 、HCl 、3NH 、2Br 蒸气等气体中的几种,进行以下操作:①通少许于水中,得无色溶液;②通少许于3AgNO 溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊.则:由①可判断,一定存在_________;一定不存在________.由②可判断,一定存在_________;一定不存在_________.由③、④可判断,一定存在________;可能存在的是________.24.(7分)某河道两旁有甲乙两厂.它们排放的工业废水中,共含+K 、+Ag 、+3Fe 、-Cl 、-OH 、-3NO 六种离子.(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、_________、________.(2)乙厂的废水中含有另外三种离子.如果加一定量_______________(选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属_______________(填写金属元素符号).(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的_________________(填写离子符号)转为沉淀.经过滤后的废水主要含__________________,可用来浇灌农田.五、本题包括2小题共20分 25.(7分)下列关系图中,A 是一种正盐,D 的式量比C 大16,E 是酸.当X 无论是强酸还是强碱时都有如下转化关系:当X 是强酸时,A 、B 、C 、D 、E 均含有同一种元素;当X 是强碱时,A 、B 、C 、D 、E 均含有另一种元素 回答下列问题(用化学式填写):(1)A 是________________,Y 是_______________,Z 是________________. (2)当X 是强碱时,E 是________________. (3)当X 是强酸时,E 是________________.(4)写出A 与X 反应的离子方程式_______________.26.(13分)合金A 由4种单质组成,经过一系列反应分别进入了沉淀或气体中.试回答:(1)合金A 由哪4种元素的单质组成?_________、________、________、_________. (2)写出固体B 、溶液C 、沉淀D 和气体E 、F 有关组成的化学式: B_________、C_________、D_________、E_________、F_________.(3)写出合金A 中的有关组成与过量烧碱溶液反应生成无色气体E 的化学反应方程式: __________________________________________________________________________. (4)写出向无色溶液C 加适量盐酸生成白色沉淀D 有关反应的离子方程式:__________________________________________________________________________.六、本题包括2小题共15分 27.(6分)下列物质存在如图所示的转化.(1)当X 为两种非金属元素所组成的化合物时,则下列物质的化学式为 甲______________,乙_______________,丙______________; X______________, Y_______________,Z_______________.(2)当X 为金属元素与非金属元素所组成的化合物时,则下列物质的化学式为 甲_______________,乙_______________丙______________; X_______________,Y______________,Z______________.28.(9分)硫酸钡是惟一无毒的钡盐,工业上以4BaSO 等为原料通入下列流程反应可以制备锌钡白和过氧化氢:(1)上述流程中共有7个化学反应,其中有_________个属于氧化还原反应.(2)写出过氧化氢的电子式_____________.写出物质H 的电子式_____________. (3)写出下列化学反应方程式:反应①:___________________________________________________________________. 反应③:___________________________________________________________________. 反应④:___________________________________________________________________. 反应⑦:___________________________________________________________________. 七、本题包括2小题共19分 29.(8分)有A 、B 两种无机含氧酸的正盐,A 盐中的阳离子为+2价,B 盐中的阳离子为+1价.现把两盐的浓溶液混合使其发生复分解反应,完全作用后产生带+2价阳离子的沉淀C 及含溶质D 的滤液.取5.00 g 沉淀C 在高温下灼烧可得2.80 g 固态的金属氧化物E ,并生成了能使澄清石灰水变浑浊的无色刺激性气味的气体F .1 mol 固体D 受热分解,生成1 mol 气态非金属氧化物G 和O m olH 22(气)组成的混合气体,混合气体的密度是2H 的340倍.请回答: (1气体F 的化学式是________________; (2)列式计算确定金属氧化物E 的化学式(3)列式计算确定非金属氧化物G 的化学式(4)A 的化学式是_________________,B 的化学式是________________.30.(11分)某复盐的组成可表示为:O H BR R A 22z y x ⋅⋅,R 为-2价含氧酸根.为了确定该盐的组成,进行如下实验:(1)准确称取4.02 g 样品加热到失去全部结晶水,冷却后称量,质量为2.94 g .(2)将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量23)Ba(NO 溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g .(3)向上述溶液中加入过量NaOH 溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g ,再将固体高温灼烧后冷却,称得剩余固体质量是0.40 g . 请通过计算回答下列问题:(1)确定R 的化学式. R 的化学式______________.(2)求x 、y 、z 的值. x =________,y =________,z =_________. (3)确定A 是什么元素. A 元素的名称是_____________. (4)该复盐的化学式为______________.(5)要确定某化合物是否含A 元素,最简单方法是______________.参考答案1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D 13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C 23.(1)2NO ;2Br ;(2)HCl ;3NH ;(3)HCl 、2CO 、4CH24.(1)-OH 、-Cl 、+K ;(2)铁粉,Ag (3)+Ag 、+3Fe 、-Cl 、-OH ;3KNO25.D 的式量比C 大16,猜想Y 是2O .D CB22O O 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.正盐A 既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A 是弱酸的铵盐S )(NH 24 (1)S )(NH 24 2O O H 2 (2)3HNO (3)42SO H(4)O H NH ΔOH NH 234+↑+-+或↑++-S H 2H S 2226.(1)Fe 、C 、Si 、Al (2)Fe 、C 32SiO Na 、2NaAlO 44SiO H 、3)Al(OH 2H 、2CO(3)↑+++2223H 2NaAlO 2NaOHO 2H 2Al(4)↓+++-44223SiO H OH 2H SiO ↓+++-322)Al(OH OH H AlO27.(1)Mg 2O C 2CO MgO CO (2)2Cl Fe 2Br 2FeBr 3FeCl 3FeBr 28.(1)3 (2)(3)↑+→+4CO BaS 4C BaSO 4,↓+↓→+ZnS BaSO ZnSO BaS 44 →++O H CO BaS 22↑+↓S H BaCO 23,224422O H BaSO SO H BaO +↓→+ 29.(1)2CO (2)设金属元素的原子量为x ↑+23CO MO ΔMCO5.00 g 2.80 g 2.20 gx +16 44442.21680.2=+x x =40,该金属元素是Ca ,氧化物E 的化学式是CaO (3)O 2H G ΔD2+,设G 的分子量为y ,则2340321831⨯=⨯+⨯y ,y =44,若G分子中含有1个O 原子,则44-16=28,28是N 原子量的2倍,则G 是O N 2,若G 分子中含2个O 原子,则44-32=12,则G 是2CO ,不合题意(4)23)Ca(NO ,324CO )(NH30.(1)由于向溶液中滴加盐酸,无现象,再滴加23)Ba(NO 溶液,产生白色沉淀.所以,R 必定是硫酸根;R 的化学式为-24SO(2)4.02 g 样品中含结晶水的物质的量为)mol (06.01894.202.4=-4.02 g 样品中含硫酸根的物质的量为)mol (02.023366.4= ↓+-+22)B(OH 2OH B m ∆+OH BO Δ)B(OH 22b +34 18 180.58 g (0.58-0.40)g 解得 b =24,∴ B 是镁元素 4.02 g 样品中含硫酸镁的物质的量为)mol (01.05858.0= 4.02 g 样品中含另一种硫酸盐的物质的量为0.02 mol -0.01 mol =0.01 mol x ∶y ∶z =0.01∶0.01∶0.06=l ∶1∶6 ∴ x =1;y =1;z =6 (3)A 的原子量为3902.024.092.194.2=--,∴ A 是钾元素A 元素的名称是钾(4)复盐的化学式为O 6H MgSO SO K 2442⋅⋅ (5)焰色反应。
