有机化学本科生期中期末串讲讲义,12
本科五年制 基础 有机化学第12章 胺
N
N
N
N
OH
ONa
无偶联 能力
② 酚或胺:
OH
OH -
偶联慢
NH 2
H+
O-
偶联快
NH 3+
H+ OH-
能偶联
不能偶联
偶联的条件为:低温、弱酸或弱碱。
思考题
重氮盐稳定存在的条件是什么?为什么? 为什么重氮盐被羟基取代要强酸条件,而偶 联反应要弱酸、弱碱?
生物碱 (Alkaloid) 一、生物碱的概念及临床应用
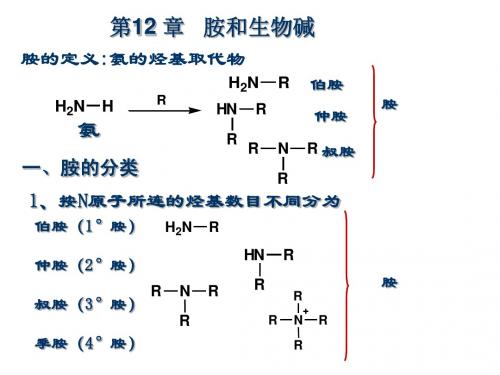
胺
脂肪胺 芳香胺 R-NH2 Ar-NH2
3、根据分子中氨基的数目分类
胺 一元胺 多元胺
CH3CH2NH2 H2NCH2CH2NH2
注:芳香胺为N原子 直接连在芳香环上 的胺,如果不是直 接连在芳香环上, 即使有芳香环也不 属于芳香胺。
4、季铵盐和季铵碱
氢氧化铵或铵盐分子中四个氢原子完全被烃基取代而 成的化合物分别称为季铵碱或季铵盐。
MDMA
2-(2-氯苯基)-2-(甲氨基)环己酮 氯胺酮(K粉)
苯丙胺为中枢神经兴奋剂, 是国家严格管制的精神类药品。 甲基苯丙胺俗称“冰毒”, 属于联合国规定的苯丙胺类毒品。 MDMA 属于致幻剂类毒品,是“摇头丸”的主要成分。 氯胺酮俗称K粉。临床上用作麻醉剂或麻醉诱导剂, 有精神 依赖性,其致幻作用是导致被滥用的主要原因。
R R' N H OH2 "R
R R' H OH 2 H OH 2
< <
N
<
H OH 2 R N H OH 2 H OH 2
H OH2 H2O H N H OH2 H OH2
有机化学要点复习讲义

有机化学总复习要点一、碳原子的成键原则1、饱和碳原子与手性碳原子;2、不饱和碳原子;3、苯环上的碳原子。
[应用]:①利用“氢1,氧2,氮3,碳4”原则分析有机物的键线式或球棍模型;②利用其卤代产物可能的种类或“手性碳原子”的特点分析有机物结构并书写有机物结构简式。
二、官能团的重要性质1、C=C :①加成(H2、X 2或HX 、H 2O );②加聚(单聚、混聚);③氧化2、C ≡C :①加成(H 2、X 2或HX 、H 2O );②氧化3:①取代(卤代,硝化,磺化);②加成(H 2) [延伸]①引入羟基:先引入OH ONa X -−−→−-−−→−-酸化水解 ②引入烃基: R RCl AlCl -−−→−+3 ③引入羧基:先引入烃基COOH R KMnO-−−−→−-4酸性 4、R —X :OH NaX CH CH R NaOH X CH CH R NaX OH R NaOH X R O H 22/22/;2++=-−−→−+--+-−−→−+-醇溶液5、醇羟基: O H CH CH R OH CH CH R OH ONO R ONO H OH R OH OR CO R COOH R OH R COOHR CHO R OH CH R O H X R HX OH R H ONa R Na OH R O O 22222222//,22222;222+=-−−−→−--+-−−−→−-+-+--−−−→−-+--−−−→−-−−−→−-+-−→−+-↑+-−→−+-∆∆∆∆浓硫酸,浓硫酸,浓硫酸,催化剂,催化剂6、酚羟基:①与Na ,NaOH ,Na 2CO 3反应2 —OH+2Na →2 —ONa +H 2↑—OH +NaOH → ─ONa +H 2O─OH +Na 2CO 3→ ─ONa +NaHCO 3[注意]酚与NaHCO 3不反应。
─ONa −−−−−−→−+H SO H CO H 或或3232 ─OH +NaHCO 3(NaHSO 3,Na +) ②苯酚在苯环上发生取代反应(卤代,硝化,磺化)的位置:邻位或对位。
高考化学总复习讲义有机部分知识分享

,所以
例 5 中草药秦皮中含有的七叶树内酯
( 碳氢原子未画出, 每个折
点表示一个碳原子 ) ,具有抗菌作用。若 1mol 七叶树内酯,分别与 浓溴水和 NaOH溶液完
全反应,则消耗的 Br2 和 NaOH的物质的量分别为 ( )
A.3mol Br 2;2mol NaOH
B.3mol Br
2;4mol NaOH
=4;③当 x= 3 时, y= 8. 答案: C、 D. 例 4 已知维生素 A 的结构简式如下:
学而不思则惘,思而不学则殆
关于它的说法正确的是 ( ) A. 维生素 A 是一种酚 B. 维生素 A 是一个分子中含有三个双键 C. 维生素 A 的一个分子中有 30 个氢原子 D. 维生素 A 具有环已烷的结构单元 【解析】 由于维生素 A 无苯环上的羟基,所以 A 错误;显然分子中含五个双键 B 错误;分子中六元环含双键,所以 D 错误 . 利用数碳算氢的方法可得答案应为 C. 【答案】 C
学而不思则惘,思而不学则殆
第三节 有机物
一、知识结构
为了适应高考的新趋势,在有机化学复习中应立足课本,发展智力,培养能力,必须向
能力 ( 观察能力、实验能力、思维能力和自学能力 ) 测试倾斜具体讲,应做到:
1. 对中学化学应掌握的内容能融会贯通, 将知识横向和纵向统摄整理, 使之网络化,有
序地贮存,作“意义记忆”和抽象的“逻辑记忆” ,有正确复述,再现、辨认的能力。
成反应,综合各种信息,可以推测这是一个加成消去反应。即
学而不思则惘,思而不学则殆
例 2 白藜芦醇
,广泛存在于食物 ( 例如
桑椹、花生,尤其是葡萄 ) 中。它可能具有抗癌性。该物质和溴水或
氢气反应时,能够跟 1
[中南大学]有机化学复习课提纲讲课稿
![[中南大学]有机化学复习课提纲讲课稿](https://img.taocdn.com/s3/m/04008aa5f90f76c660371a2e.png)
◆ 亲电取代:连有吸电子基(卤素和第二类定位基)时,将使芳环上的电子云密
度降低,反应速率减慢。
Cl
N2O
A .
B .
C .
O3 CHCOOE
D .
E .
第 一 类 第 二 类
第 一 类 第 二 类
(弱 )
DC A E B
(3) 亲核反应:包括亲核取代、亲核加成。
◆亲核取代: SN1 反应,SN2反应
3.反应活性(如亲电、亲核反应) (1) 自由基取代反应:
反应的难易取决于活性中间体烃基自由基的稳定性,烃基自由基越稳定,其反应 速率越快.
(2) 亲电反应:包括亲电加成和亲电取代。 ◆ 亲电加成反应的反应速率取决于碳碳不饱和键电子云密度,电子云密度大,
速率快。符合马氏加成规则。如:
= = = A . P C 2 B h . p - O 2 H N C 6 C H 4 C H C 2 C . H p - C H H 3 C 6 H 4 C H C 2
A .
+
+
+
+
C 2H B .C 3H C . C 2H D .C 3 C H H 3 CH
CDAB
= A .P h 3 CB .( C H 3 ) 3 CC .C H 3 C H C H 3 D .C 3 C C H H
A B CD
5. 亲核试剂与离去基团 离去基团对亲核取代反应的影响。 亲核试剂对亲核取代反应的影响,如试剂的碱性、 可极化性及溶剂的影响等。
b412b412413413414414415415选择题选择题2020分分101022分命名或写结构式命名或写结构式2020分分10102完成反应式完成反应式3030分分151522分写反应机理写反应机理1010分分2255分合成题合成题1010分分2255分推断题推断题1010分分2255分选择题选择题2020分分101022分命名或写结构式命名或写结构式2020分分10102完成反应式完成反应式3030分分151522分写反应机理写反应机理1010分分2255分合成题合成题1010分分2255分推断题推断题1010分分2255分一选择题一选择题取代基的电子和空间效应对化合物性质的影响如酸性主要包括如下方面主要包括如下方面沸点与分子结构的关系沸点与分子结构的关系熔点与分子结构的关系熔点与分子结构的关系溶解度与分子结构溶解度与分子结构有关物理性质的问题化合物酸碱性的强弱主要受其结构的电子效应杂化合物酸碱性的强弱主要受其结构的电子效应杂化氢键空间效应和溶剂的影响
有机化学专题讲稿

这是含有α- H的酯在强碱条件下的Claisen酯缩合反应,产物
的结构特点是:除乙酸乙酯外,其它含α- H的酯都将得到在α-位
上有支链的β-酮酸酯。
反应物系空间位阻较大的α-烯烃(端烯),在加溴时将得到以重
排产物为主的二卤代烃。
反应物系α-氨基酸,其受热生成交酰胺。
该反应是含有活泼氢的化合物与不含α- H的醛的缩合反应。生成β-羟基化合物。
该反应是卤代烃的碱性水解反应,随反应物β- C上的烃基增多,反应逐渐过渡到按SN1历程进行,将得到以重排产物为主的醇。
这是苯的烷基化反应;当烷基化试剂的碳原子数≥3时易发生重排。
这是α,β-不饱和醛(或酮)的交错缩合反应;这里的关键是“α-氢”的确认,这里的“γ-H ”受共轭效应的影响而显示出一定的“酸性”。
顺式异构体、1 , 3 –二取代环丁烷和1 , 4 –二取代环己烷(无论两个取代基相同与否,是顺式还是反式)均因有对称面而无旋光性。
内消旋体不是内消旋体
其他三元、四元、五元、六元环状化合物,只要是反式异构体,因分子中既无对称面,也无对称中心,因而均有旋光性(无论两个取代基相同与否)
(5)内消旋体、外消旋体、非对映体和差向异构体:
该化合物为γ-羟基酸,受热发生分子内脱水,生成交酯。
该反应是醇羟基被卤素取代的反应,反应按SN1历程进行。与
HBr反应的特点是:易发生重排。
这是季胺碱的热消除反应,理应
.生成连有取代基少的烯烃,即Hofmann产物。但该规律只适用于烷
基季胺碱。本题的反应物为非烷基季胺碱,消除成为为热力学稳定的Saytzeff产物。
这种现象可用溶剂效应来解释,以水和叔丁醇为例:水的共轭碱OH-能很好的被水溶剂化,因而较稳定;但叔丁醇的共轭碱(CH3)3CO-则因空间位阻较大难以被水溶剂化,所以不稳定。若在气相中,因不存在溶剂化效应,其酸性的强弱次序则刚好相反。
大学有机化学讲稿教案重点自学

⼤学有机化学讲稿教案重点⾃学《有机化学》(第六版)讲稿⼈民卫⽣出版社主编吕以仙副主编陆阳第⼀章绪论(Introduction )教学要求:掌握:碳原⼦的三种杂化轨道(sp3 sp2 sp)的特点;分⼦极性与偶极矩的关系;分⼦轨道与原⼦轨道的关系; 成键轨道与反键轨道的差异;共振式与共振杂化体的区别;熟悉:有机化合物和有机化学的含义;键长、键⾓、键能和共价键的极性的含义;官能团的含义和圭要官能团;有机反应中共价键断裂的主要⽅式; 实验式、分⼦式和结构式的含义。
了解:有机化合物分⼦中,原⼦间主要以共价键相结合。
掌握共价键的本质是学习和理解有机化合物结构与性质关系和反应机制以及化合物稳定性的基础。
因此本章对路易斯结构和现代价键理论作⼀简要回顾;有些化合物的结构⽤单⼀路易斯结构式不能准确表达,然⽽运⽤共振结构却有它的独到之处,为此对共振结构作⼀简介;掌握路易斯酸碱概念对理解有机反应⼗分有⽤,故将其作为⼀个知识点加以阐述。
了解有机化合物分类和反应类型及确定结构式的步骤与⽅法对提⾼学习有机化学的综合分析能⼒也是⼗分必要的,本章对此⽅⾯内容作⼀扼要介绍。
第⼀节有机化合物和有机化学⼀、有机化合物和有机化学下⾯是⼀些简单⽽熟悉的有机化合物,他们在化学组成上有什么共同点?◆有机化合物含碳的化合物或碳氢化合物及其衍⽣物。
◆有机化学:有机化学的现代定义是指研究含碳化合物的化学。
第⼆节共价键⼀、现代共价键理论路易斯的共价键理论虽然揭⽰了共价键与离⼦键的区别,但未能说明共价键是怎样形成的,也不能解释共价键为什么具有饱和性和⽅向性等诸多问题。
现代共价键理论指出:当两个原⼦互相接近到⼀定距离时,⾃旋⽅向相反的单电⼦相互配对(即两原⼦轨道重叠)。
使电⼦云密集于两核之间,降低了两核间正电荷的排斥,增加了两核对电⼦云密集区域的吸引。
因此使体系能量降低,形成稳定的共价键;共价键有以下特点:第⼀、每个原⼦所形成共价键的数⽬取决于该原⼦中的单电⼦数⽬,这就是共价键具有饱和性。
有机化学精讲资料(复习攻略)

第一部分命名一、通用规则1.选取含官能团在内的最长碳链作为主链。
若存在两条或两条以上等长的最长碳链,选择取代基数目最多的一条作主链。
2.用天干(甲乙丙丁戊己庚辛壬癸)代表主链碳原子数,写在母体名称之前,如甲烷,乙烯,丙炔,丁醇,戊酸等3.从距离官能团最近的一端开始,对主链进行编号(卤烃除外,X视为取代基)。
若有两种或两种以上编号方法,以及对于不含有官能团的烷烃,以取代基所在位次之和最小为原则,进行编号。
4.将各取代基的位次和名称写在母体名称之前。
以阿拉伯数字标明取代基位次,并以“-”与基名相连,如2-甲基;相同的取代基合并写出,位次按由小到大次序列出,并以“,”隔开,同时在基名前以汉字标明该取代基总数,如2,2,4-三甲基;不同取代基按“次序规则”(见附录)进行排列,较优基团后列出;不同取代基之间以“-”连接,最后一个基名与母体名称间无“-”,如2-甲基-3-乙基辛烷5.对于存在官能团位次异构的化合物,需要在取代基与主体名称之间以“-取代基位次-”的形式标明取代基位置,其中取代基位次以阿拉伯数字写出,双键、三键位次以成键C原子中较小位次为准,如2-甲基-3-戊醇,2-甲基-2-丁烯6.含有多个同种官能团时,按由小到大的次序依次列出官能团位次,并以“,”隔开,同时在母体名称前以汉字表明官能团总数,如1,3-丁二烯,2,4-庚二酮,对苯二酚,乙二酸,丙三醇*7.多官能团化合物命名时,按下式所列的优先级次序,以优先级较高的官能团作母体,优先级较低的官能团作取代基(—X和—NO2只能作取代基)—COOH>—COOR>—CN>—CHO>—C=O>—OH(醇)>—OH(酚)>—NH2>醚)>—R碳链编号时以母体官能团位次最低为原则,如3-戊烯-1-炔,4-戊酮醛二、特殊化合物命名及位次规则1.螺环化合物根据组成环的碳原子总数命名为“某烷”,加上词头“螺”。
有机化学课堂演讲

(2)给主链编号时从距离双键最近的一端开始,侧链 视为取代基,双键的位次须标明,用两个双键碳原子 位次较小的一个表示,放在烯烃名称的前面. (3)其它同烷烃的命名规则. 3,5 -二甲基-2-己烯 3,3-二甲基-1-戊烯 3-甲基-2乙基-1-丁烯 3-甲基环己烯 烯烃去掉一个氢原子后剩下的一价基团称为某烯 基,烯基的编号自去掉氢原子的碳原子开始.如: CH2=CH- CH3CH=CH- CH2=CHCH2乙烯基 1-丙烯基(丙烯基) 2-丙烯基(烯丙基)
烯烃的系统命名法基本上与烷烃相似,其要点是: (1)首先选择含有双键的最长碳链作为主链,按主链中所含碳原子的 数目命名为某烯.主链碳原子数在十以内时用天干表示,如主链含有 三个碳原子时,即叫做丙烯;在十以上时,用中文字十一,十二,……等 表示,并在烯之前加上碳字,如十二碳烯. (2)给主链编号时从距离双键最近的一端开始,侧链视为取代基,双 键的位次须标明,用两个双键碳原子位次较小的一个表示,放在烯烃 名称的前面. (3)其它同烷烃的命名规则. 3,5 -二甲基-2-己烯 3,3-二甲基-1-戊烯 3-甲基-2-乙基-1-丁烯 3-甲 基环己烯 烯烃去掉一个氢原子后剩下的一价基团称为某烯基,烯基的编号自 去掉氢原子的碳原子开始.如: CH2=CH- CH3CH=CH- CH2=CHCH2乙烯基 1-丙烯基(丙烯基) 2-丙烯基(烯丙基) 3.2.烯烃的顺反异构 与烷烃不同,由于双键不能自由旋转,所以当两个双键碳原子各连有 两个不同的原子或基团时,可能产生两种不同的空间排列方式.例如 2-丁烯:
当基团含有双键和三键时,可以认为
Z , E —命名法
此种方法是根据IUPAC命名法,用次序规 则来决定Z,E的构型。 次序规则(a)将双键碳原子所连接的原子或 基团按其原子序数的大小排列,把大的排 在前面,小的排在后面,同位素则按原子 大小次序排列。(直接排列法) 例如:I>Br>Cl>S>O>N>C>D>H
