电化学测量原理及方法
电化学检测原理

电化学检测原理电化学检测(Electrochemical Analysis)是一种基于电化学原理的分析方法,通过测量电化学信号来定量或定性地检测化学物质的特性。
本文将介绍电化学检测的原理和常用的电化学检测技术。
一、电化学检测原理概述电化学检测是利用化学反应引起的电流或电位变化来检测分析物质的含量或性质的一种方法。
它基于电化学的基本原理,即在电解质溶液中,电流与溶液中电离物种的浓度成正比,电位则与氧化还原反应的进行有关。
二、电化学检测技术分类根据电化学过程的特点和检测目标的不同,电化学检测技术可以分为以下几种:1. 电化学传感器:通过一种特殊的电极与被检测物质之间的电化学反应,将被检测物质的浓度转化为电信号输出,实现对物质的定量或定性检测。
2. 电解池法:利用溶液中的电性参数,如电导率、电阻率等的变化,以及电极上的电位或电流的变化,来检测分析物质的含量或性质。
3. 循环伏安法(Cyclic voltammetry):在一个电极电位可以反复变化的条件下,测量在电位变化过程中所产生的电流,结合电化学反应的特性,得到分析物质的信息。
4. 安培法(Amperometry):通过施加恒定的电位,在电解质溶液中测量电流的变化,以化学反应的速率来推测分析物质的浓度。
5. 多重脉冲伏安法(Multiple pulse amperometry):利用多个脉冲电位来激发电化学反应,并测量所产生的电流信号,以获得更多的信息。
6. 阻抗法(Impedance Spectroscopy):通过测量电感、电阻、电容等电性参数的变化,来检测分析物质的性质和浓度。
三、电化学检测的优点和应用电化学检测具有以下优点:1. 灵敏度高:电化学检测可以实现对微量物质的检测,达到ppb(亿分之一)乃至ppm(百万分之一)级的灵敏度。
2. 快速实时性:电化学检测响应速度快,通常在几秒钟或几分钟内即可完成检测。
3. 无需标记:相比于其他传统的分析方法,电化学检测可以直接反映分析物质的化学特性,无需额外的标记物。
电化学原理和方法

电化学原理和方法电化学是研究电荷在电化学界面上转移和反应的学科,是物理化学的重要分支之一。
通过电化学实验和研究,可以揭示物质的电化学性质,并应用于电池、电解池、电解制备和分析等领域。
本文将介绍电化学的基本原理和常用的实验方法。
一、电化学基本原理1. 电解学和电池学电解学研究的是电解液中电荷的转移现象,它关注电离和非电离物质在电解液中的电化学行为。
电池学则研究的是电池的性质和工作原理,包括原电池、电解池和燃料电池等。
2. 电化学反应电化学反应可以分为氧化还原反应和非氧化还原反应。
在氧化还原反应中,电荷由氧化物传递给还原物,形成氧化物和还原物之间的电荷转移反应。
在非氧化还原反应中,电荷转移到非氧化还原剂和氧化剂之间,但没有氧化或还原的过程。
3. 电化学方程式电化学方程式是描述电化学反应的方程式,它将反应物和生成物之间的电荷转移过程表示为化学方程式。
在方程式中,电子传递通常用电子符号“e-”表示,离子迁移则用相应的离子符号表示。
4. 电极和电动势电极是电化学反应发生的场所,分为阳极和阴极。
阳极是发生氧化反应的地方,而阴极则是发生还原反应的地方。
电动势是衡量电化学反应自发性的物理量,通过比较不同半反应的电动势可以判断反应的进行方向。
二、常用电化学实验方法1. 极化曲线法极化曲线法是一种常见的电化学实验方法,用于研究电化学界面上的电荷转移和反应过程。
它通过改变外加电势的大小,并测量电流的变化,绘制电流对电势的曲线图,从而得到电化学反应的特征。
2. 循环伏安法循环伏安法是研究电化学反应动力学过程的重要实验方法。
它通过不断改变电势,使电化学反应在阳极和阴极之间来回进行,然后测量反应的电流响应,从而得到电化学反应的动力学参数。
3. 旋转圆盘电极法旋转圆盘电极法是一种用于研究电化学反应速率的实验方法。
它通过将电极固定在旋转的圆盘上,使电解液与电极之间产生强制对流,从而提高反应速率,并测量反应的电流响应,得到反应速率的信息。
电化学测量原理及方法

电化学测量原理及方法
电化学测量是根据物理和化学定律进行测量的方法,是利用电场的作用,以及原子核、电子、离子和分子在电场中的运动影响来引起物质的化
学反应及其变化,从而测量物质的各种特性的方法,可以用来测量物质的
纯度、分量、温度等参数。
通常用于电化学测量的工作原理有半导体电阻法、电极测量法、电极
滴定法、极谱法、色谱法、热电堆法、光电流法、飞行时间技术等。
半导体电阻法是通过测量溶液中微量电荷离子的浓度来实现的,它是
利用半导体材料在溶液中的电阻的变化来检测溶液中微量电荷离子的含量,进而测量物质的纯度。
电极测量法是一种用于检测电极上的电流变化的测量方法,它可以揭
示不同物质的电场及极化现象,测量物质的结构、电性质等参数。
电极滴定法是使用悬浮于滴定液中的电极,在滴定过程中,电极可以
接受或释放电流,以改变电极的电位,从而直接测量物质的量。
极谱法是利用特定温度下溶液中的电位来测量物质的特性和结构的方法。
电化学技术的基本原理和实验方法

电化学技术的基本原理和实验方法电化学技术是一种利用电化学反应进行分析和合成的方法。
它在环境保护、能源存储和化学合成等领域具有重要的应用价值。
本文将介绍电化学技术的基本原理和实验方法。
一、电化学技术的基本原理电化学技术的基本原理是通过电化学反应来实现物质的转化。
电化学反应包括氧化还原反应和电解反应两种。
氧化还原反应是指物质在电极上失去或获得电子的过程。
在这个过程中,被氧化的物质称为还原剂,它捐出电子;被还原的物质称为氧化剂,它接受电子。
这种反应可以通过测量电流来观察。
电解反应是指电流通过电解质溶液时,溶液中的物质被分解成离子的过程。
正极(阳极)是溶液中的阴离子的源头,负极(阴极)是溶液中的阳离子的源头。
该反应主要用于分析样品中的离子含量。
二、电化学实验方法电化学实验主要分为三个步骤:样品制备、电化学测量和数据处理。
1. 样品制备样品制备是电化学实验的第一步。
首先,需要选择一个合适的电极材料,如铂电极、玻碳电极等。
其次,根据样品的性质和需要进行合适的前处理,如清洗、溶解等。
最后,将制备好的样品溶液注入到电化学池中。
2. 电化学测量在实验仪器方面,主要有三种常见的电化学测量设备:电化学滴定仪、电化学工作站和电化学生物传感器。
电化学滴定仪通过控制电位和电流来进行分析和滴定。
它可用于测量溶液中的物质浓度、反应速率等参数。
电化学工作站是一种集成结构的仪器,能够同时进行电化学实验和数据分析。
它可以具有多个电极、多个槽和多个电位控制器。
电化学生物传感器是利用生物酶或抗体等具有生物特性的物质与电极表面上的生物识别层之间的反应来测量样品中的成分。
3. 数据处理在电化学实验中,测得的数据通常需要进行处理和分析。
常见的数据处理方法包括绘制电流-电势曲线、计算峰电位、峰电流和输出曲线等。
此外,还可以使用一些数学模型和计算方法来解释实验结果。
三、电化学技术的应用领域电化学技术在环境保护、能源存储和化学合成等领域具有广泛的应用。
电化学测试原理

电化学测试原理
电化学测试原理是基于电化学原理的一种实验方法,用来研究电化学过程中的电流、电压、电荷等物理量的变化规律。
电化学测试原理包括电池测试原理、电解池测试原理等。
电池测试原理是通过将被测试物质置于电池中,利用电流和电压的测量来研究其电化学性质。
在电池中,纳入两个不同的电极(阳极和阴极),它们与电解液接触,形成两个半电池。
阴极半电池发生还原反应,接受电子;而阳极半电池发生氧化反应,释放电子。
这些电子通过外部电路流动,并在电池中产生电流。
电池测试中,通过测量电流和电压的变化,可以分析电池的性能和反应动力学。
电解池测试原理是通过电解池实验来研究物质的电化学性质。
电解池由两个电极(阳极和阴极)和电解液组成。
当外加电压施加到电解池中时,阳极上发生氧化反应,阴极上发生还原反应。
这些反应在电解液中引起电荷的转移,形成电流。
通过测量电流和电压的变化,可以分析电解物质的电导率、溶解度、电极反应速率等。
电化学测试原理的应用十分广泛。
它可以用来研究金属腐蚀、电解过程、电池性能等领域。
通过测试原理的分析,可以帮助我们深入了解电化学过程中的物理现象,并为相关领域的研究提供理论依据。
电化学测量原理及方法
a、电解池/容器:是装电解质溶液、WE、CE所用,是一种容器,要求稳定性好,不溶出杂质,不与电极物质、电解液发生反应,大部分无机电解质是玻璃的,强碱电解液例外,具体要求如下:
① 化学稳定性高;
② 体积适中,太小:研究体系浓度变化;太大:浪费。
浓度变化: ,可见c与J0有关→η。
③ 鲁金Luggin毛细管距离;太近:电位测不准;太远:较大的欧姆压降;距离(管直径) ,这是半定性半定量关系。
④辅助电极的位置、大小及形状;
位置:与WE平行放置;大小:SCE>5SWE。
φ研-φ参=φ研-φ界+IRΩ
⑥恒电位测量中,电解池的内阻要小。
b、参比电极
作用:比较,本身电位的稳定。
应具备的条件:
b、电极表面处反应物的浓度只与位置有关,与时间无关,c=f(x)
Fick(费克扩散)定律:单位时间内通过单位平面的扩散物质的量与浓差梯度成正比,即:
又根据法拉第定律: ;所以有: ,对稳态系统,是常数,与x无关,所以上式极化电流可以写成:
④稳态极化的种类及其影响因素
电极过程往往是复杂的、多步骤的过程,因此极化的类型也有许多种,例如电化学极化(或称为电荷传递极化,也称为活化极化)、由传质过程控制引起的浓差极化、欧姆极化(或称为电阻极化)、匀相或多相化学反应极化、电结晶极化等。现只讨论电化学极化、由扩散控制引起的浓差极化和欧姆极化等三种基本极化类型,三种类型极化的过电位分别用:ηe、ηc和ηR表示。
电流通过电极时,从鲁金毛细管管口至研究电极表面上存在溶液的电阻—溶液电阻RL。通电时所产生的压降叫欧姆压降,欧姆极化,。
减小或消除欧姆压降的方法:
①鲁金毛细管管口尽可能靠近研究电极表面;太近,产生屏蔽作用;太远,欧姆压降大;
电化学分析方法的原理和实验操作
电化学分析方法的原理和实验操作电化学分析方法是一种基于电化学原理的分析技术,广泛应用于环境监测、生物医学和材料研究等领域。
本文将介绍电化学分析方法的原理和实验操作。
电化学分析方法主要包括电位法和电流法两种基本原理。
电位法是通过测量电极的电势来得到分析物浓度的一种方法。
常见的电位法技术有电位滴定法、电位滴定曲线法等。
电位滴定法利用电极在不同电势下与溶液中的分析物发生反应的特性,通过改变电极电位,观察电势的变化来判断溶液中分析物的含量。
电位滴定曲线法是基于电位滴定法的一种改进方法,通过测量滴定过程中电极电势与滴定剂用量的关系,绘制滴定曲线来定量分析。
不同的电位法技术适用于不同的分析物种类和浓度范围,选择合适的技术能够提高分析结果的准确性和重复性。
电流法是通过测量电极上的电流来获取分析物信息的方法。
电流法包括电位阶跃法、电位线性扫描法等。
电位阶跃法是在稳定电位和工作电位之间进行切换,通过测量电流的变化来得到分析物浓度的方法。
电位线性扫描法是通过改变电极的电位线性地扫描电极电位,测量扫描过程中的电流和电位之间的关系,从而获取分析物的信息。
与电位法相比,电流法具有更高的灵敏度和更广的线性范围,能够分析更低浓度的分析物。
实验操作是电化学分析方法的关键环节。
首先,需要选择合适的电极和电解质溶液。
电极通常使用玻碳电极或导电聚合物修饰电极,根据分析物的性质选择合适的电极。
电解质溶液应根据需要调整pH值和离子强度,以提高反应速率和准确性。
其次,实验过程中要控制温度和搅拌速度,避免温度和扩散的影响。
还需要进行标定实验,通过测量标准溶液的电流或电势与浓度的关系,建立标准曲线来定量分析。
对于常见的电化学分析方法,还可以利用附件实验方法来提高分析准确性。
附件实验方法包括溶液前处理、电极修饰和反应条件调控等。
溶液前处理可以通过滤过、萃取和离子交换等方式去除干扰物质,提高分析结果的准确性。
电极修饰可以增强电化学反应的灵敏度和选择性,提高分析方法的灵敏度。
化学实验中的电化学实验
化学实验中的电化学实验电化学是研究电与化学之间相互作用的学科,它在化学实验中扮演着重要的角色。
电化学实验是一种通过电流作用于化学体系进行实验研究的方法,可以用于分析物质的性质、反应机制以及合成新物质等。
本文将介绍电化学实验的基本原理、常见实验方法以及它们在化学研究中的应用。
一、电化学实验的基本原理电化学实验的基本原理是基于电解和电池的原理。
电解是指通过外加电压使电解液中发生化学反应,将化学能转化为电能的过程。
而电池则是通过化学反应产生电能的装置。
在电化学实验中,通过连接电解池和电池,我们可以通过观察电流的变化来了解电化学反应的特性和机理。
二、常见的电化学实验方法1. 电解实验电解实验是最常见的电化学实验之一。
它通过在电解池中通电,引发电解液中的化学反应。
常见的电解实验有电解水制氢气和氧气的实验,电解氯化钠制取氯气和氢氧化钠等实验。
这些实验可以通过观察电解液的气体产生、电极的气味变化等来揭示反应机制和产物性质。
2. 电化学分析实验电化学分析实验是应用电化学方法进行定量和定性分析的重要手段。
例如,电化学滴定法可以通过测定反应物的氧化还原电位来确定物质的浓度。
电化学分析实验也广泛应用于环境监测、食品安全检测等领域。
3. 电极制备实验电极是电化学实验的重要组成部分。
制备合适的电极材料对于实验结果的准确性和稳定性至关重要。
电极制备实验包括金属电极的沉积、碳纳米管电极的合成等。
这些实验可以通过改变电极材料和制备条件来探索电极性能的影响因素。
三、电化学实验在化学研究中的应用1. 电化学合成反应电化学合成反应是一种通过电流驱动化学反应进行合成的方法。
通过控制电流密度、反应时间等条件,可以实现对产物形态、结构和纯度的精确控制。
电化学合成反应在有机合成、材料合成等领域具有广泛应用。
2. 电化学催化电化学催化是指通过电流作用下改变化学反应速率和选择性的现象。
电化学催化在燃料电池、电解水制氢等领域发挥着重要作用。
通过电化学实验可以研究催化剂的性能、反应机制以及提高催化性能的方法。
电化学测试方法及原理
电化学测试方法及原理
电化学测试方法是用电流或电位和被测物质相关的特性来测量的一种测试方法。
电化学技术可以提供有关元素的信息,这些信息是生物、化学、机械和结构工程等领域的基础。
电化学测试的原理是使用电极间的电势差来测量反应的速率,电势差表示电位在两个电极之间的差异。
当反应中出现氧化离子或还原离子时,它们在电极处产生特定的变化,电势会发生变化。
准确测量这种变化可以对物质进行非常准确的测试。
电化学测试分为循环伏安法和动力学法,前者测量电流和电势或势垒,可以记录瞬时流变;而动力学法可以用反应速率常数(k)来描述反应的速率。
电化学测试可以用来检测电子的迁移率或极化率,电化学反应的测定类似于其他分析技术,如硫酸盐变化、氧化还原和转移过程等。
电化学反应的结果可以用于研究新材料的结构、定义活性中心等,也可以用于研究有机、无机物在体外反应中发生的变化。
因此,电化学测试对于化学分析、生物医学分析、医用诊断和药物开发都有重要的作用。
电化学测试方法是用3个组件:反应物、介质和电极组成的测试系统,来测量电子的迁移率或极化率的一种方法。
电极和介质之间的电势差可以用于测量反应的速率,电化学技术可以提供有关元素的信息,对于化学分析、生物医学分析、医用诊断和药物开发都具有重要的行业应用。
电化学检测器原理
电化学检测器原理
电化学检测器是一种基于电化学原理的分析仪器,其原理是利用电化学反应的特性来检测和分析样品中的成分和性质。
在电化学检测器中,电化学反应发生在电极表面,通过测量电流、电势或电荷的变化来获得样品信息。
电化学检测器包括电化学电容器、电化学电导、电化学溶解度等。
其中,电化学电容器是利用电容量的变化来检测样品中某种成分的浓度。
当样品中的特定成分与电容器中的电极发生反应时,电容量会发生改变,通过测量电容量的变化可以确定样品中的成分浓度。
电化学电导是通过测量电解质溶液中电导率的变化来检测样品中的成分。
当样品中含有某种成分时,电导率会改变,通过测量电导率的变化可以判断样品中的成分种类和浓度。
电化学溶解度是利用电化学反应中产生的溶解度变化来检测样品中的成分溶解度。
通过测量溶解度的变化可以判断样品中的溶解度和溶解度相关的信息。
电化学检测器可广泛应用于环境监测、食品安全、医学诊断等领域,具有快速、灵敏、可靠等特点,是一种重要的分析检测方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
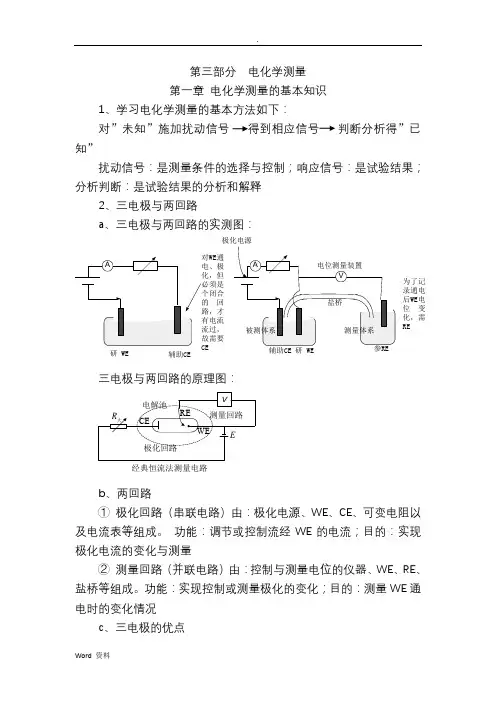
第三部分 电化学测量 第一章 电化学测量的基本知识1、学习电化学测量的基本方法如下:对”未知”施加扰动信号 得到相应信号 判断分析得”已知”扰动信号:是测量条件的选择与控制;响应信号:是试验结果; 分析判断:是试验结果的分析和解释2、三电极与两回路a 、三电极与两回路的实测图:三电极与两回路的原理图:b 、两回路① 极化回路(串联电路)由:极化电源、WE 、CE 、可变电阻以及电流表等组成。
功能:调节或控制流经WE 的电流;目的:实现极化电流的变化与测量② 测量回路(并联电路)由:控制与测量电位的仪器、WE 、RE 、盐桥等组成。
功能:实现控制或测量极化的变化;目的:测量WE 通电时的变化情况c 、三电极的优点研 WE辅助CE通回为了记录通电后WE 电位变化,需RE极化电源经典恒流法测量电路① 可以同时测量极化电流和极化电位; ② 三电极两回路具有足够的测量精度。
d 、两类溶液体系① 被测体系:研究电极所处的溶液体系。
② 测量体系:参比电极所处的溶液体系。
3、三电极体系中各组成部分的作用和要求a 、电解池/容器:是装电解质溶液、WE 、CE 所用,是一种容器,要求稳定性好,不溶出杂质,不与电极物质、电解液发生反应,大部分无机电解质是玻璃的,强碱电解液例外,具体要求如下:① 化学稳定性高;② 体积适中,太小:研究体系浓度变化;太大:浪费。
浓度变化: ,可见c 与J0有关→η。
③ 鲁金Luggin 毛细管距离;太近:电位测不准;太远:较大的欧姆压降;距离(管直径) ,这是半定性半定量关系。
④辅助电极的位置、大小及形状;位置:与WE 平行放置;大小:S CE >5S WE 。
φ研-φ参=φ研-φ界+IR Ω⑥ 恒电位测量中,电解池的内阻要小。
b 、参比电极作用:比较,本身电位的稳定。
应具备的条件:① 可逆电极(浓度不变,电位不变);这是热力学说法,符合Nernst 方程。
② 参比电极是不极化电极(i 0→∞);实际上i 0不可能∞,所以需要控制流经RE 的电流非常小,即:I 测<10-7 A/cm 2。
0J nFkc =CE消除边缘效应,实现电力线的均匀分布CEWE 等势面0.1~0.3l d mm ≈=③ 良好的稳定性(化学稳定性好、温度系数小); ④ 具有良好的恢复特性;⑤ 恒电位测量中,要求低内阻,从而实现响应速度快。
c 、参比电极的选择测量体系(参)与被测体系(研)具备相同的阴离子(浓度相近),则不要盐桥,如没有相同的阴离子,则需要盐桥,常用的是以下三种阴离子电极(酸、盐、碱)。
SO 42-:Hg|Hg 2SO 4|SO 42- ; Cl -:Hg|Hg 2Cl 2|Cl -或Ag|AgCl|Cl - OH -:Hg|HgO|OH -d 、盐桥:测量与被测体系组成或浓度不同时用盐桥。
作用:① 消除或减小液接电位;② 消除测量体系与被测体系的污染。
要求(盐桥制备的注意事项):① 内阻小,合理选择桥内电解质溶液的浓度;② 盐桥内电解液阴阳离子当量电导尽可能相近,扩散系数相当(常用:KCl 、NH 4NO 3),以消除液接电位;③ 盐桥内溶液不能和测量、被测量体系发生相互作用; ④ 固定盐桥防止液体流动,采用4%的琼脂溶液固定。
ef 、辅助电极作用:象形对电极,实现WE 导电并使WE 电力线分布均匀。
要求:①应使辅助电极面积增大;为使参比电极等势面,应使辅助电极面积增大,以保证满足研究电极表面电位分布均匀,如是平板电极: ;②辅助电极形状应与研究电极相同,以实现均匀电场作用。
形态液态Hg滴汞电极表面状态复杂清洁度低气态固体表面能量性强、吸附性强研辅5S S4、精确测量的注意事项 a 、参比电极电位必须稳定温度系数小 , 。
b 、测量或控制电位仪器的要求 ① 内阻足够大,R >1000R池;② 合适的量程及精度;③ 快的响应速度;④ 高的灵敏度。
测量仪器除以上要求外,还有形状、面积、反应产物、稳定性、位置等要求。
c 、减小或消除液体接界电位① 被测体系与测量体系具有相同的阴离子; ② 合理选择和使用盐桥。
d 、减小或消除欧姆压降对电压测量的影响电流通过电极时,从鲁金毛细管管口至研究电极表面上存在溶液的电阻—溶液电阻R L 。
通电时所产生的压降叫欧姆压降,欧姆极化,。
减小或消除欧姆压降的方法:① 鲁金毛细管管口尽可能靠近研究电极表面;太近,产生屏蔽作用;太远,欧姆压降大;鲁金毛细管(Φ=0.1~0.3 mm )管口到研究电极表面的距离约等于管口直径,即L =Φ。
欧姆压降的校正除依赖于Luggin 毛细管外径,还依赖于电极的形状:球形电极的欧姆压降最小,圆柱形电极次之,平板电极的最大。
② 恒电位仪溶液电阻的补偿(减小); ③ 断电流电位瞬时测量; ④ 桥式电路补偿。
e 、消除或减小辅助电极的影响测量仪器除形状、面积、反应产物、稳定性、位置等要求外,还有灵敏度、量程、精度的要求。
0→参I 7210/I A cm -<参L iR =∆ϕ第二章 稳态研究方法1、稳态过程① 稳态过程的意义(构成稳态的条件)电流通过电极时,在指定的时间内,电化学参量(极化电流、极化电位、电极表面处的反应物的浓度等)不变或基本不变。
② 稳态过程的意义(构成稳态的条件) 注意:a 、稳态不是平衡态平衡态:I=0,Ja=Jc ,φe ;稳态:I ≠0,Ja>Jc ,φ极;平衡态是稳态的特列。
b 、绝对的稳态是不存在的c 、稳态和暂态是相对的稳态和暂态区分标准是参量变化是否显著,这个标准是相对的。
例如:用不灵敏的仪器测量不变化,但用精度较高的仪器测量,则变化;短时间参量不变化,但长时间却发生变化。
在做稳态极化曲线时,就需要注意手动调节恒电位仪的时间及量程。
③ 稳态过程的特点a 、通过电极的电流全部用于电化学反应,i=i r ;无双电层充电电流i c ;无非法拉第电流i 吸=0。
b 、电极表面处反应物的浓度只与位置有关,与时间无关,c=f(x) Fick (费克扩散)定律:单位时间内通过单位平面的扩散物质的量与浓差梯度成正比,即:又根据法拉第定律: ;所以有: ,对稳态系统,是常数,与x 无关,所以上式极化电流可以写成:④ 稳态极化的种类及其影响因素电极过程往往是复杂的、多步骤的过程,因此极化的类型也有许多种,例如电化学极化(或称为电荷传递极化,也称为活化极化)、由传质过程控制引起的浓差极化、欧姆极化(或称为电阻极化)、匀相或多相化学反应极化、电结晶极化等。
现只讨论电化学极化、由扩散控制引起的浓差极化和欧姆极化等三种基本极化类型,三种类型极化的过电位分别用:ηe 、ηc 和ηR 表示。
cf D x∂=∂c i nFf nFD x ∂⎛⎫== ⎪∂⎝⎭0=⎪⎭⎫ ⎝⎛=x O O dx dc nFD i δsOO O O c c nFDx c nFD i -=∆∆=02、各种类型的极化和过电位假定电化学反应为简单的电荷传递反应,因为稳态电流全部由于电极反应所产生,所以i 与反应速度υ成正比,即:上式中 ,称为阴极极化过电位;其中, i 0和i d 分别是代表 学极化和浓差极化的参量。
该式是同时包括电化学极化和浓差极化的i-η关系式,既适用于不可逆电极,也适用于可逆电极,对各种程度的极化(从平衡电位→弱极化→强极化→极限扩散电流)均适用。
i 0:i d =ks δ/D ,i 0:i d 这个比值代表了电化学极化与浓差极化快慢的比较,决定了电极的可逆性。
a 、当i 0:i d >>1时,浓差极化比电化学极化更容易出现,电化学的平衡不容易被打破,电极表现为可逆体系。
过电位完全(超电势)是由浓差引起的,表现为可逆电极。
这样的电极,扩散过程(浓差)总是占主导地位,要想从稳态极化曲线研究电化学极化或电化学反应速度是不可能的。
在一般情况下,δ≈10-3~10-2 cm ,D ≈10-5 cm 2·s -1,所以稳态极化曲线不宜于研究ks>10-2 cm 2·s -1的电化学反应。
b 、当i 0:i d <<1时,电化学极化比浓差极化更容易出现,电化学的平衡容易被打破,电极表现为不可逆体系。
这样的电极在不同的超电势范围内表现出不同的极化程度。
这就是著名的Tafel 公式。
这种电极的极化曲线示意于右 图,从图上也可以看出ηe 和ηc 具 有完全不同的特征,在小电流时,以ηe 为主,在大电流时,以ηc 为主。
它们随电流变化的规律也不相()000nF nFRTRTf O b Ri nF nF i i nFk c nFk c i e e αβηηυνν-⎛⎫==-=-=-=- ⎪⎝⎭ηϕϕ=-平()()011nF nF RT RT d d O R i i i i e e i i αβηη-⎡⎤⎛⎫⎛⎫=--+⎢⎥ ⎪ ⎪ ⎪ ⎪⎢⎥⎝⎭⎝⎭⎣⎦00ln ln ln log e RT i RT RTi i a b inF i nF nFηηααα===-=+同。
除了电化学极化和浓差极化外,还有欧姆极化。
电极界面两侧为电子导体(通常为金属)和离子导体(电解质溶液),它们都有电阻,电流通过时就产生Ohm电位降,称为Ohm过电位ηR,它与i的关系符合欧姆定律。
在一般情况下,溶液电阻R L远大于金属电阻,因此负号:是因规定阴极电流为正,而阴极超电势为负。
R L可以从溶液的比电阻及液层的截面和厚度计算得到。
由于ηR 的存在,在电极界面的真实过电位比测量到的过电位小ηR的数值。
当i0很小时,即使通过不大的净电流也能使电极电势发生较大的变化,这种电极称为“极化容量小”或“易极化电极”,也称为电极反应“可逆性小”。
若i0=0,则不需要通过电解电流(即没有电极反应)也能改变电极电势,因而称为“理想极化电极”。
研究双电层构造时所用电极体系最好应有近似于“理想极化电极”的性质。
若i0很大,则电极上可以通过很大的净电流密度而电极电势改变很小。
这种电极常称为“极化容量大”或“难极化电极”。
由于在这种电极上通过外电流时正、反向电流的数仍然几乎相等,有时就称为电极反应的“可逆性大”。
若i0→∞,则无论通过多大的净电流也不会引起电化学极化。
这种电极称为“理想可逆电极”或“理想不极化电极”。
电极电势测量时用作“参比电极”的体系或多或少地应具有“不极化电极”的性质。
电极体系根据i0的大小分类:I~η关系电极电势可以任意改变一般为半对数关系一般为直线关系电极电势不会改变3、各种极化的特点与影响因素a、电化学极化ηe的影响因素电化学极化是由电化学反应速度决定的,它与电化学反应本质有关。
化学反应的活化能比较高,且各种反应的活化能相差悬殊,因此反应速度的差别是以数量级计(即通常相差达几个数量级)。
