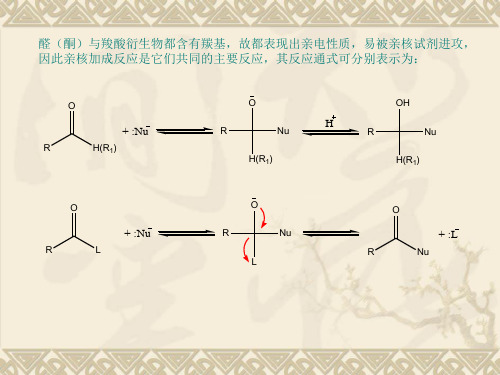
第9章亲核加成反应
亲核加成反应
+ HN
H H R3
H
H N R2 OH R3 H
- H2O
N R2 O R3
+
RHC R1
-H
RHC CH2 R3R2N R1 RHC CH2NR2R3 R1
如是碱催化,则由碱与活泼氢化合物作用生成碳负离子再和醛与胺形成的加成 产物作用。
O O
+ OH
R1 R1
+ H2O
可以采取其它几种方法制备烯胺。如把酮和仲胺混合后,加入四氯化钛作脱 水剂,很快就能生成烯胺,此方法对于普通的胺和有位阻的胺都适用。
O R1 NR1R2 R1
5
R2
NH + 2 RH2C R3
+ TiCl4
2 RHC
R3
+ 4
R2
NH2Cl
+ TiO2
或把仲胺转化成三甲基硅基衍生物,由于硅具有强烈的亲氧不亲氮的性质, 故能在较温和的条件下形成烯胺。
Z=R,Ar,OH,HZAr,HNCONH2.......
在酸性条件下,质子加到羰基的氧原子上,增加了羰基碳原子上的正电荷,有 利于亲核加成,所以这些反应能被酸所催化。
O
+ H
C
OH
但质子又可以结合反应物H2N-Z,使之失去活性。所以此类反应有一最合适的 PH值,从而使相当一部分羰基化合物质子化,又能使游离的含氮化合物保持一 定的浓度。在这一最合适的PH值下,反应速率最大。
O OH
O
R3
+
H H H
H N R2 R2 N
H
R1
R2R3NCH2CH2COR1
- OH
R3
亲核加成反应

1. 重要的亲核加成反应(1) 加氰化氰 醛、脂肪族甲基酮和含8个碳以下的脂环酮都可以加氰化氢,生成氰醇(α-羟基腈)。
CO CHCNα-羟基腈实验证明碱对这个反应的影响颇大。
例如,丙酮和氰化氢作用,不加任何催化剂,3至4小时内只有50%的丙酮起反应;当加入一滴氢氧化钠溶液,反应在两分钟内完成。
若加入酸,反应速度减慢;加入较多的酸,放置几个星期也不反应;因为氢氰酸是弱酸,酸或碱的存在将直接影响它的电离平衡。
+H+--C O H HHNCN+加入碱,平衡向右移动,CN -的浓度增加;加入酸,平衡向左移动,CN -的浓度降低。
这些事实说明在丙酮与氰化氢的反应中起决定作用的是CN -本身的性质和浓度。
醛、酮加氰化氢的反应是可逆的,亲核试剂是CN -,其历程可以表示如下:反应分两步进行,第一步是CN -进攻羰基碳,生成氧负离子中间体。
这是个慢步骤,也是决定速度的步骤。
第二步是氧负离子中间体和质子结合,形成氰醇,这是个快步骤。
醛、酮和氰化氢直接加成反应的产率较好,但是氰化氧有剧毒,且挥发性大(沸点26.5℃)。
使用起来不安全。
为了避免反应中直接使用氰化氢,一般采用醛或酮与氰化钾(钠)的水溶液混合,然后加入无机酸,使氰化氢一旦生成立即和醛或酮作用。
.但在加酸时应控制溶液的pH 值,使之始终偏于碱性(pH ≌8),以利于反应的进行。
醛、酮加氰化氢在有机合成中很有实用价值。
它是增长碳链的一种方法;此外加成物含有双官能团,是一类较活泼的化合物,可进一步转化为多种其它化合物。
例如:CH 3CH 3CH 2CH 3CH 3CH3CH 333)2CCH 2NH 2CH 33CO H O H O+C H C O O HNCNCO CCHO C H +O,Δα-甲基丙烯酸甲酯(90%) α-甲基丙烯酸甲酯是合成有机玻璃——聚α-甲基丙烯酸甲酯的单体。
C R R R`δ+O H ()+--慢快C H H NCN +R`)H (-C R O CN R`)H ((2)加亚硫酸氢钠 大多数醛、脂肪族甲基酮和8个碳以下的脂环酮与亚硫酸氢钠饱和溶液(40%)加成,生成白色的α-羟基磺酸钠晶体。
亲核加成

NO2
_ + CH3
H H H C C NO2 CH3 NO2
2
碳-碳双键的亲核加成反应
• 亲核试剂对碳-碳双键加成的反应历程: • 反应的第一步是亲核试剂带着一对电子进攻双键 上的一个碳原子,而电子则被集中到另一个双键 碳原子上形成碳负离子,这是慢的一步。第二步 是碳负离子与质子或带正电荷的物质结合形成产 物。
+ E+ C C Nu E C C Nu
3
C C
+ E Nu
• 一些常见得促进亲核加成反应的取代基有: CHO、 COR、COOR、 CN、NO2、 CONH2、SO2R等。 它们通过降低碳-碳双键碳原子上的p电子云密度 来促进亲核试剂的进攻,但更重要的是,这样的 取代基能使生成的碳负离子中间体的负电荷分散 而得到稳定。
C2H5O
-
H O C C C CH3
1)水解 2)加热
O
7
碳-碳三键的亲核加成反应
• 碳-碳三键通常比双键更容易被亲核试剂进攻,而较难被 亲电试剂进攻。这是因为碳-碳三键之间的距离较短,三 键中的电子被束缚的比双键中的紧,所以进攻的亲电试剂 夺取三键中的一个电子较困难。从杂化角度来考虑,三键 碳原子(sp杂化)比双键碳原子(sp2杂化)具有较多的s成分, 因此它与电子的结合力较强,表现出较强的亲电性。
O
NH2NH2
NNH2
NH2NHCONH2
NNCONH2
RSH
• 羰基化合物与醇的反应
• 醛(酮)能与一分子醇加成生成半缩醛(酮)。半缩醛(酮)不稳 定,容易分解成醛(酮)和醇或与另一分子醇进一步缩合, 生成缩醛(酮)。 • 由于缩醛(酮)生成后又可水解成原来的化合物,故可利用 缩醛(酮)生成还保护醛(酮)基。 • 环状缩醛(酮):最常见的是利用羰基化合物和乙二醇反应, 生成二氧戊环化合物,该化合物比烷基缩醛(酮)更加稳定, 可耐大多数碱性及中性的反应条件。
亲核加成反应机理

亲核加成反应机理一、介绍亲核加成反应是有机化学中一种重要的反应类型。
它通过亲核试剂攻击电荷不饱和的碳原子,形成新的碳-亲核键,并伴随有官能团的转换。
本文将对亲核加成反应的机理进行全面、详细、完整且深入地探讨。
二、亲核加成反应概述亲核加成反应是一类重要的有机化学反应,其主要特点是用亲核试剂攻击双键或三键上的电子,形成新的化学键。
亲核试剂可以是阴离子、中性分子或阳离子。
在亲核加成反应中,亲核试剂通常经历亲核进攻、负离子重排和质子化等阶段。
1. 亲核进攻亲核试剂在亲核加成反应中起到亲核进攻的作用。
通常情况下,亲核试剂具有可用的自由电子对,能与电子不足的碳原子形成新的化学键。
亲核进攻的速率和选择性受到亲核试剂的性质、反应条件和底物的结构等因素的影响。
2. 负离子重排在某些亲核加成反应中,亲核试剂的亲核进攻会导致反应过渡态产生负电荷,形成负离子。
负离子重排是亲核加成反应中的一个重要步骤,可以通过改变碳原子的排列顺序来稳定负离子。
3. 质子化质子化是亲核加成反应中的最后一个阶段,通过给亲核试剂或负离子成员质子化,使反应产物获得更稳定的结构。
质子化通常发生在负离子重排之后。
三、亲核加成反应的分类亲核加成反应可根据亲核试剂和底物的不同进行分类。
下面将对几种常见的亲核加成反应进行介绍。
1. 碱性条件下的亲核加成反应在碱性条件下,亲核试剂通常是醇、酚、胺等带有孤对电子的化合物。
这类亲核试剂能够与电荷不饱和的碳原子形成新的化学键。
碱性条件下的亲核加成反应常用于合成醇、酚、胺等化合物。
2. 酸性条件下的亲核加成反应在酸性条件下,亲核试剂通常是具有孤对电子的阴离子,如卤素离子、亚硫酸根离子等。
酸性条件下的亲核加成反应可以用于合成卤代烷、磺酸酯等化合物。
3. 中性条件下的亲核加成反应在中性条件下,亲核试剂通常是中性分子,如水、醛、酮等。
中性条件下的亲核加成反应常用于合成醇、酮等化合物。
四、亲核加成反应的机理解析1. 碱性条件下的亲核加成反应机理以醇作为亲核试剂为例,碱性条件下的亲核加成反应机理如下:1.酸性条件下,氧上的醇质子化生成质子化醇。
第九章 碳氧双键的亲核加成

Nu
R R'
C
O
R C R'
O Nu
sp2杂化 平面三角型 键角: 键角:120° 109°28 ′ °
sp3杂化 四面体
产物中基团拥挤程度增大。 产物中基团拥挤程度增大。 R 越大,妨碍 进攻 原子。 越大,妨碍Nu进攻 原子。 进攻C原子
2. 亲核试剂的活性
① 对于同一羰基化合物,试剂的亲核性越强, 对于同一羰基化合物,试剂的亲核性越强, 反应的平衡常数越大。 反应的平衡常数越大。
Stronger base
Weaker base
碱催化利于醛的缩合,而不利于酮的缩合。 碱催化利于醛的缩合,而不利于酮的缩合。
酸催化: 酸催化:
O CH3CCH3 + H Cl OH CH3C CH2 H + Cl
-HCl
OH CH3C CH2
羰基质子化及烯醇的生成
CH3 CH3C CH2 + C OH CH3
OH
O CH3CHCH2C H OH
O HOH + CH 2 CH CH 2
O CH
烯醇负离子
Step 2
O CH3CH
O CH2 CH CH2 O CH
O
O
CH3CHCH2CH
An alkoxide ion
OH O OH
Step 3
O O CH 3 CHCH 2 CH
HOH
CH 3CHCH 2CH
1. Wittig 反应
Wittig 试剂: 试剂:
Ph3P C R2
膦的内 盐
Ph3P CH2
膦的叶立德 (ylid)
Ph3P CHR (RO)3P CHR
有机化学 第9章 醛和酮(2)

2020/8/3
11
2. 炔烃和胞二卤代物的水解
3. 烯烃的臭氧化
2020/8/3
12
4.烯烃的羰基化法 烯烃的羰基化法是制备醛的重要方法。反应一般需要高压和过渡金属催化,最常用的 催化剂为羰基钴
5. 傅-克酰基化
2020/8/3
13
6. 瑞默-梯曼(Reimer-Tiemann)反应
2020/8/3
2.酮也能与醇生成半缩酮或缩酮,反应相对困难;常用原甲酸酯在酸催化下与酮反 应来制备缩酮,例如:
2020/8/3
20
3. 环状缩醛或酮——有机合成中的保护基团
缩醛或酮结构特征,醚,对碱性条件、亲核 试剂稳定;将醛/酮羰基转换为缩醛或酮, 对碱性条件、亲核试剂稳定
2020/8/3
21
4. 亲核试剂的亲核能力,例如:氢氧根代替水做亲核试剂
第9章 醛和酮
2020/8/3
1
2020/8/3
2
1. 醛和酮的结构及命名 2. 羰基的结构、亲核加成反应概述,底物对亲核加成反应的影响 3. 羰基与含碳亲核试剂的加成,包括:与氢氰酸、格式试剂、炔负离子的反应
4. 羰基与含氧亲核试剂的加成,包括半缩醛(酮)、缩醛(酮),有机合成中的 保护和去保护
最常用的氧化剂: (1) 高锰酸钾 (2) 铬氧化剂
铬酸(适合于将仲醇氧化为酮 ) Collins试剂 [C5H5N] 2CrO3 in CH2Cl2 氯铬酸吡啶盐(PCC) 重铬酸吡啶盐(PDC) [C5H5NH] 2[Cr2O7]
2020/8/3
10
Swern氧化 Swern氧化的反应活性高,特别适合于有立体位阻的醇的氧化,但通常都需要在低 温下进行。 二甲基亚砜-二环己基碳二亚胺(DMSO-DCC);二甲基亚砜-乙酸酐 (DMSO-Ac2O); 二甲基亚砜-三氟乙酸酐[DMSO-(CF3CO)2O]; 二甲基亚砜-草酰氯
亲核加成反应例子

亲核加成反应例子
1. 嘿,你知道吗,醛和酮与氢氰酸的反应就是亲核加成反应的典型例子呀!就像苹果遇到了喜爱它的人,氢氰酸这个小家伙迅速地向醛或酮跑去,结合在一起。
比如乙醛和氢氰酸反应生成乙腈醇,这多神奇呀!
2. 哇塞,还有格氏试剂和羰基化合物的反应呢!这就好比两个好朋友找到了最佳组合,互相成就。
像是甲基碘化镁和丙酮反应生成叔丁醇,多有意思啊!
3. 哎呀呀,水和羰基化合物的加成也是哦!把水想象成一个热情的拥抱者,紧紧抱住羰基化合物。
例如甲醛和水反应生成甲醇,这过程不是很奇妙吗?
4. 嘿,别忘了氢卤酸和烯烃的加成呀!这就好像一场精彩的追逐赛,氢卤酸努力地去和烯烃结合。
像丙烯和氯化氢反应生成氯丙烷,超酷的呢!
5. 哟呵,醇和羰基化合物的反应也得算上呀!好比两个合作伙伴,一拍即合。
就像乙醇和乙醛反应形成半缩醛,这多让人惊叹!
6. 哈哈,亚硫酸氢钠和醛、酮的反应也很典型呢!这就像一场特别的相遇,产生独特的结果。
比如说苯甲醛和亚硫酸氢钠反应生成苯甲醛亚硫酸氢钠加成物,是不是很特别呀!
7. 哇哦,有机金属化合物和不饱和化合物的反应也是呢!就如同两块拼图完美地契合。
像二甲基铜锂和丙烯反应生成丁烷,是不是很神奇呢!我觉得亲核加成反应真的是化学世界里超级有趣和奇妙的一部分呀!。
亲核加成反应

O + HCN
OH CN
K=1000
这里,角张力得到缓解,但程度不大。
水
亲核加成反应活性
a)决定于羰基碳上的正电性 δ + ,则 反应
b)决定于空间效应 空间位阻 ,反应
如: H C=O
H
>
R C=O
H
>
R δ+ δ C=O
R
R C=O
H
>
Cl
C=O H
> Cl C C=O
CH3 -C=O
Cl H
思考题:烯烃有无亲核加成?乙烯能否与CH3OK反应?
PhC CH
PhSH KOH PhCH CHSPH
PhC
CH
CH3O CH3OH
Ph C
H
C OCH3 H
库切洛夫反应
如果使用弱的亲核试剂则需要加入催化剂,常用的 催化剂是Hg2+离子,因为它能与叁键配位,从叁键吸 引电子,有利于弱亲核试剂的进攻。例如炔烃的水合 反应:
R'
M
S
ZO
R
L
交叉式(主要产物)
L
R'
R
M ②
SOZ
RL
R'
M
S
R
OZ
L
(次)
与格氏试剂加成的手性诱导效应:
CHO
H
Ph + CH3MgI Et2O
② 试剂的可极化度越大,则利于亲核加成 反应的进行。
CH3CHO + H2O CH3CHO + HCN
CH3CH(OH)2 CH3CHOH
CN
K≈ 1 K≈ 104
HCN的可极化度大,HCN是比水更强的亲核试 剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
CHO
CH3 C CH2CH3 O
OH
CH CH C CH2CH3
O
主 要产 物
+
2015/8/17
CH3 CCH2CH3 O
H
+
O CH C C CH3
CH3 主 要产 物
19
(3)Benzoin(安息香)缩合 两分子芳醛在KCN的水-乙醇溶液中短时间 温热则发生双分子缩合生成芳香族a-羟基 酮类的反应
CH3COOCPh3 + H2O CH3COOH / H
+
H2O 二 噁 烷
+
CH3COOH + Ph3COH
O CH3 C O CPh3
H
+OH CH3 C O CPh3
O CH3 C OH
+ CPh3
+
+ CPh3
+ Ph3C OH2 -H
+
H2O
Ph3COH
▲关键在于碳正离子的稳定性
2015/8/17 30
H
+
R R'
Nu C OH
快
2015/8/17
11
基础有机 化学所讲 内容:
OH CN HCN
+
OH SO3 Na
NaHSO3 NH2OH N NNH2 OH
OR ROH OH H
O
RSH SR OH
NH2NH2 RMgX R OH
2015/8/17
12
1、杂原子亲核试剂的加成
多数亲核试剂与醛酮的加成反应,在平衡建立后,其平衡 常数往往小于1。只有当强的吸电子试剂与羰基相连时, 才能得到较稳定的加成产物。
第9章 亲核加成反应
碳杂键常发生亲核加成反应(如C=N\C=O\C≡N等) 除此之外,碳碳键也可以发生亲核反应(如C=C\C≡C)常 见的亲核试剂有:N、O、S、X、P等杂原子中心,负碳离子, 氢负离子。
第一节 碳碳双键的亲核加成反应
一、碳碳双键的亲核加成 碳碳双键含π键,是富电子的,容易发生亲电反应, 难被亲核试剂进攻。因此要想进行亲核反应需活化,降低 双键电子云密度,需增加吸电子基团。
+ Ph3P CH CH3+ C6H5CHO H3C C6H5 H3C H + C C C C H H H C6H5
- +
PPh3 + O
OCOCH3
OCOCH3
VA 的乙酸酯
2015/8/17 18
(2)羟醛缩合反应 在酸或碱催化下含有α-氢的醛酮 相互作用生成羟基醛或羟基酮。 ●碱催化下的反应历程(酮难于缩合) ●酸催化下的反应历程(利于酮的缩合)
Wittig试剂是一种磷的内翁盐,也叫磷叶立德。它是 相邻的原子带有不同的电荷,磷带正电荷而碳带负电 荷,由于碳和磷之间的轨道重叠而使碳的负电荷分散。
Ph3P + RCH2X + Ph3P CR2
Ph3PCH2RX
+
-
C4H9Li
Ph3P-CHR
+
-
Ph3P CR2
Wittig反应可用通式表示: + O + Ph3P CR2
是维生素B1的中间体
CH2 CH CN + NH3
二苯 胺
H2N CH2 CH2CN
可合成3-丙氨酸
2015/8/17
3
氰乙基化反应特点:当亲核试剂具有一 个活泼的亚甲基或甲基时,丙烯腈可以 发生二或三次氰乙基化反应。
CH3 C CH3 + CH2 CH CN O
KOH
CH3 C C(CH2CH2CN)3 O
2015/8/17
1
CH2 CH2
H H C C NO2 NO2
+
CH3
-
-
无 反应
溶剂
NO2 CH3CH2CH NO2
+ CH3
- 溶 剂 负离 子
双键碳上连有吸电子基有利于亲核加成反应。 它们可以降低双键碳上的电子云密度,来促进亲 核试剂的进攻。更重要的是,这样的取代基能使 生成的负碳离子中间体的负电荷分散而得到稳定。
CH CH H2O O -OH N CH CH
O
N -
O
N
O
CH CH2
2015/8/17
10
第三节 羰基的亲核加成反应
一、羰基的亲核加成反应 两种不同条件下的加成历程: 1、酸催化下:
R C O R' H
+
R R' C OH
+
R R'
快
C OH
+
Nu 慢
- R Nu C OH R'
2、碱催化下: Nu Nu R R 慢 C O C O R' R'
2015/8/17
8
R C CH
HgSO4
H2SO4
O R C CH3
H2O
R C CH
Hg
2+
R C CH Hg
2+
H2O
+OH 2 R C CH Hg
+
Hg
2+
OH R C CH2
互 变异构
O R C CH3
2015/8/17
9
KOH N H O CH CH N O
CH CH2
反应机理为:
KOH N H
F3C F3C C O + H2 O
F3C F3C
OH C OH
Cl3C C O + H NH3
Cl3C H C
OH NH2
13
2015/8/17
苯甲醛与季戊四醇在稀盐酸溶液中反应:
HO HO OH OH H
+
CHO
+
H2O
O CH O
O CH O
2015/8/17
14
2、碳原子亲核试剂的加成 (1)Wittig反应(维蒂希反应)
2015/8/172Fra bibliotek1、氰乙基化反应
丙烯腈分子中的碳碳双键,因受到氰基的影响能发生 亲核反应。 因此,由亲核试剂进攻双键碳原子,生成的中间体 再从溶液中获得质子,所得产物相当于在亲核试剂分子 中引入一个氰乙基,故称为氰乙基化反应。
CH2 CH CN + CH3OH
CH3ONa
CH3O CH2 CH2 CN
O CH COOC2H5
R'
如从苯乙酮为原料合成2-苯基丙醛:
O C CH3 CH3
+ Cl CH2COOC2H5
CH3
NaOC2H5
C
CH COOC2H5 O
CH3 CH COONa HCl C CH COOH O
NaOH C2H5OH
C
O
2015/8/17
23
CH3 -CO2 C CH OH
CH3 CH CHO
CH3 C O CH2C(CH3)3 O
18
OH H2O
CH3 C OH + HOCH C(CH ) 2 3 3 O
O -
18
3
k
1
0.97
HCl 25℃
0.53
RCOOC2H5 + H2O C(CH3)3 0.025
RCOOH + C2H5OH R k CH3 1 CH3CH2 0.83
CH(CH3)2 0.27
2015/8/17
29
(2)酸催化 烷-氧键断裂单分子历程 (AAl1) Acid catalysis,unimolecular alkyl-oxygen cleavage
OH CH O C
KCN CHO
2015/8/17
20
CHO
CN
-
O C H CN
O OH C CN O C H
OH C CN
OH C CN
+
CH
O C CN
OH C H
-CN
O C
OH C H
2015/8/17
21
(4)Perkin反应(柏金反应) 由于酸酐的α-氢比较活泼,在羧酸盐的催 化下,与芳醛作用。
O H5C6 C CH CH C6H5 + CH2(COOC2H5)2
哌啶 CH3OH
C6H5 C CH2 CH CH(COOC2H5)2 O C6H5
2015/8/17
5
O CH3 C CH C(CH3)2 + CH2(COOC2H5)2
C2H5O -
CH2 O C(CH3)2 CH3C CH2 C(CH3)2 C2H5O- O C CHCOOC2H5-C H OH CH2 CH 2 5 COOC2H5 COOC2H5 C O
2015/8/17
27
O R C OR'
H
+
+ OH R C OR' R
OH C OR' + H2O
OH R C OR' +OH2 R
OH C OH + OR' H -R'OH R
+ H O C OH
-H
+
O R C OH
2015/8/17
28
对AAC2而言,主要影响因素是四面体中间 体的空间张力作用。 HCl CH3COOR CH3COOH + ROH 25℃ CH(CH3)2 CH2CH3 R CH
2015/8/17
26
3、酯化、水解反应历程及影响因素 在羧酸衍生物中,酯化和水解反应研究的最为详细。 以酯类水解为例,包括酰氧键断裂和烷氧键断裂。在不 同条件下,反应历程有所不同。
