体外消化实验
养殖技术中的饲料消化率评估方法

养殖技术中的饲料消化率评估方法引言:饲料消化率是评估养殖动物对饲料中的养分吸收利用能力的重要指标。
准确评估饲料消化率对于优化养殖管理,提高养殖效益至关重要。
在养殖技术中,饲料消化率的评估方法有多种,下文将介绍其中几种常用方法。
一、代谢试验法代谢试验法是一种直接测定动物对饲料养分消化利用率的方法。
通过收集动物排泄物和尿液,以及测定摄入的饲料量,可以计算出饲料中的各种养分的消化率。
代谢试验法的优点是直接、准确,能够真实反映动物对饲料的利用情况。
但是,该方法需要耗费时间和人力,且具有一定的侵入性,因此在实际应用中受到一定的限制。
二、捕食消化能试验法捕食消化能试验法是通过测定动物排泄物中能量的代谢率来评估饲料消化率的方法。
该方法的特点是相对简便、节省时间,且不需要对动物进行干预。
通过测定饲料中能量含量及动物排泄物中的代谢能量,可以计算出动物对饲料能量的消化率。
然而,捕食消化能试验法对饲料中非能量养分的评估相对较弱,在实际应用中需结合其他方法进行综合评估。
三、营养素标记法营养素标记法是通过标记饲料中的特定营养物质,如氨基酸、脂肪酸等,来评估饲料的消化率。
该方法主要通过测定标记物在动物的排泄物中的浓度变化来估算饲料的消化率。
这种方法具有非侵入性,能够实时监测动物对饲料中各种营养物质的利用情况。
然而,该方法仅适用于特定营养物质的评估,对于其他养分的评估有一定的局限性。
四、体外消化试验法体外消化试验法是通过模拟动物消化系统,测定饲料在体外消化过程中的变化,来评估饲料的消化率。
该方法主要通过采集饲料和消化液,模拟动物的消化过程,评估不同饲料的消化率和营养价值。
体外消化试验法具有简单、快速的优点,能够较准确地评估饲料的消化率。
然而,该方法存在模拟动物消化系统的不精确性,对于饲料中的一些特殊成分评估不准确的问题。
结论:饲料消化率是评估养殖动物对饲料中养分利用的重要指标,准确评估饲料消化率对于改善养殖管理和提高养殖效益具有重要意义。
模拟肠道消化实验报告

一、实验目的为了探究食物在人体肠道中的消化过程,本实验采用模拟肠道消化方法,对某种食物进行体外消化实验,观察食物在模拟肠道环境中的消化情况,并分析消化产物。
二、实验材料1. 实验试剂:模拟消化液、酶制剂、pH缓冲液、指示剂等;2. 实验器材:离心机、恒温箱、分光光度计、消化装置、烧杯、试管等;3. 实验样品:某种食物(如面粉、米饭等)。
三、实验方法1. 模拟消化液的制备:根据模拟肠道消化液成分,配制pH值为6.8的缓冲液,加入适量的消化酶,使酶浓度与人体肠道消化酶浓度相当。
2. 样品处理:将实验样品粉碎,过筛,称取适量样品置于烧杯中,加入适量的模拟消化液,搅拌均匀。
3. 模拟消化过程:将烧杯置于恒温箱中,模拟人体肠道温度(37℃),消化时间为2小时。
4. 消化产物检测:消化结束后,将消化液离心,取上清液进行以下检测:(1)蛋白质含量测定:采用双缩脲法检测消化液中的蛋白质含量;(2)淀粉含量测定:采用碘液法检测消化液中的淀粉含量;(3)脂肪含量测定:采用索氏抽提法检测消化液中的脂肪含量;(4)氨基酸含量测定:采用高效液相色谱法检测消化液中的氨基酸含量。
5. 数据分析:将实验数据与对照样品进行对比分析,评估实验样品在模拟肠道环境中的消化情况。
四、实验结果1. 蛋白质含量:实验样品在模拟肠道环境中的蛋白质含量较对照样品降低,说明蛋白质在模拟消化过程中得到了部分分解。
2. 淀粉含量:实验样品在模拟肠道环境中的淀粉含量较对照样品降低,说明淀粉在模拟消化过程中得到了部分分解。
3. 脂肪含量:实验样品在模拟肠道环境中的脂肪含量较对照样品降低,说明脂肪在模拟消化过程中得到了部分分解。
4. 氨基酸含量:实验样品在模拟肠道环境中的氨基酸含量较对照样品增加,说明蛋白质在模拟消化过程中被分解为氨基酸。
五、实验结论本实验采用模拟肠道消化方法,对某种食物进行了体外消化实验,结果表明:1. 实验样品在模拟肠道环境中的蛋白质、淀粉和脂肪含量均有所降低,说明这些营养成分在模拟消化过程中得到了部分分解;2. 实验样品在模拟肠道环境中的氨基酸含量增加,说明蛋白质在模拟消化过程中被分解为氨基酸。
食品营养成分和功能评价的实验方法

食品营养成分和功能评价的实验方法食品的营养成分和功能评价对于消费者的健康和营养摄入至关重要。
为了准确评估食品的营养价值以及其对人体健康的益处,科学家们开发了多种实验方法。
本文将介绍几种常用的食品营养成分和功能评价的实验方法。
1. 体外消化模拟实验体外消化模拟实验可模拟人体消化过程,评估食物在胃和肠道中的消化。
该方法通过模拟胃酸和酶的作用,在一定的温度、酸度和时间条件下,观察食物在模拟消化过程中的变化,以评估其营养成分的消化率和可利用率。
体外消化模拟实验可以帮助科学家们确定食品中蛋白质、脂肪、碳水化合物等营养成分的消化情况,为食品的配方和工艺改进提供依据。
2. 细胞模型实验细胞模型实验是评估食品功能性成分对细胞生理功能的影响。
科学家们利用细胞培养技术,将特定细胞品系培养在实验室中,并加入不同浓度的食品提取物或功能性成分。
通过观察细胞生长、代谢、氧化应激等指标的变化,确定食品的功能性成分对细胞的影响程度。
这些实验可以评价食品对抗氧化、抗炎、抗肿瘤等功能性特性,有助于开发具有保健功效的食品和药物。
3. 动物实验证明动物实验证明可评估食品对动物生长、免疫功能、内分泌调节等方面的影响。
在实验过程中,科学家们将特定的食品添加到动物的饲料中,观察动物的体重变化、血液生化指标、器官功能等,并与对照组进行比较。
通过这些动物实验证明,科学家们可以评估食品对动物营养需求的满足程度,以及其对动物健康的益处。
这些实验证明为人类食品安全和营养评估提供了参考。
4. 人体实验人体实验是评估食品在人体内的影响和效果的最直接方法。
科学家们通过招募志愿者,设计合理的实验方案,观察特定食品摄入对人体生理指标的影响。
例如,在葡萄糖耐量试验中,科学家们通过测量被试者的血糖水平,评估特定食品对血糖代谢的影响。
人体实验可以更直接、准确地评估食品成分和功能对人体健康的影响,但由于涉及人体,应严格遵循伦理原则和实验安全规范。
综上所述,食品营养成分和功能评价的实验方法包括体外消化模拟实验、细胞模型实验、动物实验证明和人体实验。
体外消化模型的研究进展

内容摘要
为了更深入地探讨7种饲料原料粉碎粒度对蛋白质体外消化率及能耗的影响, 我们设计了一项实验研究。在实验中,我们选取了7种常见的饲料原料,分别为 玉米、豆粕、麦麸、鱼粉、棉粕、菜粕和酵母粉。首先,我们将每种饲料原料分 别粉碎成不同粒度的粉末,然后测定其蛋白质体外消化率和能耗。
内容摘要
实验结果表明,对于不同的饲料原料,粉碎粒度对蛋白质体外消化率及能耗 的影响存在差异。其中,玉米、豆粕和鱼粉的粉碎粒度对蛋白质体外消化率的影 响较为显著,而麦麸、棉粕、菜粕和酵母粉的影响相对较小。此外,粉碎粒度的 变化对蛋白质体外消化率的影响并非单调递增或递减,而是存在一个最优粒度。 对于能耗方Байду номын сангаас,粉碎粒度越小,能耗越高,这与文献综述中的结论一致。
柚子皮多糖的体外消化及其抗氧化活性的变化规律
日常生活中,我们也可以通过食用柚子或柚子制品来摄取柚子皮多糖等有益 健康的成分。除了食用柚子外,我们还可以了解更多有关植物来源的食物和补充 剂的信息,以及它们对我们的健康可能产生的影响。通过合理的饮食和生活方式, 我们可以充分利用这些天然抗氧化物质,提高我们的健康水平并预防疾病。
内容摘要
在讨论中,我们分析了粉碎粒度对蛋白质结构的影响,发现较小的粉碎粒度 有助于改善蛋白质的分散性和溶出性,从而提高其体外消化率。此外,我们还探 讨了粉碎粒度提高蛋白质体外消化率的可能性,认为其可能与提高饲料与消化酶 的接触面积有关。
内容摘要
总之,本项研究证实了7种饲料原料的粉碎粒度对蛋白质体外消化率及能耗具 有显著影响。在实际生产中,应根据不同的饲料原料和养殖需求,选择合适的粉 碎粒度,以充分发挥饲料的营养价值并降低能耗。这一研究结果对于优化畜牧业 生产具有一定的指导意义。
谢谢观看
肉饼体外消化实验报告

肉饼体外消化实验报告
实验目的:
验证肉饼在体外消化过程中的化学反应和分解过程。
实验原理:
体外消化是指将实验样品置于模拟人体胃液和胰液的溶液中,模拟人体消化过程,观察样品在消化液中的反应和分解过程。
胃液中含有胃蛋白酶,可以将蛋白质分解为肽和氨基酸,而胰液中含有胰蛋白酶和胰脂酶,可以进一步将肽和脂肪分解为氨基酸和脂肪酸。
本实验将肉饼置于模拟胃液和胰液中,观察肉饼的消化过程。
实验步骤:
1. 准备实验所需的材料,包括肉饼、模拟胃液、模拟胰液等。
2. 将肉饼置于模拟胃液中,放置一段时间,观察肉饼在胃液中的变化。
3. 将肉饼从胃液中取出,置于模拟胰液中,放置一段时间,观察肉饼在胰液中的变化。
4. 观察实验结果,记录下肉饼在胃液和胰液中的变化情况。
实验结果:
在模拟胃液中,肉饼经过一段时间的浸泡,变得柔软,并有一些褐色液体从肉饼中渗出。
在模拟胰液中,肉饼进一步分解,变得更为柔软,并有更多的褐色液体从肉饼中渗出。
实验讨论:
根据实验结果,可以得出肉饼在体外消化过程中的化学反应和
分解过程。
当肉饼置于胃液中时,胃蛋白酶开始将蛋白质分解为肽和氨基酸,导致肉饼变得柔软并有一些褐色液体渗出。
当肉饼进一步置于胰液中时,胰蛋白酶和胰脂酶进一步将肉饼中的肽和脂肪分解为氨基酸和脂肪酸,导致肉饼变得更为柔软并有更多的褐色液体渗出。
实验结论:
肉饼在体外消化过程中,经过胃液和胰液的作用,逐渐分解为氨基酸和脂肪酸。
体外模拟消化法优化生长猪饲粮非淀粉多糖酶谱

体外模拟消化法优化生长猪饲粮非淀粉多糖酶谱导读非淀粉多糖(NSP)作为一种抗营养因子,常影响畜禽饲粮营养物质的消化。
NSP 酶由于可降低NSP 的抗营养作用,越来越受到关注。
许多研究表明,NSP 酶能够降低NSP 的抗营养作用,提高营养物质利用率,改善肠道健康。
但是也有研究发现,NSP 酶对猪生产性能、营养物质利用率没有影响。
由于不同饲粮中NSP的含量和组成差异较大,而NSP 酶作为生物反应的催化剂,对底物具有专一性,因此,NSP 酶的合理配伍是充分发挥其对饲粮中NSP 降解作用的关键。
但是针对不同的饲粮,通过动物试验方法来筛选与之相适应的NSP 酶的配伍,不但工作量巨大,而且结果变异比较大,不能满足实际需求。
近年来,一些研究者通过体外模拟消化的方法来研究饲粮中添加NSP 酶的效果,为高效、快速的优化NSP 酶的配伍提供了一个可行的途径。
王恩玲等和何科林等使用胃蛋白酶-胰液素的体外2 步模拟消化法对NSP 酶在家禽饲粮中的作用效果进行了体外评定,取得了良好的促生产效果。
Narasimha 等使用体外消化法成功筛选出了纤维素酶、木聚糖酶和β-葡聚糖酶在几种饲料原料中的最佳组合。
但是,使用体外模拟消化法优化生长猪不同饲粮NSP 酶谱的研究目前还没有报道。
此外,胰液素是含有多种消化酶的复合物,不同批次之间组成有所不同,无法实现模拟肠液的重复以及测试重演性的需求。
本实验室前期在研究生长猪小肠液组成的基础上开发了猪模拟小肠液,并在猪饲粮的体外模拟消化上取得了较好的效果。
因此,本试验使用基于生长猪生理消化液组成依据的体外三角瓶2 步消化法,在玉米-豆粕型和玉米-杂粕型2 种不同类型的生长猪饲粮中使用6 种NSP 酶,探讨NSP 酶对不同类型饲粮的作用效果,探索优化猪饲粮中NSP酶配伍的方法,为NSP 酶在猪饲粮中的高效使用提供依据。
1材料与方法1.1 NSP 酶及酶活性测定选用纤维素酶、木聚糖酶、β-葡聚糖酶、β-甘露聚糖酶、α-半乳糖苷酶和果胶酶6 种NSP酶。
体外消化实验
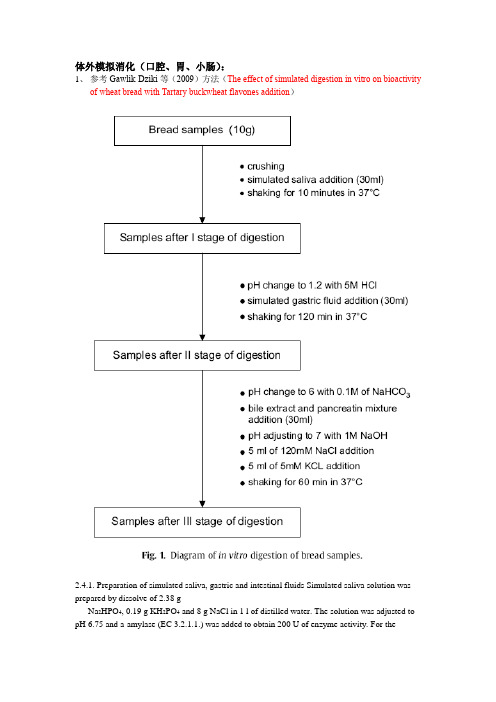
体外模拟消化(口腔、胃、小肠):1、参考Gawlik-Dziki等(2009)方法(The effect of simulated digestion in vitro on bioactivityof wheat bread with Tartary buckwheat flavones addition)2.4.1. Preparation of simulated saliva, gastric and intestinal fluids Simulated saliva solution was prepared by dissolve of 2.38 gNa2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and a-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For thegastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal. juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2.4.1. Preparation of simulated saliva, gastric and intestinal fluidsSimulated saliva solution was prepared by dissolve of 2.38 g Na2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and α-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For the gastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2、参考Versantvoort等(2005)(Applicability of an in vitro digestion model in assessing thebioaccessibility of mycotoxins from food)和Hur等(2009)的方法(Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion)Table 1Constituents and concentrations of the various synthetic juices of the in vitro digestion model representing fed conditionsSaliva 唾液Gastric juice 胃液Duodenal juice十二指肠液Bile juice 胆汁Inorganic solution 10 ml KCl 89.6g/l15.7 ml NaCl 175.3g/l40 ml NaCl175.3g/l30 ml NaCl175.3g/l10 ml KSCN20g/l3.0 ml NaH2PO4 88.8g/l40 ml NaHCO384.7 g/l68.3 ml NaHCO384.7 g/l10 ml NaH2PO488.8 g/l9.2 ml KCl 89.6 g/l10 ml KH2PO48g/l4.2 ml KCl 89.6 g/l 10 ml NaSO457g/l18 ml CaCl2· 2H2O22.2 g/l6.3 ml KCl89.6 g/l150 μl HCl 37%g/g1.7 ml NaCl175.3 g/l10 ml NH4Cl 30.6 g/l10 ml MgCl2 5g/l20 ml NaHCO384.7 g/l6.5 ml HCl 37%g/g180 μl HCl37%g/gOrganic solution 8 ml urea 25 g/l10 ml glucose 65 g/l 4 ml urea 25 g/l10 ml urea 25 g/l10 ml glucuronic acid(葡萄糖醛酸) 2g/l3.4 ml urea 25g/l10 ml glucosaminehydrochloride (盐酸氨基葡萄糖) 33g/lAdd to mixtureorganic+ inorganic solution290 mgα-amylase1g BSA9mlCaCl2· 2H2O22.2 g/l10ml CaCl2· 2H2O22.2 g/l15 mg uric acid 2.5 g pepsin1g BSA 1.8 g BSA25 mg mucin 3 g mucin9 g pancreatin30 g bile1.5 g lipasepH 6.8 ± 0.2 1.30 ± 0.028.1 ± 0.28.2 ± 0.2 The inorganic and organic solutions are augmented to 500ml with distilled water. After mixing of the inorganic and organic solutions, some further constituents are added and dissolved. If necessary, the pH of the juices is adjusted to the appropriate interval.另外,抗性淀粉含量测定:1、参考Li等(2008)方法(Characterization of maize amylose-extender (ae) mutant starches. PartI: Relationship between resistant starch contents and molecular structures)2.3. Resistant starch (RS) contentRS contents of the ae-mutant starch samples were determined using the AOAC Method 991.43 for total dietary fiber (AOAC, 2003) and Englyst’s method (1992) for comparison.For the AOAC 991.43 method, starch (1.0 g, dry-starch basis, dsb) was suspended in a Mes-tris buffer solution (0.05 M, 40 ml) and hydrolyzed with 500 u of a-amylase from Bacilluslicheniformis (Sigma Chemical, Cat. No. A3403) in a boiling water-bath for 30 min with stir. The sample was then digested with protease from Bacillus licheniformis (5 mg, Sigma Chemical, Cat. No. P3910) at 60 ºC in a shaker waterbath for 30 min. The sample dispersion was adjusted to pH 4.4–4.6 by adding HCl and then hydrolyzed with amyloglucosidase (300 U, Sigma chemical, Cat. No. A9913) at 60 ºC in a shaker water-bath for 30 min. The digested sample was filtered through a celite layer in a crucible and washed twice with 15 ml of 78% ethanol, twice with 15 ml of 100% ethanol and rinsed with 15 ml of acetone. The remaining sample was dried in an oven at 100 ºC overnight. The resistant starch content was calculated using the equation:(%)RS content = Remaining sample weight (g, dsb)/initial sample weight (g, dsb) ×100%For RS determined using Englyst’s method (1992), Starch (1.000 g, db) in 20 mL of sodium acetate buffer (0.1 M, pH 5.2) was cooked in a boiling water-bath for 30 min. The starch dispersion was cooled down to 37 ºC, mixed with an enzyme solution (5 mL) consisting of pancreatin extract and amyloglucosidase, and incubated in a water-bath at 37 ºC. The pancreatin extract was prepared as follows; 3.0 g of pancreatin (Sigma, Cat. No. P7545) was suspended in 20 mL deionized water, stirred for 10 min at room temperature, and centrifuged at 1500g for 10 min. The enzyme solution was prepared by mixing 13.5 ml supernatant of pancreatin extract, 210 U amyloglucosidase (Sigma, Cat. No. A7095), and 1.0 mL deionized water. The rapid digestible starch (RDS) was defined as the total starch digested within the first 20 min, and the slowly digestible starch (SDS) was the starch digested between 20 and 120 min (Englyst et al., 1992). The resistant starch content was calculated as follows:(%)RS content = 100%×(total starch – RDS - SDS) (g, dsb)/total starch (g, dsb)。
消化实验方法总结

《豆粕粉碎粒度与蛋白质体外消化率的关系研究》采用胃蛋白酶-胰酶两步法,通过体外模拟鸡体消化道内环境来比较不同粉碎力度豆粕的蛋白消化率,从而确定适合肉仔鸡生长的较适宜豆粕粉碎力度。
白消化率,从而确定适合肉仔鸡生长的较适宜豆粕粉碎力度。
平均粒径采用GB 6971-86 方法,体外试验采用Boisen 和Fernandez 等体外模拟消化方法。
等体外模拟消化方法。
胃蛋白酶最适浓度的选择1g 豆皮→豆皮→100ml 100ml 三角瓶三角瓶+25ml +25ml 磷酸缓冲液(磷酸缓冲液(pH=6.0 0.01M pH=6.0 0.01M )+10ml 盐酸(盐酸(0.2M 0.2M 0.2M)→温和搅拌)→温和搅拌+1ml(15mg/ml,30mg/ml,45mg/ml,60mg/ml,75mg/ml,90mg/ml)的新鲜胃蛋白酶溶液(由0.01M HCl 配制)配制),pH=2.0 +0.5ml 抑菌剂(青霉素抑菌剂(青霉素++链霉素)→链霉素)→393939℃恒温水浴中震荡℃恒温水浴中震荡6h,6h,消消化后化后+20%+20%+20%黄基水杨酸黄基水杨酸5ml 5ml→室温静置→室温静置30min 30min→抽滤→干燥后残渣凯式定氮法测蛋白质含量→→抽滤→干燥后残渣凯式定氮法测蛋白质含量→计算蛋白质和干物质消化率。
确定最适胃蛋白酶浓度为75mg/ml.胰酶最适浓度选择在最适(75mg/m )胃蛋白酶液消化后的产物中加入10ml 磷酸缓冲液(0.2M pH=6.8)+5mlNaoH(0.6M)+1ml(70mg/ml,90mg/ml,110mg/ml,130mg/ml,150mg/ml)的胰酶溶液(由磷酸二氢钾缓冲液配制)pH=6.8→3939℃恒温水浴中震荡℃恒温水浴中震荡18h 18h→消化后→消化后→消化后+20%+20%+20%磺基水杨酸磺基水杨酸5ml 5ml→室温→室温静置30min 30min→抽滤,干燥后残渣按照凯式定氮法测其蛋白质含量,计算粗蛋白和干物质消化→抽滤,干燥后残渣按照凯式定氮法测其蛋白质含量,计算粗蛋白和干物质消化率,确定最适胰酶浓度为110mg/ml 110mg/ml。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
体外模拟消化(口腔、胃、小肠):1、参考Gawlik-Dziki等(2009)方法(The effect of simulated digestion in vitro on bioactivityof wheat bread with Tartary buckwheat flavones addition)2.4.1. Preparation of simulated saliva, gastric and intestinal fluids Simulated saliva solution was prepared by dissolve of 2.38 gNa2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and a-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For thegastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal. juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2.4.1. Preparation of simulated saliva, gastric and intestinal fluidsSimulated saliva solution was prepared by dissolve of 2.38 g Na2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and α-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For the gastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2、参考Versantvoort等(2005)(Applicability of an in vitro digestion model in assessing thebioaccessibility of mycotoxins from food)和Hur等(2009)的方法(Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion)Table 1Constituents and concentrations of the various synthetic juices of the in vitro digestion model representing fed conditionsSaliva 唾液Gastric juice 胃液Duodenal juice十二指肠液Bile juice 胆汁Inorganic solution 10 ml KCl 89.6g/l15.7 ml NaCl 175.3g/l40 ml NaCl175.3g/l30 ml NaCl175.3g/l10 ml KSCN20g/l3.0 ml NaH2PO4 88.8g/l40 ml NaHCO384.7 g/l68.3 ml NaHCO384.7 g/l10 ml NaH2PO488.8 g/l9.2 ml KCl 89.6 g/l10 ml KH2PO48g/l4.2 ml KCl 89.6 g/l 10 ml NaSO457g/l18 ml CaCl2· 2H2O22.2 g/l6.3 ml KCl89.6 g/l150 μl HCl 37%g/g1.7 ml NaCl175.3 g/l10 ml NH4Cl 30.6 g/l10 ml MgCl2 5g/l20 ml NaHCO384.7 g/l6.5 ml HCl 37%g/g180 μl HCl37%g/gOrganic solution 8 ml urea 25 g/l 10 ml glucose 65 g/l 4 ml urea 25 g/l 10 ml urea 25 g/l10 ml glucuronic acid(葡萄糖醛酸) 2g/l3.4 ml urea 25g/l10 ml glucosaminehydrochloride (盐酸氨基葡萄糖) 33g/lAdd to mixtureorganic+ inorganic solution290 mgα-amylase1g BSA9mlCaCl2· 2H2O22.2 g/l10ml CaCl2· 2H2O22.2 g/l15 mg uric acid 2.5 g pepsin 1g BSA 1.8 g BSA25 mg mucin 3 g mucin 9 g pancreatin 30 g bile1.5 g lipasepH 6.8 ± 0.2 1.30 ± 0.02 8.1 ± 0.2 8.2 ± 0.2 The inorganic and organic solutions are augmented to 500ml with distilled water. After mixing of the inorganic and organic solutions, some further constituents are added and dissolved. If necessary, the pH of the juices is adjusted to the appropriate interval.另外,抗性淀粉含量测定:1、参考Li等(2008)方法(Characterization of maize amylose-extender (ae) mutant starches. PartI: Relationship between resistant starch contents and molecular structures)2.3. Resistant starch (RS) contentRS contents of the ae-mutant starch samples were determined using the AOAC Method 991.43 for total dietary fiber (AOAC, 2003) and Englyst’s method (1992) for comparison.For the AOAC 991.43 method, starch (1.0 g, dry-starch basis, dsb) was suspended in a Mes-tris buffer solution (0.05 M, 40 ml) and hydrolyzed with 500 u of a-amylase from Bacilluslicheniformis (Sigma Chemical, Cat. No. A3403) in a boiling water-bath for 30 min with stir. The sample was then digested with protease from Bacillus licheniformis (5 mg, Sigma Chemical, Cat. No. P3910) at 60 ºC in a shaker waterbath for 30 min. The sample dispersion was adjusted to pH 4.4–4.6 by adding HCl and then hydrolyzed with amyloglucosidase (300 U, Sigma chemical, Cat. No. A9913) at 60 ºC in a shaker water-bath for 30 min. The digested sample was filtered through a celite layer in a crucible and washed twice with 15 ml of 78% ethanol, twice with 15 ml of 100% ethanol and rinsed with 15 ml of acetone. The remaining sample was dried in an oven at 100 ºC overnight. The resistant starch content was calculated using the equation:(%)RS content = Remaining sample weight (g, dsb)/initial sample weight (g, dsb) ×100%For RS determined using Englyst’s method (1992), Starch (1.000 g, db) in 20 mL of sodium acetate buffer (0.1 M, pH 5.2) was cooked in a boiling water-bath for 30 min. The starch dispersion was cooled down to 37 ºC, mixed with an enzyme solution (5 mL) consisting of pancreatin extract and amyloglucosidase, and incubated in a water-bath at 37 ºC. The pancreatin extract was prepared as follows; 3.0 g of pancreatin (Sigma, Cat. No. P7545) was suspended in 20 mL deionized water, stirred for 10 min at room temperature, and centrifuged at 1500g for 10 min. The enzyme solution was prepared by mixing 13.5 ml supernatant of pancreatin extract, 210 U amyloglucosidase (Sigma, Cat. No. A7095), and 1.0 mL deionized water. The rapid digestible starch (RDS) was defined as the total starch digested within the first 20 min, and the slowly digestible starch (SDS) was the starch digested between 20 and 120 min (Englyst et al., 1992). The resistant starch content was calculated as follows:(%)RS content = 100%×(total starch – RDS - SDS) (g, dsb)/total starch (g, dsb)澳大利亚NI 消化系统图片GI20。
