质量负责人质量管理体系内部审核报告
质量管理体系内部审核制度

目的:为了保证公司质量管理体系运行的适宜性、充分性和有效性,审核现有质量体系的运行是否可以保证所经营药品的质量,制定本制度。
范围:适用于本公司质量管理体系所覆盖的所有工作区域和GSP要求的内部审核。
责任:质量管理部及公司各部门对本制度实施负责。
内容:1、质量管理体系审核范围主要包括全面内审(GSP规范的全部内容)和专项内审。
公司发生下列情况时进行专项内审:经营范围发生变更;企业负责人、质量负责人、质量机构负责人变更;经营场所、仓库地址变更、仓库新、改(扩)建;空调系统、温湿度自动监测系统、计算机系统更换;质量体系文件修订等。
2、公司成立内审领导小组,总经理为领导小组组长,质量副总为副组长、各部门负责人为成员。
质量管理部具体负责组织审核工作,从各部门抽调精通经营业务与质量管理且具有较强原则性的人员参加现场检查评审。
3、质量管理部负责制定内审计划、实施方案、现场检查标准及编写评审报告,并将内审报告交给总经理签字批准。
4、各部门负责提供本部门质量管理工作的评审资料。
5、审核工作按年度进行,于每年的12月份组织实施.特殊情况下,如公司在GSP 认证期间可以增加质量体系审核的频次,更好的推动GSP工作的开展与实施。
6、建立质量管理体系审核记录,包括内审现场评审记录,问题汇总记录,问题调查分析记录,纠正与预防意见,问题整改记录,跟踪检查记录。
7、纠正与预防措施的实施与跟踪:7.1质量体系审核过程中要对存在的缺陷进行认真分析,在此基础上提出纠正与预防措施;7.2各部门根据评审结果制定改进措施,并将责任落实到具体岗位;7.3质量管理部负责对纠正与预防措施的具体实施情况及有效性进行跟踪检查,包括对改进后的情况进行再评价、再审核。
并将内审结果应用到质量体系文件修订、员工培训等质量管理过程中。
8、质量管理体系审核应按照规范的格式记录,记录由质量管理部门负责归档。
9、质量管理体系审核的具体操作按质量体系内审规程执行。
质量负责人岗位职责与权限

质量负责人岗位职责与权限
⑴负责确保质量管理体系所需的过程得到建立,实施和保持。
⑵负责向公司总经理报告质量管理体系的业绩和任何改进的需求。
⑶负责公司内部提高满足政府与客户要求的意识。
⑷负责质量管理体系有关事宜的外部联络。
⑸负责主持质量管理体系内部质量审核工作。
⑹负责编制管理评审计划,并提供输入和编制评审报告。
⑺根据管理评审、内部审核以及受检方反馈信息,对形成检验检测过程中的质量问题,组织分析研究,确定预防、纠正措施。
⑻负责组织审定公司各种各类检验报告和记录的项目格式内容,并且对其合理性、正确性、完整性负全责。
⑼定期召开检验质量分析会,总结检验工作质量情况,提出控制措施和处理意见。
⑽负责抱怨、质量事故、质量分析过程的处理工作。
⑾负责检验、检测样品的管理。
⑿参与组织人力资源和对全体人员的考核奖惩。
⒀完成公司总经理安排的其他工作。
品质体系审核工作总结汇报

品质体系审核工作总结汇报
尊敬的领导和各位同事:
我很荣幸能够在此向大家汇报我所负责的品质体系审核工作。
在过去的一段时
间里,我和我的团队致力于建立和维护公司的品质体系,以确保我们的产品和服务能够满足客户的需求并达到国际标准。
在品质体系审核工作中,我们首先对公司的品质管理体系进行了全面的评估和
分析,以确保其符合ISO9001等相关标准的要求。
我们对各个部门的品质管理流
程进行了深入调研,并提出了一系列改进建议,以提高整体的品质管理水平。
同时,我们也对公司的产品和服务进行了全面的检查和测试,确保它们符合客户的期望和要求。
在审核过程中,我们发现了一些问题和不足之处,并及时提出了改进措施。
我
们与各个部门的负责人进行了充分的沟通和协调,共同制定了改进计划,并监督了改进措施的实施情况。
通过我们的努力,公司的品质管理体系得到了显著的改善,产品和服务的品质也得到了有效的提升。
在未来的工作中,我们将继续加强对品质体系的监督和管理,确保其持续有效
运行。
同时,我们也将继续与各个部门密切合作,共同推动公司品质管理水平的提升,为客户提供更优质的产品和服务。
最后,我要感谢所有参与品质体系审核工作的同事们,是你们的辛勤工作和支持,才使得我们取得了这些成绩。
同时,也要感谢公司领导对品质管理工作的重视和支持。
我们将继续努力,为公司的发展贡献自己的力量。
谢谢大家!。
环境监测站质量体系内部审核报告

XXX环境监测站质量管理体系内部审核报告(二○一二年度)XXX环境监测站二○一二年十一月质量管理体系内部审核报告(二○一二年度)编写人: X X X审核人:X X X签发人:X X XXXX环境保护监测站质量管理体系内部审核报告(2012年度)XXX环境监测站依据实验室资质认定评审准则工作的要求和2012年内审计划安排,于2012年11月12日-12月3日对本站质量管理体系的运行情况进行了集中式的全面审核。
一、内部审核目的通过对质量体系开展内部审核,验证其运行是否符合质量体系文件和《实验室资质认定评审准则》的要求,以促进质量体系规范有序的运作。
将内审结果作为管理评审输入,以保证管理体系有效运行及持续改进。
二、内部审核范围本次内部审核主要是针对新制订的质量管理体系文件首次进行的内部审核,按照《实验室资质认定评审准则》的评审程序,对照评审准则19个要素、75条、180款,对我站质量管理体系进行逐条审核,审核范围包括我站的质量管理体系、文件控制、分包、服务和供应品采购、合同管理、申诉和投诉、纠正措施和预防措施、记录、人员、设施和环境条件、监测分析方法、仪器设备、标准物质、量值溯源、样品采集、样品管理、样品分析、质量管理、监测分析结果与报告等。
三、内部审核依据1.《2012年XXX环境监测站质量保证计划》。
2.《实验室资质认定评审准则》。
3. XXX环境监测站质量管理体系文件。
4.国家或行业的有关法律、法规、规章和标准。
四、内部审核方法通过查阅记录/报告/文件、现场检查、调查验证、与受审部门责任人及有关人员交谈、提问等多种方法五、内部审核组构成组长:XXX成员:XXX、XXX六、内部审核程序1.提出内部审核计划质量负责人安排开展我站质量管理体系内部审核工作,质量管理室编写审核实施方案,形成站内正式文件并发放相关科室。
2.成立内部审核小组我站本次质量管理体系内部审核小组,组长由质量负责人担任,小组成员由内审员担任。
质量负责人变更专项内审(计划、内审检查记录、综合素质调查、内审报告)
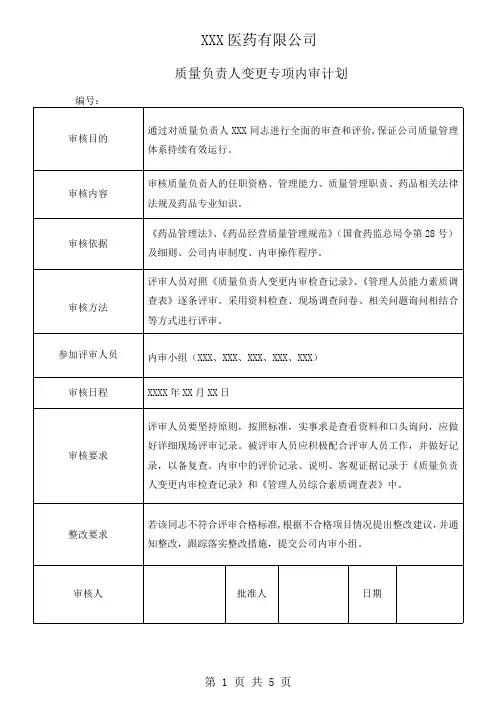
XXX医药有限公司
质量负责人变更专项内审计划
XXX医药有限公司
质量负责人变更内审检查记录
第2页共5页
管理人员综合素质调查表
进书明显践,效果不明显自己的能力,学习
后用于实践,效果
较明显
其他要求会议组织
能有效主持会议,把握会议节奏,明确会议内容,顺利安排会议任务
□能□不能
信息沟通
对本岗位所产生的信息(报表、计划、总结等)及时向上级汇报,同时也能
及时从下级获得此类信息□能□不能
综合评定
内审组员签字:
年月日内审组长签字:
年月日
XXX医药有限公司
质量负责变更专项内审报告编号:。
五、内审计划、通知、内部评审报告(GSP)

GSP质量体系内审计划内审时间:2015.11.22. -11.26内审标准:新版《药品经营质量管理规范》内审目的:为了审核我公司执行新版《药品经营质量管理规范》的具体落实情况,结合我公司的实际,对公司质量管理体系进行内审。
确保公司质量管理体系运行符合新版GSP要求。
参加人员:公司负责人(组长):质量负责人(副组长):成员:各部门负责人、各柜组负责人第一组:第二组:内审步骤:1、2015.11.22上午召开首次会议2、2015.11.23现场检查和各岗位实际操作3、2015.11.23检查各项记录4、2015.11.24总结评审5、2015.11.26召开末次会议6、2015.11.23-30跟踪整改公司质量负责人:2015.11.18GSP质量体系内部审核通知公司各部门:一、根据新版《药品经营质量管理规范》的规定,为保证公司质量体系系统持续有效的进行,经质量领导小组决定,于2015年11月22日至11月26日对公司质量体系进行首次内部审核。
二、审核人员审核小组组长:审核小组成员:各部门、各岗位负责人三、审核方式:GSP现场检查和审阅软件(记录、凭证)、计算机功能。
四、审核内容:包括质量体系所涉及的所有部门及场所。
主要针对各部门在实施GSP过程中,是否符合GSP的有关规定,对所审核的内容如实记录。
对审查不符合规定的部门应作出整改措施,并限期在10天内整改。
若在下次检查中发现仍不符合GSP要求的,视情节轻重将给予必要的惩罚。
哈尔滨国健大药房有限公司质量领导小组2015年11月18日质量内审首次会议记录会议时间:2015.11.22上午9.00-11.30地点:营业室参加人员:公司负责人(组长):质量负责人(副组长):成员:各部门负责人、质管部全体人员会议内容:1.企业负责人讲解我公司执行新版《药品经营质量管理规范》的前期工作(投入的人力、物力)情况2.质量负责人做前期质量管理工作总结3.安排内审详细步骤、时间、参加人员。
内部质量管理体系审核
内部质量管理体系审核(总58页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--内部质量管理体系的审核质量管理体系审核的分类质量管理体系审核的分类质量管理体系审核分为:(1) 内部质量管理体系审核,也称第一方审核,是组织的自我审核。
(2) 外部质量管理体系审核,包括第二方和第三方审核。
第二方审核是顾客对组织的审核,第三方审核是第三方性质的认证机构对申请认证组织的审核。
各类质量管理体系审核的区别内部质量管理体系审核与外部质量管理体系审核从审核的目的、审核方组成、审核依据、审核人员以及审核后的处理不同。
表7-1列出了它们的区别。
表7-1 内、外部质量管理体系审核的区别第一方审核,以质量手册所列范围为准。
第二方审核,以ISO9001标准为依据,但标准中所列的条款可以剪裁,这些都应在合同中明确规定。
第三方审核,标准中所列条款一个也不能少,除非申请认证的组织有充分的理由说明可以剪裁某些条款。
质量管理体系内部审核员内审员的条件内审员的注册不是强制性的,企业可以自己任命内审员,内审员一般应具备下列条件:(1) 教育程度具有中专以上学历(2) 培训需接受有内审员培训资格的机构的培训,并取得培训合格证书。
(3) 工作经历三年以上工作经验,至少有一年质量管理和企业管理的经验。
(4) 个人素质思路开阔,成熟,很强的判断和分析能力,看问题客观公正,坚持原则等。
(5) 基本能力了解审核程序,方法和技巧;熟悉组织情况、管理体系文件;掌握基本的法律法规知识等。
(6) 专业能力对质量管理的原则和技术熟练,了解作业过程、产品和服务。
内审员的个人素质(1) 开放式思维。
愿意考虑不同的想法和观点。
(2) 善于交往。
与人交往的能力与技巧。
(3) 觉察能力。
视觉、嗅觉和听觉等感觉的应用。
(4) 反应能力。
对外界的直觉反应能力。
(5) 执着。
坚持不懈,不受外界干扰及追求目标的能力。
(6) 决定能力。
管理评审总结报告(热门6篇)
管理评审总结报告篇1时间:xxx年12月31日地点:xx市计量所会议室主持人:记录人:参加评审人员:所长、副所长、质量负责人、技术负责人、各科负责人会议内容记录:一.由所长报告本次管理评审会议的目的、依据、评审内容。
二.监督员汇报xxx年监督情况。
三.由质量负责人向与会人员汇报:年内部审核情况:共发现11项不符合项,这些不符合项没有对质量体系的正常运行造成不良后果。
2.对内审中发现的不符合项的纠正情况:内审员在规定的期限内跟踪审核,并对纠正措施进行验证。
对审核过程中一些小问题,现场进行了纠正,所有纠正措施均验证有效。
本次内审以抽查为主,所以带有一定的偶然性,为此要求各部门在纠正整改时,要举一反三,找出相关的不合格,并予以纠正整改。
各部门负责人应进一步加强对标准、质量手册、程序文件的学习,认真理解和掌握文件的精神内容,明确自己的职责,严格按照文件的规定要求确保质量体系持续有效的运行。
通过此次内部质量体系审核,验证了所按照JJF1069-《法定计量检定机构考核规范》、CNAS-CL01:xxx《检测和校准实验室的认可准则》(等同ISO/IEC17025:xx)、(国认实函[xxx ]141号)《实验室资质认定评审准则》建立的质量管理体系,运行是基本符合的、是基本有效的。
四.技术负责人向与会人员汇报质量方针、质量目标等的实施情况:1、质量方针全体员工认真学习方针,并在体系运行过程中把方针要求作为指导,取得了一定的进步。
经管理评审会议的讨论,认为方针是适合实验室的,并体现了持续改进及预防的思想,今后应在此方针指导下,进一步落实,取得更大的成效。
2、对体系持续适用性、充分性和有效性的评估:(1)、适用性:在管理评审会议中未提出对体系文件、方针政策的修改意见,确定体系目前无需修改。
(2)、充分性:体系文件全面覆盖了标准各要素要求,并针法律、法规和标准,结合本实验室情况制定了相应的目标、程序、管理措施等,体系策划建立较充分。
2质量管理体系内部审核管理规程
质量管理体系内部审核管理规程1 目的为规范质量管理体系内部审核的检查与评价,确保质量管理体系运行的充分性、适宜性及有效性,并满足质量过程控制,特制定本规程。
2 适用范围本规程适用于对公司质量管理体系内部审核活动的管理。
3 职责公司总经理、质量负责人、质量管理部对本规程的实施负责。
3.1.质量管理部是质量管理体系内部审核的主管部门,总经理是内部质量管理体系审核的总负责人,质量负责人是内部质量管理体系审核的直接负责人。
3.2.各部门负责人是质量管理体系审核的组成人员。
4 内容4.1.由专门成立的质量管理体系内部审核小组负责质量管理体系审核工作,成员包括:4.1.1.总经理,任组长。
4.1.2.质量负责人,任副组长。
4.1.3.各部门负责人为组员。
4.2.4.必要时,可邀请代储代配受托方企业提供相关人员姓名及岗位,配合进行内部审核。
4.2.质量管理部出具《内部评审计划》并附《内部评审方案》经质量负责人审核,报总经理批准。
因时间调整需延期开展内审的,由质量管理部报总经理批准后方可延期内审。
4.3.内部审核(后简称为内审)分为:换证前内审、定期内审、专项内审。
4.4.内审频率:4.4.1.定期内审,每年进行一次,内审应在当年12月或下年1月进行。
4.4.2.因药品质量原因而发生重大质量事故,并造成严重后果的,应组织专项内审。
4.4.3.服务质量出现重大问题或顾客投诉、新闻曝光,造成不良影响时,应进行专项内审。
4.4.4.药品经营许可证到期换证检查前应进行1-2次内审。
4.4.5.在对质量管理体系文件进行修订或新颁布某项文件后,应在下一次质量制度执行情况检查时,对新颁布制度的执行情况进行检查。
4.4.6.公司的组织结构、企业负责人、质量负责人、质量管理部负责人、质量管理体系文件、计算机系统等质量管理体系关键要素发生重大变动时应组织专项内审。
4.5.评审第一天召开会议,参会人员为质量管理体系内审小组全体人员,内容包括本次内审的目的、范围、依据、方式、内审组成员、内审日程安排及其他有关事项,质量管理部会议记录并存档管理;4.6.内审人员按《药品经营质量管理规范》进行检查。
内部审核报告(4篇)
针对不符合项,开具了“内审不符合报告”,责成相关部门对本部门出现的不符合项进行了整改与纠正。在规定的时间内,经过内审员对不符合项的改善效果进行了追踪确认,均已经得到不同程度的改善,是有效的。后续将对本次出现的不符合项再进行跟踪确认。在本次审核中,各部门仍有人对体系文件的要求还不太熟悉,执行力度不够彻底。在后续的工作中,应努力并严格按文件要求去执行。
本次质量管理体系内部审核的结论:
1.公司质量管理体系自运行以来,公司质量管理体系是符合的,有效的;
2.质量管理体系存在需改进的细节,应整改。
纠正措施整改要求:按照内审不符合报告要求,在一周内纠正完毕。
本报告分发对象
本报告副本分发至公司管理层人员、部门负责人。本报告正本包括内部审核报告、内审不符合报告,正本由人事部保存。
审核概述:
公司根据2021年度内审计划安排于2021-09-25至2021-09-26进行了内部管理体系审核。本次审核对质量、环境、职业健康安全管理体系覆盖的所有管理层人员、职能部门进行了现场审核,审核涉及管理手册覆盖的所有管理体系要求。本次内审在公司领导的重视和各职能部门的支持和配合下顺利完成。
审核组通过询问、交谈、现场观察、查阅文件资料及记录的方式进行审核,共发现一般不符合项1项。
审核组通过询问、交谈、现场观察、查阅文件资料及记录的方式进行审核,共发现一般不符合项1项。
本次审核发出了1份不符合报告,但总体感觉员工对质量管理体系工作掌握得比较好,在本职工作中还是能够按照管理体系的要求执行。但是在公司还是存在少数几个人对质量管理体系文件理解还不是很到位,加之工作责任心不够,导致这次内审过程中出现的一些不符合项,这还是要引起足够的重视,管理者代表在末次会议上要求公司各部门员工加强工作责任心,加强质量管理体系文件的学习,一定要结合管理体系文件的规定和要求,力求把各项工作做得更好。要加强产品监督管理,认真制订纠正预防措施实施整改,并在今后的工作中加强对存在问题环节的控制,举一反三,做好质量管理体系运行工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
审核日期:
2013年9月12日
受审核部门:
公司经理室
审核组长:
苏天幸
审 核 员:
黄少雄、颜建清、潘喜庆
质量管理体系内部审核报告
(2013年度)
永春县医药公司
二○一三年九月十二日
2013年度内部审核报告
第1页 共3页
审核目的:
检查质量负责人变更是否对质量管理体系文件有效实施有影响;验证质量管理体系的符合性和有效性,为质量管理体系的持续改进提供依据。
审核范围:
质量管理体系涉及的经理室、过程和工作场所。
审核准则:
