知识点21化学平衡图像习题
化学平衡图像专题(超详细版)

v
v正
v逆
T1
T2
T
判断正反应是放热还是吸热?
正反应吸热
精选课件
28
五、其它: 对于反应mA(g)+nB(g)
v
v正 v逆
pC(g)+qD(g)
T 判断正反应是放热还是吸热?
正反应吸热
精选课件
29
例10 甲图中C%表示反应物的百分含量,t表示反应时 间,乙图中v表示反应速率,p表示压强,T1、T2表示
,并作出其随反应温度(T)变化的关系图。下列示意图中
,可能与实验结果相符的是 BD
精选课件
32
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
精选课件
30
五、其它:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
C%
A%
450℃
T
•正反应放热
P1
P
•m+n<p+q
精选课件
31
12.(2009年广东卷)取5等份NO2 ,分别加入温度不同、 容积相同的恒容密闭容器中,发生反应:
2NO2(g)
N2O4(g) H <0
反应相同时间后,分别测定体系中NO2的百分量(NO2%)
v
v逆
v
v正
v逆
v正
t1
t2 t
t1
t2 t
若对以上反应已知m+n>p+q,平衡后降
低压强时,画出相关精选的课件v – t图。
8
对于反应A(g)+3B(g) 2C(g)+D(g)(正反应 放热)有如下图所示的变化,请分析引起平衡
化学平衡图像(习题精练含解析)
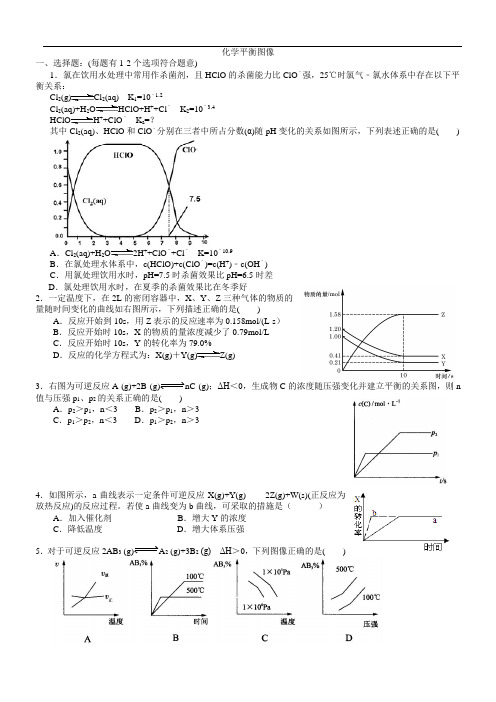
化学平衡图像一、选择题:(每题有1-2个选项符合题意)1.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO﹣强,25℃时氯气﹣氯水体系中存在以下平衡关系:Cl 2(g)Cl2(aq) K1=10﹣1.2Cl 2(aq)+H2O HClO+H++Cl﹣K2=10﹣3.4HClO H++ClO﹣K a=?其中Cl2(aq)、HClO和ClO﹣分别在三者中所占分数(α)随pH变化的关系如图所示,下列表述正确的是( ) A.Cl 2(aq)+H2O2H++ClO﹣+Cl﹣K=10﹣10.9B.在氯处理水体系中,c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差D.氯处理饮用水时,在夏季的杀菌效果比在冬季好2.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)3.右图为可逆反应A (g)+2B (g)nC (g);ΔH<0,生成物C的浓度随压强变化并建立平衡的关系图,则n 值与压强p1、p2的关系正确的是( )A.p2>p1,n<3 B.p2>p1,n>3C.p1>p2,n<3 D.p1>p2,n>34.如图所示,a曲线表示一定条件可逆反应X(g)+Y(g)2Z(g)+W(s)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采取的措施是()A.加入催化剂B.增大Y的浓度C.降低温度D.增大体系压强5.对于可逆反应2AB3 (g)A2 (g)+3B2(g) ΔH>0,下列图像正确的是( )6.已知:4NH 3(g)+5O 2(g)4NO(g)+6H 2(g). △H = -1025kJ/mol 该反应是一个可逆反应。
化学平衡的移动图像专题

T2 P2 T1 P2 T1 P1 0
t
强化练习:
4、在密闭容器中进行g)+ 2L,在不同条件下R的百分 含量R%的变化情况如下图,下列叙述正确的是( C )
A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
(3)不论恒温恒容,还是恒温恒压容器,加入稀有气体,平衡皆 发生移动。 (× )
提示:恒温恒容,加入稀有气体平衡不移动。
(4)起始加入原料的物质的量相等,则各种原料的转化率一定 相等。 ( × )
提示:由于转化的物质的量不一定相等,故转化率不一定相等。
(5)通过改变一个条件使某反应向正反应方向移动,转化率一定 增大。 (× )
(B) 平衡时,混合气中G的百分含量
(C) G的转化率
(D) L的转化率
练习题
1、mA(s)+nB(g) qC(g);ΔH<0的可逆反应, 在一定温度下的密闭容器中进行,平衡时B的体积 分数V(B)%与压强(P)关系如下图所示,下列叙述正 确的是( B、C ) A、m+n<q 平衡线
B、n>q
C、X点时的状态,V正>V逆 D、X点比Y点混和物的 正反应速率慢
5.百分含量——压强/温度曲线
例5、可逆反应mA(g)+nB(g) pC(g);△H<0中m、n、 p为系数,且m+n>p。分析下列各图, 在平衡体系中A 的质量分数与温度t℃、压强P,关系正确的是( B )
定 一 议 二
5. 图中表示外界条件(t、p)的变化对下列 反应的影响:L(固)+G(气) 2R(气); △H>0 y 轴表示的是( B ) (A) 平衡时,混合气中R的百分含量
化学平衡图像专题(精选)

【达标检测16】----化学平衡图像问题一、选择题1、下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断(AB )A、正反应是放热反应B、若A、B是气体,则D是液体或固体C、逆反应是放热反应.D、A、B、C、D均为气体2、在密闭容器中充入A、B或G、H进行可逆反应:aA(气)+bB(气)gG(气)+hH (气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是( A )A、开始时充入G和H a+b<g+h Q<0B、开始时充入G和H a+b<g+h Q>0C、开始时充入G和H a+b>g+h Q>0D、开始时充入A和B a+b>g+h Q>03、可逆反应A(气)+2B(气)nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( C )A、P1>P2,n >3B、P1>P2,n <3C、P1<P2,n >3D、P1<P2,n <34、如下图所示a曲线表示一定条件下可逆反应X(g)+Y(g)2Z(g)+W(s)△H <0的反应过程。
若使a曲线变成b曲线,可采取的措施是(AD )A、加入催化剂B、增加Y的浓度C、降低温度D、增大体系压强5、反应A(g)+B(g)C(g)+D(g);△H>0分别在673K和373K时进行,得C 的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是( C )6、在容器相同的五个容器中,分别充入同量的N2和H2,在不同温度下任其反应:N2+3H22NH3,分别在同时刻测得其中NH3的体积百分比,连成如下图所示曲线,不正确的叙述是( C )。
A、放热反应B、E、F二点尚未达到化学平衡状态C、H、I二点尚未达到化学平衡状态D、G、H、I三点已达到化学平衡状态7、反应:L(s)+ a G(g) b R(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。
化学平衡图像题目

化学平衡和速率图像1.速率-时间(v-t )图像方法:A. 首先分清图像的“突变”和“渐变”,出现渐变的为改变浓度。
如下图甲乙甲图中v 正突然变大、v 逆在t1渐变,可见改变的为增加反应物的浓度。
乙图中v 正突然变小、v 逆在t1渐变,可见改变的为减少反应物的浓度。
B.如果图像都为突变,则改变的可能是温度、压强、催化剂等,以及同时改变反应物和生成物的浓度。
这类图像要先看速率,再看平衡。
首先分析速率较之前的大小变化,如果变大,为增大温度、增大压强、加催化剂,再分析此时v 正、v 逆的相对大小,如果v 正>v 逆,表示平衡正向移动,再从上述条件里选择使平衡正向移动的条件。
例1,N 2+ 3H 22NH 3,△H<0建立平衡后加热对速率的影响如图1。
123图1υ图2如图1所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为升温。
如图2所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v 逆,平衡正向移动,上述可以使此反应正向移动的为升压。
如图3所示,t2时刻后,图像突变,速率较之前都变小,为降温降压,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为降温。
图3练习1.下列图像为反应H 2(g)+I 2(g)2HI(g);△H>0 的速率-时间图像,分析下列三个图像改变的条件图1中,t2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v逆,平衡正向移动,上述可以使此反应正向移动的为升温。
图2中,t1时刻后,图像渐变,v逆突然变小,V正渐渐变小,为减少生成物即HI的浓度。
图3中,t0时刻后,图像突变,速率都变大,为升温、升压、加催化剂,又因为v正=v逆,平衡不移动,根据此反应,为升压或者加催化剂。
练习2一密封体系中发生下列反应:N+3H2 2NH3 +Q,下图是某一时间段中反应速率2与反应进程的曲线关系图:回答下列问题:(1)处于平衡状态的时间段是______.(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?、、(3)下列各时间段时,氨的百分含量最高的是______.A.t0~t1B.t2~t3C.t3~t4D.t5~t6【答案】(1)t0~t1、t2~t4、t5~t6(2)升高温度,加了催化剂,降低压强(3)t0~t1练习3一定温度下可逆反应aX(g)+bY(g)cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率()随时间(t)变化如图所示。
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
化学平衡图像题例析 (带答案)

十类化学平衡图像题例析化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。
从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。
解题关键一是读图,弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的“0”点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率大小、升降。
二是识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。
三是用图,联想化学原理解答问题。
1. 以速度-时间(v-t)图像计算平衡浓度例1 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)()A、2-S aobB、1-S aobC、2-S abdoD、1-S bod解析根据v-t曲线计算反应物的平衡浓度,初看题目似乎无从下手,若静心思考,从定义出发,Y减少的浓度△C Y=vt,随着反应进行,逆反应同时生成部分Y,因此Y的平衡浓度为初始浓度与消耗浓度之差。
瞬时速率与时间的乘积即为微小矩形的面积,累积计算则Y 减少的浓度表示为S aobd,Y增加的浓度表示为S obd,则Y的平衡浓度表示为:1-(S aodb-S obd)=1-S aob,故选B。
2. 以v-t图像描述化学平衡移动的本质例2 已知合成氨的反应为:N2+3H22NH3; △H=-92.4KJ/mol,一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是()解析此题易误选D,以为逆反应速率升高了正反应速率必然降低,其实升高温度放热、吸热方向的反应速率都增大,但吸热反应增大的幅度大,因此平衡向吸热反应方向移动,合成氨的正反应为放热反应,应选C。
高考化学专题复习:化学平衡图像专题

高(Gao)考化学专题复习:化学平衡图像专题1.对反(Fan)应2A(g)+2B(g)3C(g)+D(?),下列图象的描述(Shu)正确的是A. 依(Yi)据图①,若(Ruo)t1时升高温度,则ΔH<0B. 依据图①,若t1时增大压强,则D是固体或液体C. 依据图②,P1>P2D. 依据图②,物质D是固体或液体【答案】B2.下列图示与对应的叙述相符的是A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOHD. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大【答案】B3.—定条(Tiao)件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往(Wang) 2L 恒容密(Mi)闭容器中充入 1 mol CO2和(He)3 mol H2,在不同催化剂作(Zuo)用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是A. a 点 v(正)>v(逆)B. b点反应放热53.7 kJC. 催化剂效果最佳的反应是③D. c点时该反应的平衡常数K=4/3(mol-2.L-2)【答案】A4.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A. 正反应是放热反应B. A、B一定都是气体C. D一定不是气体D. C可能是气体【答案】B5.下图是恒温下H2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是A. 升高温(Wen)度B. 增大(Da)压强C. 增大反应(Ying)物浓度D. 加入(Ru)催化剂【答(Da)案】C6.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
知识点21 化学平衡图像习题
1.对达到平衡的可逆反应X+Y W+Z ,增大压强则正、逆反应速率(v )的变化如下图,分析可知X ,Y ,Z ,W
的聚集状态可能是( )
A .Z ,W 为气体,X ,Y 中之一为气体
B .Z ,W 中之一为气体,X ,Y 为非气体
C .X ,Y ,Z 皆为气体,W 为非气体
D .X ,Y 为气体,Z ,W 中之一为气体
2.由某可逆反应测绘出图象如下图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应 3.右图表示外界条件(T, P )的变化对下列反应的影响: L(s)+G(g)
2R(g)(正反应为吸热反
应),则纵座标可以表示的是( ) A .平衡时,混合气体中R 的百分含量 B .平衡时,混合气体中G 的百分含量 C .G 的转化率 D .L 的转化率
4.下图Ⅰ、Ⅱ、Ⅲ分别代表①③、②、④反应,则Y 轴是指( ) ① N 2(g)+3H 2(g) 2NH 3(g);△H=-Q ② H 2(g)+I 2(g) 2HI(g); △H=+Q ③ CO(g)+2H 2(g) CH 3OH(g); △H=-Q
④ 2SO 3(g)
2SO 2(g)+O 2(g); △H=+Q
A .平衡混合气中一种生成物的百分含量
B .平衡混合气中一种反应物的百分含量
C .平衡混合气中一种生成物的转化率
D .平衡混合气中一种反应物的转化率 5.反应mA(固)+nB(气)
eC(气)+fD(气),反应过程中,当其它条件不变时,C 的百分含量(C%)与温度(T )
和压强(P )的关系如下图,下列叙述正确的是( )
A . 达平衡后,加入催化剂,则C%增大
B .达到平衡后,若升温,平衡向左移动
C .化学方程式中n>e+f
D .达到平衡后,增加A 的量有利于平衡向右移动
7.若反应:L (s )+aG (g ) bR (g )达到平衡时,温度和压强对该反应的影响
如右图所示,图中:压强
p 1>p 2,x 轴表示温度,y 轴表示平衡混和气中G 的体积分 Y
P 1
P 2
数。
据此可判断
A.上述反应正反应是放热反应
B.上述反应正反应是吸热反应
C.a >b
D.a <b
8.在一定温度下,容器内某一反应中M 、N 的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A 、反应的化学方程式为:2M=N
B 、t 2时,正逆反应速率相等,达到平衡
C 、t 3时,正反应速率大于逆反应速率
D 、t 1时,N 的浓度是M 浓度的2倍
9.在一定条件下,反应A 2+B 2 2AB ;△H= Q 的反应时间与生成物AB 的质量分数(AB %)的关系如图所示,其中a 为500℃,b 为300℃时的情况(其他条件不变),c 则为在时刻t 3开始缩小容器容积(温度维持300℃)的情况,则Q 的值应为( )
A .Q >0
B .Q <0
C .Q =0
D .无法判断
10.对于达到平衡的反应:2A(g)+B(g) nC(g),符合下图所示的结论是( ) A. P 1>P 2,n >3 B. P 1>P 2,n <3 C. P 1<P 2,n >3 D. P 1<P 2,n <3
11.如下图所示,反应:X (气)+3Y (气)
2Z (气);△H=-Q ,在
不同温度、不同压强
(P 1>P 2)下,达到平衡时,混合气体中Z 的百分含量随温度变化的曲线应为( )
12.反应aA(g)+bB(g) cC(g);△H=Q ,生成物C 的质量分数与压强P 和温度的关系如下图,方程式中的系数和Q
值符合图象的是( )
A .a+b<c Q>0 B.a+b>c Q<0 C.a+b<c Q<0 D.a+b=c Q>0 13.某可逆反应L (s )+G(g) 3R(g); △H>0,下图表示外界条件温度和压强的变化对上述反应的影响。
试判断图
中y 轴可以表示( )
A .平衡混合气中R 的质量分数
B . G 的转化率
C .平衡混合气中G 的质量分数
D . L 的转化率 14.下图表示外界条件(T 、P )的变化对下列反应的影响: L (固)+G (气)
2R (气);△H>0,y 轴表示的是( )
2 4 6 8 t t 2
t 3
N
M 时间/min
物质的量
A .平衡时,混合气中R 的百分含量
B .G 的转化率
C .平衡时,混合气中G 的百分含量
D .L 的转化率 15
.如图,条件一定时,反应
2
(正反应为放热)中NO 的
与T 变化关系
曲线图,图中有a 、b 、c 、d4个点,其中表示未达到平衡状态,且的点
是( )
A. a
B. b
C. c
D. d
16. 下列反应符合下图p-v 变化曲线的是( )
A.
2HI(g) B.
C. 4NO(g)+
D. CO(g)+C(s) 2CO(g)
17.可逆反应2A+B 2C (g )+Q (Q>0)随T (℃)变化气体平均相对分子质量的变化如图所示,则下列叙述
中正确的是( )
A. A 和B 可能都是固体
B. A 和B 一定都是气体
C. A 和B 可能都是气体
D. 若B 为固体,则A 一定为气体 18.在一定温度不同压强(P 1<P 2)下,可逆反应
2X(g) 2Y(g) + Z(g)中,生成物Z 在反应混合物中的体积分数
(ψ)与反应时间(t )的关系有以下图示,正确的是
19.右图曲线a 表示放热反应
X(g) + Y(g)
Z(g) + M(g) + N(s)进行过程中
X 的转化率随时间变化的关系。
若要改变起始条件,使反应过程按b 曲线进行,可采取的措施是
A .升高温度
B .加大X 的投入量
C .加催化剂
D .增大体积
o
a
b
X 的转化率
时间
20.对于反应2X(g)+Y(g)2Z(g)不同温度(T1和T2)及压强(p1和p2)下,
产物Z的物质的量n(Z)和反应时间t的关系如右图
所示,下列判断正确的是
A.T1<T2,p1<p2,正反应为放热反应
B.T1<T2,p1>p2,正反应为吸热反应
C.T1>T2,p1>p2,正反应为放热反应
D.T1>T2,p1<p2,正反应为吸热反应
21.用来表示可逆反应2A(g)+B(g)2C(g)(正反应为放热反应)的正确的图象为
22.在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)2C(g);ΔH<0。
达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
X Y
A 再加入A B的转化率
B 再加入
C A的体积分数
C 增大压强A的转化率
D 升高温度混合气体平均摩尔质量
23.对可逆反应A(g)+nB2C(g),恒温下,其反应物B的转化率
(αB%)与压强(P)的关系如右图,则下列叙述正确的是()
A.B为固体n>1 B.B为液体n>1
C.B为气体n>1 D.B为气体n<1
24.在一化学平衡mA(g)+nB(g)pC(g)+qD(g)中,A的转化率(αA%)与温度(T)的关系如右图所示,分析下图可以得出的正确结论是()
A.正反应是吸热反应,m+n>p+q
B.正反应是吸热反应,m+n<p+q
C.正反应是放热反应,m+n>p+q
D.正反应是放热反应,m+n<p+q
25.在温度相同,压强分别为P1、P2条件下,A(g)+2B(g)nC(g)的反应体系中,C的
体积分数(C%)随时间(t)变化的曲线如图所示。
下列结论中正确的是
()
A.P1>P2,n<3 B.P1<P2,n>3
C.P1<P2,n=3 D.P1>P2,n>3
答案:1 CD 2 AC 3 B 4 AD 5.BC 6.A 7.B D 8.D 9.B 10.C 11.C 12.C 13 C 14.C 15 D 16 B 17 CD 18 B 19 C 20 C 21 AC 22AC 23 C 24A 25 D。
