DB22T396.8-2017保健用品毒理学评价程序与检验方法第8部分:小鼠精子畸形试验
保健食品安全性毒理学检验及评价

1. 受保护的野生动物。 2. 禁止使用自然的、人工驯养繁殖或人工栽培的国家 一级和自然的二级保护野生动植物及其产品。 3. 人工驯养繁殖或人工栽培的国家二级保护野生动植 物及其产品,国家保护的有益的或者有重要经济、 科学研究价值的陆生野生动物及其产品应提供省级 以上农业(渔业)、林业行政主管部门的批准文件。
1. 生产用菌种应满足一定的条件。 2. 生产企业应具备的一定条件。
3. 菌种及生产工艺不得变更,否则产品必须重新申报。
4. 不提倡以液态形式生产活菌产品。 5. 在保存期内活菌数目不得少于 106cfu/mL(g) 。
益生菌类
益生菌类保健食品的部分规定:
6. 如需在特殊条件下保存,应在标签和说明书中标示 7. 所用菌种在其发酵过程中,除培养基外,不得加入 具有功效成分的动植物及其物质
常用的介质有:蒸馏水、食用植物油、淀粉、明胶及羧甲基 纤维素等。
2.液体类
受试物浓缩倍数应符合试验要求。 浓缩方法不应破坏其有效成份,常用的有60℃~70℃减压或 常压蒸发、冷冻干燥。 按工艺要求。
样品的预处理原则
3.袋泡茶类
处理方法与产品推荐饮用方法相同
推荐用:80℃--90℃ 常压用水浸泡30min
新资源作为原料时必须具备的有关资料:
1. 名称及国内外研究利用情况; 2. 名称、配方及生产工艺; 3. 产品成分(包括营养物质、有生物效应物质及有毒 有害物质等)的分析报告;
4. 安全性毒理学评价报告或有关文献资料;
5. 个别地区有食用习惯的应提供பைடு நூலகம்关食用历史的证明 资料; 6. 质量标准。
野生动植物及其产品类
将功能学、毒理学、功效成分及卫生指标检验评价方法三者合一
保健用品功能学评价程序和检验方法——评价程序

保健用品功能学评价程序和检验方法 第1部分:评价程序警示——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本标准规定了保健用品功能学评价程序和检验方法。
本标准适用于保健用品功能学检验。
2 评价程序2.1 基本要求2.1.1 对受试样品的要求2.1.1.1 应提供受试样品的原料组成或/和尽可能提供受试样品的物理、化学性质(包括化学结构、纯度、稳定性等)有关资料。
2.1.1.2 受试样品必须是规格化的定型产品,即符合既定的配方、生产工艺及产品质量标准。
2.1.1.3 功能学评价的样品与毒理学评价、卫生学检验的样品应为同一批次(安全性毒理学评价和功能学评价试验周期超过受试样品保质期的除外)。
2.1.1.4 受试样品必须是直接或间接作用与人体皮肤表面,并列入本省保健用品类别目录的外用产品。
2.1.2 对试验动物的要求2.1.2.1 根据各种试验的具体要求,合理选择试验动物。
常用大鼠和小鼠,品系不限,推荐使用近交系动物。
2.1.2.2 动物的性别、年龄依试验需要进行选择。
动物的数量要求为小鼠每组10只~12只(单一性别),大鼠每组8只~12只(单一性别)。
2.1.2.3 动物应达到SPF级试验动物的要求。
2.1.3 对受试样品剂量及时间的要求2.1.3.1 各种动物试验至少应设对照组、试验组,必要时可设阳性对照组。
受试样品的功能试验剂量必须在毒理学评价确定的安全剂量范围之内。
2.1.3.2 给受试样品的时间应根据委托方提供的使用说明书而定。
2.1.4 对受试样品处理的要求以推荐方式进行前处理。
2.1.5 对受试样品使用方式的要求参照厂家推荐的使用方式。
2.1.6 对合理设置对照组的要求以载体和功效成分(或原料)组成的受试样品,当载体本身可能具有相同功能时,应将该载体作为对照。
2.2 人体试用试验规程2.2.1 试验前的准备2.2.1.1 原则上人体试用试验应在动物功能学试验有效的前提下进行。
保健食品毒理学评价程序

保健食品及其原料毒理学评价程序本程序适用于保健食品及其原料的毒理学安全性评价。
1术语1.1保健食品是指声称保健功能,不得对人体产生急性、亚急性或者慢性危害的特别食品。
包括属于补充维生素、矿物质等养分物质的养分素补充剂,以及声称保健功能的产品。
1.2保健食品原料形成保健食品成效成分和配方的初始物料。
2受试物2.1受试物可以是保健食品或保健食品原料。
2.2资料性要求2.2.1应供给受试物的名称、性状、规格、批号、生产日期、保质期、保存条件、申请单位名称、生产企业名称、配方、生产工艺、质量标准、保健功能以及推举摄入量等信息。
2.2.2受试物为保健食品原料时应供给动物和植物类原料的产地和食用部位、微生物类原料的分类学地位和生物学特征、食用条件和方式、食用历史、食用人群等根本信息,以及其他有助于安全性评估的资料。
2.2.3原料为从动物、植物、微生物中分别的成分时,还需供给当成分的理化特性和化学构造等资料。
2.2.4供给受试物的主要成分、成效成分/标志性成分及可能的有害成分的分析报告。
2.3受试物的特别要求2.3.1保健食品应供给包装完整的定型产品。
毒理学试验所用样品批号应与功能学试验所用样品批号全都,并且为卫生学试验所用三批样品之一〔益生菌、奶制品等产品保质期短于整个试验周期的产品除外〕。
依据技术审评意见要求补做试验的,假设原批号样品已过保质期,可使用批号的样品试验,但应供给批号样品按产品技术要求检验的全工程检验报告。
2.3.2由于推举量较大等缘由不适合直接以定型产品进展试验时,可以对送检样品适当处理,如浓缩、局部去除辅料或安全的食品成分等。
应供给受试样品处理过程的说明和相应的证明文件,处理过程应与原保健食品的主要生产工艺步骤保持全都。
3.毒理学试验的主要工程依据 GB15193 开展以下试验。
3.1急性经口毒性试验3.2遗传毒性试验:细菌回复突变试验,体内哺乳动物红细胞微核试验,哺乳动物骨髓细胞染色体畸变试验,小鼠精原细胞或精母细胞染色体畸变试验,体外哺乳类细胞 HGPRT 基因突变试验,体外哺乳类细胞 TK 基因突变试验,体外哺乳类细胞染色体畸变试验、啮齿类动物显性致死试验,体外哺乳类细胞 DNA 损伤修复〔非程序性 DNA 合成〕试验,果蝇伴性隐性致死试验。
保健用品毒理学评价程序与检验方法——致畸试验

DB22/T 396.10—2017 保健用品毒理学评价程序与检验方法 第10部分:致畸试验警示——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本标准规定了保健用品毒理学致畸试验评价程序。
本标准适用于保健用品毒理学致畸试验检验方法。
2 致畸试验方法2.1 试剂及其配制(实验用水为纯水)2.1.1 甲醛、冰乙酸、2,4,6-三硝基酚、氢氧化钾、甘油、水合氯醛、茜素红;2.1.2 茜素红贮备液:茜素红-S,50 %乙酸饱和液5.0 mL,甘油10.0 mL,1%水合氯醛溶液60.0 mL 混合,放入棕色瓶中;2.1.3 茜素红应用液:取贮备液3 mL~5 mL,用1 g/100 mL~2g/100 mL氢氧化钾液稀释至l000 mL,存于棕色瓶中;2.1.4 透明液A:甘油200 mL、氢氧化钾10 g、蒸馏水790 mL混合;2.1.5 透明液B:甘油与蒸馏水等量混合;2.1.6 固定液:Bouins液:2,4,6-三硝基酚75份、甲醛20份、冰乙酸5份。
2.2 仪器与设备2.2.1 分析天平:精确度为0.1 g;2.2.2 生物显微镜;2.2.3 体视显微镜;2.2.4 游标卡尺(百分尺)。
2.3 实验动物常用试验动物为大鼠、小鼠和家兔。
传统致畸应选用健康性成熟(90 d~100 d)雌、雄大鼠,雌性应为未交配过的大鼠80 只~90 只。
雄鼠减半。
2.4 剂量分组至少设四个组,一个空白对照组,3个试验组。
剂量原则上可采用1/4、1/16、l/64 LD50,或以长期毒性试验的最大无作用剂量为高剂量组,其1/30左右为低剂量组,在其间设一组。
对某种新的动物,初次试验可设一阳性对照组。
每组至少12 只孕鼠。
常用阳性对照物有敌枯双(0.5 mg/kg~1.0 mg/kg体重)、五氯酚钠阿斯匹林(30 mg/kg体重)及维生素A 25000 IU~40000 IU等。
保健用品毒理学评价程序与检验方法——皮肤刺激性试验

保健用品毒理学评价程序和检验方法 第4部分:皮肤刺激性试验警示——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本标准规定了保健用品毒理学皮肤刺激性试验评价程序。
本标准适用于保健用品毒理学皮肤刺激性试验检验方法。
2 皮肤刺激性试验检验方法2.1 材料2.1.1 动物多种哺乳动物均可被选为实验动物,首选白色家兔。
应使用成年、健康、皮肤无损伤的动物,雌性和雄性均可,但雌性动物应是未孕和未曾产仔的。
实验动物至少要用4只。
实验动物应单笼饲养,试验前动物要在实验动物房环境中至少适应3d时间。
实验动物及实验动物房应符合国家相应规定。
选用常规饲料,饮水不限制。
2.1.2 受试物液态受试物一般不需稀释,可直接使用原液,膏状受试物,可直接使用原膏霜。
若受试物为固体,应将其研磨成细粉状,并用水或其它无刺激性溶剂充分湿润,以保证受试物与皮肤有良好的接触。
使用其它溶剂,应考虑到该溶剂对受试动物皮肤刺激性的影响。
受试物为强酸或强碱(pH值≤2或≥11.5),可以不再进行皮肤刺激试验。
此外,若已知受试物有很强的经皮吸收毒性,经皮LD 50小于200 mg/kg BW或在急性经皮毒性试验中受试物剂量为5000 mg/kg BW 仍未出现皮肤刺激作用也无需进行急性皮肤刺激性试验,LD 50计算见附录B。
2.1.3 仪器2.1.3.1 体重秤,精确到0.1 Kg;2.1.3.2 放大镜。
2.2 试验方法2.2.1 皮肤急性刺激试验(一次皮肤涂抹试验)皮肤急性刺激试验步骤:a)试验前约24 h,将实验动物背部脊柱两侧毛剪掉,不可损伤表皮,去毛范围左、右各约3 cm×3 cm;b)取受试物约0.5 mL(g)直接涂在皮肤上,然后用二层纱布(2.5 cm×2.5 cm)和一层硫酸纸或类似物覆盖,再用无刺激性胶布和绷带加以固定。
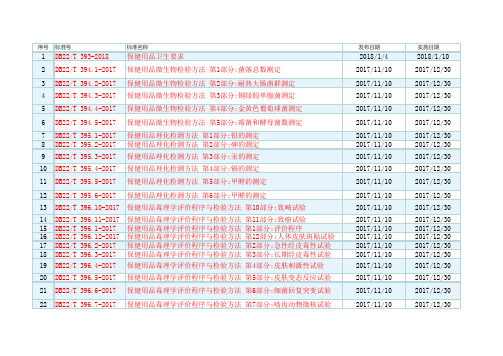
吉林省保健用品地方标准清单
保健用品功能学评价程序和检验方法 第4部分:辅助改善睡眠功能检 验方法 保健用品功能学评价程序和检验方法 第5部分:辅助减肥功能检验方 法
保健用品功能学评价程序和检验方法 第6部分:除臭功能检验方法
33 DB22/T 397.7-2017 34 DB22/T 397.8-2017 35 DB22/T 397.9-2017
2017/11/10
2017/11/10 2017/11/10 2017/11/10 2017/11/10 2017/11/10 2017/11/10
2017/12/30 2017/12/30 2017/12/30 2017/12/30 2017/12/30 2017/12/30
2017/12/30
序号 标准号
1 DB22/T 393-2018
标准名称
保健用品卫生要求
2 DB22/T 394.1-2017 保健用品微生物检验方法 第1部分:菌落总数测定
3 DB22/T 394.2-2017 保健用品微生物检验方法 第2部分:耐热大肠菌群测定
4 DB22/T 394.3-2017 保健用品微生物检验方法 第3部分:铜绿假单胞菌测定
保健用品功能学评价程序和检验方法 第10部分:辅助缓解体力疲劳 功能检验方法
26
DB22/T 397.11-2017
保健用品功能学评价程序和检验方法 第11部分:改善鼻部症状功能 检验方法
27 DB22/T 397.1-2017 保健用品功能学评价程序和检验方法 第1部分:评价程序
28 DB22/T 397.2-2017
2017/12/30
2017/12/30
23 DB22/T 396.8-2017 保健用品毒理学评价程序与检验方法 第8部分:小鼠精子畸形试验
保健食品毒理学安全性评价

• 申报保健食品中涉及真菌、益生菌等物品(或原 料)的,按照我部印发的《卫生部关于印发真菌 类和益生菌类保健食品评审规定的通知》(卫法 监发[2001]84号)执行。
附件1 既是食品又是药品的物品名单
丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、 马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉 竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉 (桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、 佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、 赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸 枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥 草、姜(生姜、干姜)、枳子、枸杞子、栀子、砂仁、 胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑椹、桔 红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、 淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、 紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公 英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、 橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。 87
└────┘
└───┘
功能
长期毒性
急期毒性
毒作用剂量—反应关系
100┫%
┫
**
┫
○
┫
┫
50
┫ ┫
┫
*
┫
○
┫○
┗┳┳┳┳┳┳┳┳┳┳┳┳┳┳┳
15 30
60
NOAEL LOAEL
阈
mg/kg
描述毒理学试验的基本原则
○化学物在实验动物产生的作用,可以外 推于人。
○实验动物必须暴露于高剂量,这是发现 对人潜在危害的必需的和可靠的方法。
保健食品原料
保健用品毒理学评价程序与检验方法——细菌回复突变试验

DB22/T 396.6—2017 保健用品毒理学评价程序与检验方法 第6部分:细菌回复突变试验警示——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本标准规定了保健用品毒理学细菌回复突变试验评价程序。
本标准适用于保健用品毒理学细菌回复突变试验检验方法。
2 鼠伤寒沙门氏菌/回复突变试验(Ames试验)2.1 菌株常用组氨酸缺陷型鼠伤寒沙门氏菌(Samomlla typhimurium)TA98、TA100、TA97和TA102,经检定符合要求,-80 ℃或液氮冻存备用。
2.2 仪器和设备2.2.1 培养箱。
2.2.2 恒温水浴。
2.2.3 压力蒸汽消毒器。
2.2.4 干烤箱。
2.2.5 低温冰箱(-80℃)或液态生物容器、普通冰箱。
2.2.6 天平(精确度0.1g或0.0001g)。
2.2.7 菌落计数仪。
2.2.8 低温高速离心机。
2.2.9 玻璃器皿等。
2.3 培养基与试剂2.3.1 营养肉汤培养基牛肉膏 5.0g胰胨(或混合蛋白胨) 5.0g氯化钠 2.5g磷酸氢二钾(K2HPO4·3H2O) 1.3g蒸馏水 500ml加热溶解,调节pH至7.4,分装后0.103 MPa20min灭菌,普通冰箱保存备用,保存期不超过半年。
2.3.2 营养肉汤琼脂培养基1DB22/T 396.6—20172 用作a.基因型鉴定的结晶紫敏感试验,抗氨苄青霉素和四环素试验,紫外线敏感性试验。
b.细菌活力鉴定。
琼脂粉 1.5g营养肉汤培养基 100ml加热融化后调pH至7.4,0.103 MPa20min灭菌。
2.3.3 底层培养基所需试剂及配置方法2.3.3.1 磷酸盐储备液磷酸氢钠铵(NaNH4HPO4·4H2O) 17.5g柠檬酸(C6H8O7·H2O) 10.0g磷酸氢二钾(K2HPO4 ) 50.0g硫酸镁 (MgSO4·7H2O) 1.0g加蒸馏水至100 ml,0.103MPa20min灭菌。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.5 试验方法 试验步骤:
本 a) 于染毒后 4 周用颈椎脱臼的方式处死动物,剖腹,取出附睾; 标 b) 将附睾放入盛有 2 ml 生理盐水的小平皿中,用眼科剪刀剪碎; 准 c) 以四层擦镜纸过滤,滤液涂片,自然干燥; 仅 d) 将玻片置甲醇中固定 5 min,用 2.5 %伊红染色 1 h,封片。 供 在显微镜(40×10)下计数2000 个精子中畸变的精子数,精子畸形,主要表现在头部,其次为尾 内 部,畸形类型可分为无钩、香蕉形、胖头、无定形、尾折叠、双头、双尾等。异常精子均应记录显微镜 部 的坐标数,以备查询。以便统计精子畸形率及精子畸形类型的构成比。判断双头,双尾畸形时,要注意 使用 与二条精子的部分重叠相鉴别,判断无定形时要与人为剪碎及折叠相鉴别。
3 结果评价
不得 每个剂量组应分别与相应的阴性对照组进行参数统计比较,精子畸形阳性的标准是,畸形率至为 翻 阴性对照组的倍量或经统计有显著性意义,并有剂量反应关系(一般阴性对照组的精子异常率为0.8%~ 印 3.4%)。
2.2.2.5 磷酸盐缓冲液(pH 7.4)
磷酸氢二钠溶液(1/15 mol/L):磷酸氢二钠(Na2HPO4 ,分析纯)9.47 g溶于 1000 ml 蒸馏水中。
1
DB22/T 396.8—2017 磷酸氢二钾溶液(1/15 mol/L):磷酸氢二钾溶液(KH2PO4 , 分析纯)9.07 g溶于 1000 ml 蒸馏水中。 取磷酸二氢钠 (1/15 mol/L):80 ml与磷酸氢二钾溶液(1/15 mol/L)20 ml 混合,调pH至7.4。
本 2.2.2.6 Giemsa 染液 标 称取Giemsa 染液3.8 g,加入375 ml甲醇(分析纯)研磨,待完全溶解后再加入125 ml甘油。置于37
准 ℃恒温箱保温48 h振摇数次。过滤两周后用。 仅 2.2.2.7 Giemsa 应用液
供内 取一份 Giemsa 染液与 9 份 磷酸盐缓冲液混合而成,现用现配。 部 2.3 剂量选择和动物分组
标准仅供内部使用 Part 8: Sperm abnormality test in mice 不得翻印
2017 - 11 - 10 发布 吉林省质量技术监督局
2017 - 12 - 30 实施 发布
本标准仅供内部使用 不得翻印
本标准仅供内部使用 不得翻印
DB22/T 396.8—2017
本 前言 标准仅 DB22/T 396《保健用品毒理学评价程序与检验方法》拟分为如下部分: 供 ——第 1 部分:评价程序; 内 ——第 2 部分:急性经皮毒性试验; 部 ——第 3 部分:长期经皮毒性试验; 使 ——第 4 部分:皮肤刺激性试验; 用 ——第 5 部分:皮肤变态反应试验;
ICS 11.020 C 05 备案号:58327-2018
DB22
吉林省地方标准
本标 DB 22/T 396.8—2017 准仅供内部使用 代替 DB22/T 396-2014
保健第用8品部毒分理:学小评鼠价精程子序畸与不形检得试验翻验方印法 本 Toxicological evaluation procedures and test methods for health care products
本部分起草单位:吉林省疾病预防控制中心。
不 本部分主要起草人:张晶莹、孙兰、孟令仪、宋昕恬、吴晓刚、隋自洁、高峰。
本部分所代替标准的历次版本发布情况为:
得 ——DB22/T 396-2004; 翻印 ——DB22/T 396-2014。
I
本标准仅供内部使用 不得翻印
本标准仅供内部使用 不得翻印
DB22/T 396.8—2017
——第 6 部分:细菌回复突变试验; ——第 7 部分:啮齿动物微核试验; ——第 8 部分:小鼠精子畸形试验; ——第 9 部分:哺乳动物培养细胞染色体畸变试验; ——第 10 部分:致畸试验; ——第 11 部分:致癌试验;
不得翻印
——第 12 部分:人体皮肤斑贴试验。 本部分为DB22/T 396-2017的第8部分。
使用 设1/2、1/5、1/10、和1/20 LD50剂量组以及阳性对照组和阴性对照组。阳性对照组腹腔注射环磷酰
胺,剂量为40 mg/kg体重。阴性对照组为溶剂对照。
不 2.4 染毒方式 得 经皮给予受试物,连续5 d,每天一次。动物处死前3 h~5 h腹腔注射秋水仙素4 mg/kg~6 mg/kg 体
部使用 2.2.2 试剂
2.2.2.1 0.1 %秋水仙素
置于棕色瓶中,冰箱保存。
2.2.2.2 60 %冰乙酸
取60 ml冰乙酸(分析纯),加蒸馏水至100 ml。
不得翻印
2.2.2.3 1 %柠檬酸三钠
取1 g柠檬酸三钠(分析纯),加蒸馏水至100 ml。
2.2.2.4 固定液
甲醇:冰乙酸=3:1,现用现配。
2 精子畸形试验 2.1 实验动物
不得翻印
健康成年雄性小鼠,周龄为7 周~12 周,体重25 g~35 g,一般每组至少5 只。试验前在实验动
物房至少适应3 天~5 天。
本 2.2 仪器和试剂
标 2.2.1 仪器
准 2.2.1.1 仅 2.2.1.2 供 2.2.1.3 内 2.2.1.4
解剖器械。 电子天平。 离心机。 冰箱。
本 本部分按照GB/T 1.1—2009给出的规则起草。 标 本部分代替DB22/T 396-2014《保健用品毒理学评价程序与检验方法》,与DB22/T 396-2014相比, 准 结构做了较大调整。除编辑性修改外,主要技术变化如下: 仅 ——增加了警示; 供 ——增加了范围; 内 ——修改了实验动物; 部 ——增加了仪器和试剂; 使 ——修改了染毒方式; 用 本部分由吉林省卫生与计划生育委员会提出并归口。
本 保健用品毒理学评价程序与检验方法 第 8 部分:小鼠精子畸形试验 标准 警示——使用本标准的人员应有正规实验室工作的实践经验。本标准并未指出所有可能得安全问
仅 题。使用者有责任采取适当的安全和健康措施。并保证符合国家有关法规规定的条件。 供内 1 范围
部使 本标准规定了保健用品毒理学精子畸形评价方法。 用 本标准适用于保健用品毒理学精子畸形检验方法。
