乙烯物理化学性质归纳
乙烯性质知识点总结归纳

乙烯性质知识点总结归纳1. 物理性质乙烯是一种无色、有刺激性气味的气体。
在常温和常压下,乙烯是一种无色无臭的气体。
它的沸点为-103.7摄氏度,密度为0.91克/升。
由于乙烯是一种不稳定的气体,通常以液态的形式存储和运输,以减少安全风险。
2. 化学性质乙烯是一种高度活泼的化合物,它具有许多特殊的化学性质。
首先,乙烯对氧气具有很高的亲和力,容易发生氧化反应,导致氧化性质比较强。
其次,乙烯还可以和卤素发生加成反应,例如和氯气发生加成反应得到1,2-二氯乙烷。
此外,乙烯可以和水发生加成反应,生成乙醇。
最后,乙烯还可以和许多有机物发生加成反应,生成不同种类的有机化合物。
3. 燃烧性质乙烯是一种易燃的气体,在空气中可以燃烧产生火焰。
乙烯的燃烧反应为:C2H4 + 3O2 → 2CO2 + 2H2O在氧气充足的条件下,乙烯燃烧会产生大量的热能和光能,释放出明亮的火焰。
这使得乙烯成为一种重要的燃料和燃烧剂,在工业生产和日常生活中都有广泛的应用。
4. 溶解性质乙烯在水中的溶解度相对较低,但可以在一定程度上溶解。
乙烯还可以溶解在一些有机溶剂中,例如乙醇、丙酮等。
此外,乙烯还可以在液态氨中溶解,形成乙烯-氨复合物。
这些溶解性质对于乙烯的分离和提纯具有一定的意义。
5. 催化性质乙烯具有很强的催化性质,它可以用作许多重要的工业催化剂。
例如,乙烯可以作为裂化反应的催化剂,将较重的烃类化合物裂解成较轻的烃类化合物。
此外,乙烯还可以用作合成乙烯醇、聚乙烯等重要化学产品的催化剂。
6. 光敏性质乙烯在紫外线的作用下会产生自聚合分解反应,生成聚乙烯。
这种光敏性质使得乙烯成为一种重要的聚合物原料,在塑料工业、合成橡胶工业中有着广泛的应用。
7. 生物活性乙烯在植物生长中起着重要的生理作用。
乙烯可以促进植物的果实成熟和脱落,调节植物的生长和发育过程。
此外,乙烯还可以作为一种植物激素,参与植物的生长和代谢过程。
因此,乙烯在农业生产中有着重要的应用价值。
乙烯知识点总结文库

乙烯知识点总结文库1. 物理性质乙烯是一种无色、无味、可燃的气体,在常温下呈现为无色、无味的气体,但可以在软泥煤、天然气、石油等矿物燃料中找到。
乙烯的比重为0.552g/cm3,沸点为-103.6℃,在常温下为无色无味的气体。
2. 化学性质乙烯是一种不稳定的化合物,可以和氧气、溴、氯等元素发生剧烈的化学反应。
乙烯可以和氯气作用生成氯乙烷,和溴作用生成1,2-二溴乙烷,和氢卤酸发生反应生成卤代乙烷等。
此外,乙烯还可以和羰基化合物发生羰基化反应,生成乙烯基醛、醇和酸。
3. 生产方法乙烯的生产方法主要包括烷烃裂解、醇脱水、乙烷氧化和原生材料合成等几种方法。
烷烃裂解是通过加热石油烃类化合物,使其分解为乙烯和其他烃类物质。
醇脱水是通过将醇类化合物和酸性或碱性催化剂一起加热,使其分解为乙烯和水。
乙烷氧化是将乙烷和氧气在铋钒酸盐催化剂的作用下,产生一氧化碳和二氧化碳并生成乙烯。
原生材料合成是通过木材、秸秆等生物质性原料提取乙醇,再通过脱水反应制得乙烯。
4. 应用领域乙烯是一种重要的工业原料,广泛用于合成塑料、橡胶、溶剂和化肥等化工产品。
乙烯可以被用来制造聚乙烯、聚氯乙烯、聚苯乙烯、聚丙烯、聚碳酸酯等各种合成树脂和塑料。
另外,乙烯还可以用于制造橡胶、制造合成纤维、制造皂化物质等。
在化工工业中,乙烯还可以被用作溶剂、去除,干燥、发泡等劬利剂。
此外,乙烯还可以用于制造氯化乙烯、醋酸乙烯、烯烃类石油树脂、乙烯醛、酒精类食品添加剂等。
另外,作为一种无毒、无害的气体,乙烯还可以被用于制造乙烯化植物生长调节剂、消毒剂等。
乙烯物理化学性质归纳

甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。
高中化学乙烯教案doc

高中化学乙烯教案doc教学内容:乙烯一、教学目标:1. 了解乙烯的基本性质和结构;2. 掌握乙烯的物理性质和化学性质;3. 理解乙烯在工业生产和日常生活中的应用。
二、教学重点和难点:1. 乙烯的结构和性质;2. 乙烯的工业生产和应用。
三、教学方法:1. 讲授结合实验;2. 案例分析;3. 课堂讨论。
四、教学内容:1. 乙烯的基本性质和结构:乙烯是一种无色、有毒气体,具有刺激性气味。
它的化学式为C2H4,结构式为CH2=CH2。
乙烯的键长度较短,键能较高,稳定性较弱。
2. 乙烯的物理性质:乙烯是一种无色、有毒气体,易燃。
其密度小于空气,可以溶解在水中。
乙烯具有特殊的刺激性气味。
3. 乙烯的化学性质:乙烯是一种具有不饱和双键的烃类化合物,在化学反应中常表现出特殊的活性。
乙烯可以发生加成反应、氧化反应、卤素加成反应等。
4. 乙烯在工业生产和日常生活中的应用:乙烯是一种重要的工业原料,用于生产乙烯聚合物、合成橡胶、合成衬里等。
此外,乙烯还可用于制备醋酸乙烯酯、氯丙烯等有机化合物。
五、教学过程:1. 讲授乙烯的基本性质和结构;2. 实验演示乙烯的物理性质;3. 分析乙烯的化学性质;4. 讨论乙烯的工业生产和应用;5. 案例分析乙烯在日常生活中的应用。
六、教学总结:通过本节课的学习,学生将了解乙烯的基本性质和结构,掌握乙烯的物理性质和化学性质,理解乙烯在工业生产和日常生活中的应用。
同时,通过案例分析和课堂讨论,提高学生的探究能力和实践能力,培养学生的综合能力和创新思维。
不饱和烃(不饱和烃乙烯与塑料)高一化学精品讲义(沪科版2020)(教师版)

7.2.2 不饱和烃-不饱和烃、乙烯与塑料学习聚焦知识精讲知识点01 乙烯乙烯1.物理性质乙烯为无色易燃气体,熔点-169℃,沸点℃,几乎不溶于水,难溶于乙醇,是石油化工最重要的基础原料。
2.乙烯的结构乙烯的分子式为C2H4,电子式为,结构式为,结构简式为CH2=CH2,球棍模型为,比例模型为,空间构型为平面形,即乙烯分子中6个原子在同一平面内,键角(键与键之间的夹角)为120°。
3.乙烯的化学性质 (1)氧化反应 ①可燃性乙烯在空气中的燃烧现象为火焰明亮并伴有黑烟。
反应的化学方程式为:CH 2=CH 2+3O 2−−−→点燃2CO 2+2H 2O 。
②与氧化剂反应 操作如右图。
现象:酸性KMnO 4溶液的紫色褪去。
结论:C 2H 4能被氧化剂KMnO 4氧化,使酸性KMnO 4溶液褪色。
(2)加成反应①概念:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应。
②乙烯的加成反应a .常温下使溴水褪色,反应的化学方程式为: CH 2=CH 2+Br 2→CH 2Br —CH 2Br ;b .与H 2加成制乙烷,反应的化学方程式为:CH 2=CH 2+H 2∆−−−→催化剂CH 3—CH 3; 乙烯水化法制乙醇,反应的化学方程式为: CH 2=CH 2+H 2O −−−−−→催化剂加热、加压CH 3CH 2OH ; 与HCl 加成制氯乙烷,反应的化学方程式为:CH 2=CH 2+HCl −−−→催化剂CH 3CH 2Cl 。
(3)聚合反应①聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应,叫聚合反应。
②加聚反应:在聚合反应中,由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物的分子,这样的聚合反应同时也是加成反应,所以这种聚合反应又叫加成聚合反应,简称加聚反应。
③乙烯的加聚反应化学方程式为:nCH 2=CH 2−−−→催化剂[CH 2—CH 2]n ,产物均称为聚乙烯。
人教版高一化学必修一知识点归纳

人教版高一化学必修一知识点归纳1.人教版高一化学必修一知识点归纳篇一乙烯C2H41、乙烯的制法:工业制法:石油的裂解气(乙烯的产量是一个国家石油化工发展水平的标志之一)2、物理性质:无色、稍有气味的气体,比空气略轻,难溶于水3、结构:不饱和烃,分子中含碳碳双键,6个原子共平面,键角为120°4、化学性质:(1)氧化反应:C2H4+3O2= 2CO2+2H2O(火焰明亮并伴有黑烟)可以使酸性KMnO4溶液褪色,说明乙烯能被KMnO4氧化,化学性质比烷烃活泼。
(2)加成反应:乙烯可以使溴水褪色,利用此反应除乙烯CH2=CH2+Br2→CH2BrCH2Br乙烯也能与氢气、氯化氢、水等反应。
CH2=CH2+ H2→CH3CH3CH2=CH2+HCl→CH3CH2Cl(一氯乙烷)CH2=CH2+H2O→CH3CH2OH(乙醇)2.人教版高一化学必修一知识点归纳篇二甲烷CH4烃—碳氢化合物:仅有碳和氢两种元素组成(甲烷是分子组成最简单的烃)1、物理性质:无色、无味的气体,极难溶于水,密度小于空气,俗名:沼气、坑气2、分子结构:CH4:以碳原子为中心,四个氢原子为顶点的正四面体(键角:109度28分)3、化学性质:①氧化反应:CH4+2O2→(点燃)CO2+2H2O(产物气体如何检验?)甲烷与KMnO4不发生反应,所以不能使紫色KMnO4溶液褪色②取代反应:CH4+Cl2→(光照)→CH3Cl(g)+HClCH3Cl+Cl2→(光照)→CH2Cl2(l)+HClCH2Cl+Cl2→(光照)→CHCl3(l)+HClCHCl3+Cl2→(光照)→CCl4(l)+HCl(三氯甲烷又叫氯仿,四氯甲烷又叫四氯化碳,二氯甲烷只有一种结构,说明甲烷是正四面体结构)4、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质(所有的烷烃都是同系物)5、同分异构体:化合物具有相同的分子式,但具有不同结构式(结构不同导致性质不同)烷烃的溶沸点比较:碳原子数不同时,碳原子数越多,溶沸点越高;碳原子数相同时,支链数越多熔沸点越低同分异构体书写:会写丁烷和戊烷的同分异构体3.人教版高一化学必修一知识点归纳篇三1.区分元素、同位素、原子、分子、离子、原子团、取代基的概念。
乙烯的结构与性质

燃料添加剂:乙烯 也可用作燃料添加 剂,以提高燃料的 燃烧性能和减少污
染排放
其他用途:除了上 述用途外,乙烯还 可用于合成树脂、 纤维、涂料等材料, 以及作为工业气体 用于金属加工等领
域
PART 5
总结
乙烯是一种重要的有机化合 物,具有独特的结构和性质, 因此在多个领域具有广泛的 应用价值
x
以下是一些乙烯的主要用途
化工原料:乙烯是 一种重要的化工原 料,可用于合成各 种有机化合物,如 聚乙烯、乙丙橡胶、
环氧乙烷等
农业化学品:乙烯在 农业上可用于促进果 实成熟和开花,以及 作为植物生长调节剂。 此外,乙烯还可用于 制造农药和除草剂等
农业化学品
医药原料:乙烯及 其衍生物在医药领 域也有广泛应用, 如用于合成抗生素、 避孕药、镇痛药等
02
在生产过程中,乙烯需要通过一系列的分离和提纯步骤,以
去除杂质并获得高纯度的产品。常用的分离和提纯方法包括
压缩、冷凝、精馏和吸附等
PART 7
乙烯的储存和运输
1
由于乙烯易燃、易爆、有 毒,因此需要采取特殊的
储存和运输措施
2
在储存方面,乙烯通常储 存在金属罐或球罐中,并 需要保持低温、干燥、通
风良好
例如,采用先进的清洁生产技术和设备,减少废气和废水的排放;对固体废弃物进行回收 再利用,提高资源利用率;加强企业的环保管理和监管,确保废弃物得到妥善处理
此外,为了满足消费者对环保产品的需求,乙烯的下游产品也需要向环保、低碳、节能等方向 发展。例如,开发高强度、高韧性的聚乙烯材料,减少对环境的污染;开发环保型涂料、粘合 剂等化工产品,减少对人体的危害
3
在运输方面,乙烯需要使 用专用的管道或车辆进行 运输,并需要严格控制温
高中化学必修2之知识讲解_乙烯(基础)-
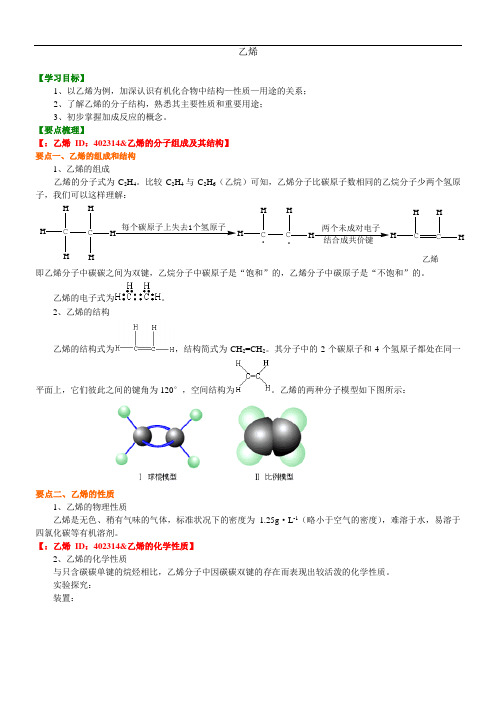
乙烯【学习目标】1、以乙烯为例,加深认识有机化合物中结构—性质—用途的关系;2、了解乙烯的分子结构,熟悉其主要性质和重要用途;3、初步掌握加成反应的概念。
【要点梳理】【:乙烯ID:402314&乙烯的分子组成及其结构】要点一、乙烯的组成和结构1、乙烯的组成乙烯的分子式为C2H4。
比较C 2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:C HHH C HHH每个碳原子上失去1个氢原子CHHC HH.两个未成对电子结合成共价键CHHC HH乙烯.即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构乙烯的结构式为,结构简式为CH2=CH2。
其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
乙烯的两种分子模型如下图所示:要点二、乙烯的性质1、乙烯的物理性质乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
【:乙烯ID:402314&乙烯的化学性质】2、乙烯的化学性质与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:装置:实验步骤与现象:实验步骤实验现象将气体通入酸性高锰酸钾溶液中溶液褪色将气体通入溴的四氯化碳溶液中溶液褪色用排水法收集气体验纯后,点燃火焰明亮,伴有黑烟结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
要点诠释:a.碎瓷片起催化作用。
b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲醇
1、物理性质
2、化学性质
甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不
具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等
乙烯
1、物理性质
2、化学性质
乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯
1、物理性质。
