2016高考化学一轮复习考点练习-氯碱工业.doc
高中化学 一轮复习氯及其化合物

Cl及其化合物1、氯气的结构和性质(1)氯气的物理性质(2)氯气的化学性质①与金属反应在一定条件下,氯气跟绝大多数的金属反应生成高价金属氯化物。
与铁反应:与铜反应:与钠反应:②与非金属反应与H2的反应:与P 的反应:,③与水反应:氯水:④与碱反应与烧碱反应:,制取漂白粉:漂白粉在空气中失效:,⑤与还原性物质反应与碘化钾溶液反应:与SO2水溶液反应:与FeCl2溶液反应:2.氯气的制法I.氯气的实验室制法注意事项:II.氯气的工业制法(1)电解饱和食盐水(氯碱工业): (2)电解熔融的氯化钠(可制得金属Na ): 卤素单质及化合物的性质 1.溴、碘单质物理性质比较2.氯、溴、碘单质化学性质比较(1)与碱溶液反应,如与NaOH 溶液反应的化学方程式为 (X =Cl 、Br 、I)。
(2)氧化性和还原性(3)卤素单质易与一些还原性的离子反应,如Br 2与SO 32−、Fe 2+反应的离子方程式分别为 ; 3.卤素离子的检验方法(1)AgNO 3溶液——沉淀法未知液――→滴加AgNO 3溶液和稀硝酸生成{( )色沉淀则有Cl —( )色沉淀则有Br —( )色沉淀则有I —(2)置换——萃取法 未知液――――――――――→加适量新制饱和氯水振荡―――――――――――→加入CCl 4下层或汽油上层振荡有机层呈{红棕色或者橙红色则存在( )紫色、浅紫色或紫红色则存在( ) (3)淀粉碘化钾【练习题】1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)Cl 2具有很强的氧化性,在化学反应中只能作氧化剂( ) (2)Cl 2与水反应的离子方程式:Cl 2+H 2O===2H ++Cl -+ClO -( ) (3)过量的铁与Cl 2在一定条件下生成FeCl 2( )(4)标准状况下,11.2 L Cl 2与水充分反应转移电子数为0.5N A ( ) (5)氯气作水的杀菌消毒剂时没有发生化学变化( )(6) Cl 2能使湿润的淀粉碘化钾试纸变蓝,说明Cl 2具有氧化性( ) (7)氯分子的电子式:( )(8)新制饱和氯水的颜色呈浅黄绿色,说明氯水中含有Cl 2( )(9) Cl 2通入NaOH 溶液的离子方程式为Cl 2+OH -===Cl -+ClO -+H 2O( ) (10)漂白粉能漂白织物的原因是次氯酸盐具有氧化性( )(11)漂白粉在空气中久置变质,是因为漂白粉中的CaCl 2与空气中的CO 2反应生成了CaCO 3( )(12)由较强酸可以制取较弱的酸的规律可推出次氯酸溶液无法制取盐酸( ) (13)MnO 2与浓盐酸反应制Cl 2的离子方程式:MnO 2+4HCl=====△Mn 2++2Cl -+Cl 2↑+2H 2O( )(14)除去Cl 2中少量HCl 气体,可用饱和食盐水,也可用饱和碳酸氢钠溶液( ) (15)检验氯气可用湿润的淀粉碘化钾试纸( )(16)氯气在饱和食盐水中的溶解度小于在纯水中的溶解度( ) (17)实验室快速制取氯气可以采用高锰酸钾与浓盐酸的反应( )(18)用NaOH 溶液吸收多余的Cl 2时,为防止倒吸,导气管不能伸到液面以下( ) (19)氯气溶于水得氯水,溶液呈酸性且可以导电,所以氯气是电解质( ) (20)新制氯水必须用棕色瓶密封保存,光照氯水有气泡逸出,该气体是氯气( ) (21)新制取的漂白粉是混合物( )(22)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气( )(23)Cl 2具有很强的氧化性,在化学反应中只能作氧化剂( ) (24)实验室保存液溴时要加少量水进行水封,不用橡胶塞( )(25)碘水中通入SO 2,反应的离子方程式为SO 2+I 2+H 2O===SO 2-3+2I -+2H +( ) (26)双氧水中加入稀H 2SO 4和KI 溶液的离子方程式为H 2O 2+2H ++2I -===I 2+2H 2O( )(27)I-遇淀粉变蓝色( )(28)碘易升华,可用加热升华法除去NH4Cl中混有的I2( )2.氯水中存在许多分子和离子,它们在不同的反应中表现各自的性质,下列实验和结论一致且正确的是( )A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2的存在B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有Cl2的存在C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明氯水中有Cl-的存在D.加入NaOH溶液,氯水浅黄绿色消失,说明溶液中有HClO分子的存在3.下列对氯气的性质及实验现象描述不正确的是( )①钠在氯气中燃烧时产生白烟;②氢气在氯气中燃烧发出淡蓝色的火焰;③红热的铜丝在氯气中燃烧发出棕黄色的雾;④氯气跟水反应生成盐酸和次氯酸;⑤氯气有毒,液氯无毒A.①②B.②③⑤C.②③④D.①④4.如图所示,在A处通入氯气,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处干燥的红布条逐渐褪色。
高中化学氯碱工业 练习解析(1)旧人教第三册必修+选修

氯碱工业练习解析(1)1.将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解。
电解过程中,溶液pH随时间t变化的曲线是解析:电解质溶液中n(Cu2+)∶n(Na+)∶n(SO-24)∶n(Cl-)=1∶1∶1∶1,则可以认为首先是电解CuCl2,当Cl-电解完后电解CuSO4和水,当Cu2+电解完后,溶液中的溶质是Na2SO4和H2SO4,则是电解水。
即电解分为三个阶段进行:①CuCl2电解=====Cu↓+Cl2↑;②2CuSO4+2H2O电解=====2Cu↓+O2↑+2H2SO4;③2H2O电解=====2H2↑+O2↑。
Cu2+水解使溶液pH<7,当电解CuCl2时,Cu2+的量减少,水解减弱,pH增大;当电解CuSO4和水时,有H2SO4生成,则溶液pH变小;当电解H 2O时,溶液的浓度增大,则H2SO4浓度也增大,故溶液pH又缓慢减小。
应选D。
答案:D2.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。
应用下图电解实验可制得白色纯净的Fe(OH)2,两电极的材料分别为石墨和铁。
电化学装置Fe(OH)2(1)a电极的材料应为,电极反应式为:(2)电解液c可能是(填编号)A.纯水B.NaCl溶液C.NaOH溶液D.CuCl2溶液(3)d为苯,其作用为,在加入苯之前对c应作何简单处理。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)A.改用稀硫酸作电解液B.适当增大电源的电压C.适当减小两电极间距离D.适当降低电解液的温度(5)若c用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为:。
解析:本题考查利用电解池原理解决实验中的一个问题,此实验的目的是制取纯净的Fe(OH)2白色沉淀。
Fe(OH)2最典型的性质就是易被O2氧化,因此,在用电解法制Fe(OH)2的过程中,须采取隔绝空气的方法,电解液上面的苯层,即是为此目的而设置,加入苯之前,应先把c加热处理,以赶走溶解在其中的空气[源于课本上用煮沸的NaOH来制取Fe(OH)2]。
高三化学一轮复习【提取卤素单质的化工流程】

2.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是 A.X试剂可用Na2SO3饱和溶液 B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
√C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
1234
解析 Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确; 步骤Ⅲ根据氯的非金属性比溴的强,利用置换反应制取Br2,B正确; 反应Ⅰ和反应Ⅲ均使用到Cl2,故制取1 mol Br2消耗2 mol氯气,但未标 明氯气所处的温度和压强,C错误; 从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的 有机溶液,再经蒸馏可得纯净的溴,D正确。
2.海水提取溴
(1)工艺流程
海水 ―蒸浓――发缩→ 富含Br-的海Байду номын сангаас ―H―2―S①―O―C4酸―l2―化→ 含Br2的溶液
通热空气和↓水蒸气吹出
Br2
←③――C―l2 CCl4
HBr溶液
←S②―O―2 Br2
(2)发生反应的化学方程式 ① 2NaBr+Cl2===Br2+2NaCl ; ② Br2+SO2+2H2O===2HBr+H2SO4 ; ③ 2HBr+Cl2===2HCl+Br2 。
1234
3.海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类 提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题: (1) 由 海 水 晒 制 的 粗 盐 中含有Ca2+、Mg2+、 SO24- 等离子,为除去 这些离子,所加试剂 及其先后顺序为(填化 学式):_B_a_C_l_2、__N__a_O_H__、 _N_a_2C__O_3_、__H_C__l(_只__要__N_a_2_C_O__3在__B__a_C_l2_之__后__加__,__H__C_l最__后__加__皆__可__)_。
北京四中网校高考化学一轮复习 氯碱工业知识导学

氯碱工业[重点难点]1.掌握电解饱和食盐水的基本原理。
2.了解离子交换膜法电解食盐水制烧碱和氯气的主要生产流程。
3.掌握围绕电解的计算[知识讲解]一、电解饱和食盐水反应原理工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
1.实验分析:电解饱和食盐水电解饱和食盐水在U型管里装入饱和食盐水,滴入几滴酚酞试液,用碳棒作阳极、铁棒作阴极,将湿润的碘化钾淀粉试纸放在阳极附近,接通电源,观察管内发生的现象及试纸颜色的变化。
注意:铁棒不可作阳极,否则发生Fe-2e-=Fe2+;碘化钾淀粉试纸需事先用水润湿。
现象:阴、阳两极均有气体放出,阳极气体有刺激性气味,能使湿润的碘化钾淀粉试纸变蓝;阴极区域溶液变红。
说明阴极区域生成物为碱性物质与H2,阳极产物是Cl2。
2.电解饱和食盐水反应原理饱和食盐水成分:溶液存在Na+、Cl-、H+、OH-四种离子。
电极反应式:阴极:2H++2e-=H2↑(还原反应);阳极:2Cl--2e-=Cl2↑(氧化反应)。
实验现象解释:(1)阴极区域变红原因:由于H+被消耗,使得阴极区域OH-离子浓度增大(实际上是破坏了附近水的电离平衡,由于K W为定值,c(H+)因电极反应而降低,导致c(OH-)增大,使酚酞试液变红)。
(2)湿润的碘化钾淀粉试纸变蓝原因:氯气可以置换出碘化钾中的碘,Cl2+2KI=2KCl+I2,I2使淀粉变蓝。
注意:如果试纸被熏蒸的太久,氯气会把生成的碘氧化成碘酸又使蓝色褪去。
电解饱和食盐水的电解方程式:该电解反应属于放氢生碱型,电解质与水均参与电解反应,类似的还有K2S、MgBr2等。
3.以氯碱工业为基础的化工生产二、离子交换膜法制烧碱1.离子交换膜电解槽的构成离子交换膜电解槽主要由阳极、阴极、离子交换膜、电解槽框和导电铜棒等组成;每台电解槽由若干个单元槽串联或并联组成。
阳极用金属钛网制成,为了延长电极使用寿命和提高电解效率,阳极网上涂有钛、钌等氧化物涂层;阴极由碳钢网制成,上面涂有镍涂层;离子交换膜把电解槽分成阴极室和阳极室。
高中化学 最基础考点系列 考点11 氯碱工业 新人教版选修4

考点11 氯碱工业【考点定位】本考点考查氯碱工业原理的理解与应用,巩固对电解规律的理解,提升电池原理的应用能力。
【精确解读】一、氯碱工业电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
二、氯碱生产工艺:1.电解法简介:工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业;2.电解饱和食盐水反应原理:2NaCl+2H2O电解¯H2↑+Cl2↑+2NaOH因为NaCl是强电解质,在溶液里完全电离,水是弱电解质,也微弱电离,因此在溶液中存在Na+、H+、Cl-、OH-四种离子.当接通直流电源后,带负电的OH-和Cl-向阳极移动,带正电的Na+和H+向阴极移动.Cl-比OH-更易失去电子,在阳极被氧化成氯原子,氯原子结合成氯分子放出,使湿润的淀粉碘化钾溶液变蓝.H+比Na+容易得到电子,因而H+不断地从阴极获得电子被还原为氢原子,并结合成氢分子从阴极放出.在上述反应中,H+是由水的电离生成的,由于H+在阴极上不断得到电子而生成H2放出,破坏了附近的水的电离平衡,水分子继续电离出H+和OH-,H+又不断得到电子变成H2,结果在阴极区溶液里OH-的浓度相对地增大,使酚酞试液变红;因此,阳极反应:2Cl--2e-=Cl2↑(氧化反应);阴极反应:2H++2e-=H2↑(还原反应);工业上利用这一反应原理,制取烧碱、氯气和氢气。
3.电解设备--离子交换膜电解槽(1)离子交换膜电解槽主要由阳极、阴极、离子交换膜、电解槽框和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成.电解槽的阳极用金属钛制成;阴极由碳钢网制成;(2)阳离子交换膜的作用:①把电解槽隔为阴极室和阳极室;②只允许Na+通过,而Cl-、OH-和气体则不能通过.这样,既能防止生成的H2和Cl2相混合而发生爆炸,又能避免C12进入阴极区与NaOH溶液作用生成NaClO而影响烧碱的质量。
高考化学一轮复习高考必考大题专练

高考必考大题专练(一) A组化工流程分析题——金属类1.绿矾被广泛用于医药和工业领域,工业上两种制备绿矾(FeSO4·7H2O)的流程如图所示,根据题意回答下列问题:方法一:利用黄铜矿粉(主要成分为CuFeS2)制取绿矾(1)试剂a和试剂b分别是____________,操作1的名称是________。
(2)有一种细菌在有氧气存在的稀硫酸中,可以将CuFeS2氧化成硫酸盐,写出该反应的化学方程式:______________________。
方法二:利用工业废铁屑制取绿矾(3)加入适量Na2CO3溶液的作用是________________________。
(4)操作Ⅰ需要用到的玻璃仪器名称有________________________________。
(5)通过检验CO 2-3来判断操作Ⅰ是否洗涤干净,检验的方法是________________________________________________________________________ ________________________________________________________________________。
2.硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。
用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)生产ZnSO4·7H2O的流程如下:n+-1(1)“酸浸”时用的稀酸是________;滤渣1的主要成分是________。
(2)“氧化”时的离子方程式为________________________;加入ZnO除杂时溶液的pH 控制范围是________~5.0。
(3)滤渣3含有锌和________;由滤液得到ZnSO4·7H2O的操作是______________________、洗涤、干燥。
(4)取42则680A .ZnO B .Zn 3O(SO 4)2 C .ZnSO 4 D .ZnSO 4·H 2O3.以废旧铅酸电池中的含铅废料(Pb 、PbO 、PbO 2、PbSO 4及炭黑等)和H 2SO 4为原料,制备高纯PbO ,实现铅的再生利用。
高中化学氯碱工业 练习解析(3)旧人教第三册必修+选修

氯碱工业 练习解析(3)1.某电解质溶液的pH=a ,向其中插入两惰性电极,通电一段时间后,测知溶液的pH=b ,若b ≤a ,该电解质可能是A.Na 2SB.CuSO 4C.NaClD.Na 2SO 4解析:电解Na 2S 、NaCl 因生成NaOH ,导致溶液的pH 升高。
电解CuSO 4溶液,因生成H 2SO 4而使pH 降低。
电解Na 2SO 4溶液实质是电解水,pH 不变。
答案:BD2.将等物质的量浓度的CuSO 4和NaCl 溶液等体积混合后,用石墨电极进行电解。
电解过程中溶液的pH 随时间(t )的变化关系如图4-1所示,下列曲线合理的是p H t 0Ap H t 0Bp Hp H t 0C图4-19解析:假如溶液中有1 mol CuSO 4、1 mol NaCl ,开始因Cu 2+、Cl -放电而pH 基本不变,当Cl -放电完毕后,因OH -放电,使H 2O H ++OH -右移产生H +而使pH 减小,最后因电解水而pH 不变。
故答案选C 。
答案:C3.用N A 表示阿伏加德罗常数,下列说法正确的是 A.1 mol I -被氧化时失去电子N A 个B.标准状况下2.24 L 甲烷和氨气的混合气,所含电子数为4N AC.1 mol OH -在电解过程中被氧化,提供电子数为2N A 个D.1 L pH=1的水溶液中,水合氢离子数为N A解析:标准状况下2.24 L CH 4和NH 3所含电子数为N A ;1 mol OH -在阳极失去1 mol e -;pH=1的溶液,c (H +)=0.1 mol ·L -1,n (H +)=0.1 mol 。
答案:A4.用惰性电极电解100 mL 4 mol ·L -1的CuSO 4溶液,一定时间后在阳极收集到1.12 L 气体。
向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe 2+浓度为(设溶液体积不变,反应前后均为标况)A.2.7 mol·L-1B.3 mol·L-1C.4 mol·L-1D.1 mol·L-1解析:电解CuSO4溶液,Cu2+放电的同时会产生H+,且Cu2+~2H+。
高中化学氯碱、硫酸、硝酸三大工业专项复习苏教版必修一
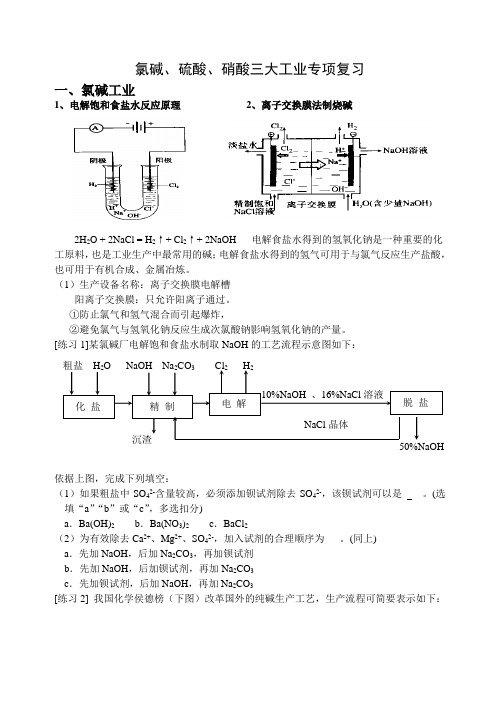
氯碱、硫酸、硝酸三大工业专项复习一、氯碱工业1、电解饱和食盐水反应原理2、离子交换膜法制烧碱2H2O + 2NaCl = H2↑+ Cl2↑+ 2NaOH 电解食盐水得到的氢氧化钠是一种重要的化工原料,也是工业生产中最常用的碱;电解食盐水得到的氢气可用于与氯气反应生产盐酸,也可用于有机合成、金属冶炼。
(1)生产设备名称:离子交换膜电解槽阳离子交换膜:只允许阳离子通过。
①防止氯气和氢气混合而引起爆炸,②避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量。
[练习1]某氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:依据上图,完成下列填空:(1)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是____。
(选填“a”“b”或“c”,多选扣分)a.Ba(OH)2b.Ba(NO3)2c.BaCl2(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___。
(同上)a.先加NaOH,后加Na2CO3,再加钡试剂b.先加NaOH,后加钡试剂,再加Na2CO3c.先加钡试剂,后加NaOH,再加Na2CO3[练习2] 我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:⑴上述生产纯碱的方法称,副产品的一种用途为。
⑵沉淀池中发生的化学反应方程式是。
⑶写出上述流程中X物质的分子式。
⑷使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述流程中的编号)的循环。
从沉淀池中取出沉淀的操作是。
⑸为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加。
[练习3]根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。
用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016高考化学一轮复习考点练习-氯碱工业.doc氯碱工业一.选择题(共18小题)1.下列有关工业生产的叙述正确的是()A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠C.硫酸工业中,在接触室安装热交换器是利用SO3转化为H2SO4时放出的热量D.电解饱和食盐水制烧碱采用离子交换膜,可防止阳极室产生的H2进入阴极室2.饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是()A.该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4ClB.母液中通入的氨气与HCO3﹣反应:NH3+HCO3﹣→CO32﹣+NH4+C.加食盐是为增大溶液中Cl﹣的浓度D.由题可知温度较低时,氯化铵的溶解度比氯化钠的大3.NaCI是一种化工原料,可以制备一系列物质(如图所示),下列说法正确的是()A.常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应B.工业上利用澄清石灰水与Cl2反应来制漂白粉C.往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3D.电解含酚酞的NaCl溶液,由于OH﹣往阳极移动,故阳极先变红4.下列关于工业生产的说法正确的是()A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率C.在氯碱工业,电解槽一般用铁网作电极D.合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法5.下列化学工业中,未涉及原料循环使用的是()A.侯德榜制碱法B.索尔维制碱法C.工业电解饱和食盐水D.工业炼铁6.化学与人们的生产、生活息息相关.下列有关说法正确的是()A.氯碱工业是利用电解原理来生产氯气和纯碱B.农业生产中可将氮肥硫酸铵与钾肥碳酸钾混合使用C.区分食盐是否加碘的方法是观察食盐是否略显紫色D.可用点燃的方法鉴别衣物是否为丝织品、毛织品7.下列关于化工生产原理的叙述中,符合目前工业生产实际的是()A.氯碱工业中,离子交换膜的作用是防止离子运动B.硫酸、硝酸、合成氨均使用了催化剂C.石油裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃D.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸8.下列有关说法中正确的是()A.自来水厂可用明矾对水进行消毒杀菌B.氯碱工业中,NaOH是在阴极室中产生的C.电解法精炼铜时,粗铜接电源的负极D.实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用玻璃塞9.下列化学工业原理对应不正确的是()化工氯碱工业原理2H2O+2NaCl H2↑+Cl2↑+2NaOHA化工高炉炼铁原理3CO+Fe2O32Fe+3CO2B化工铜的精炼原理阴极:Cu ﹣2e﹣═Cu2+C化工生产漂白粉原理2Ca(OH)+2Cl2═CaCl2+Ca(ClO)2+2H2O2DA. A B. BC.C D.D10.下列说法不正确的是()A.使用分光光度计,可以换算得到某溶液的浓度B.氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的NaCl溶液,往阴极室注入稀氢氧化钠溶液(或去离子水)C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高D.1fs(飞秒)=10﹣12s(秒)11.下列关于烧碱的制备、性质及其应用的表述错误的是()A.电解饱和食盐水制烧碱的离子方程式为:2Cl﹣+2H2O2OH﹣+H2↑+Cl2↑B.1807年英国科学家戴维通过电解熔融烧碱在阴极获得金属钠C.向石灰乳中加入纯碱是工业上制备烧碱的方法之一D.不慎将酸沾到皮肤上,要立即用大量水冲洗,然后涂上烧碱溶液12.下列工业生产的说法错误的是()A.氯碱工业中隔离两电极的材料是阳离子交换膜,因此该生产方法又称“阳离子交换膜法”B.生产普通玻璃的主要原料及设备:石灰石、石英、纯碱及玻璃熔炉C.由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不采用高压的反应条件D.合成氨的反应是放热反应,因此工业合成常采用低温条件13.氯化钠是一种重要的生活、生产必需品.下列表述中正确的是()A.NaCl的电子式为B.NaCl的水溶液是强电解质C.23Na37Cl中质子数和中子数之比是8:7 D.电解熔融氯化钠可得到氯气和金属钠14.下面物质中,不是氯碱工业的直接产品的是()A.碳酸钠B.氢氧化钠C.氢气D.氯气15.下列有关工业生产的叙述正确的是()A.氯碱工业中,阳极发生的反应是:4OH ﹣﹣4e﹣→2H2O+O2↑B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2S04时放出的热量C.合成氨生产过程中将NH3液化分离,提高N2、H2的转化率D.高炉中的主要反应是高温下焦炭和铁的氧化物直接作用炼出生铁16.下列关于工业生产说法正确的是()A.氯碱工业中的阳离子交换膜阻止阳离子通过B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理C.工业上均用电解熔融氧化物的方法制金属镁和铝D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳17.下列关于化工生产原理的叙述中,均符合目前工业生产实际的是()A.氯碱工业中,氢氧化钠在电解槽的阴极区产生B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸C.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸18.属于联合制碱法优点的是()A.氨和二氧化碳由合成氨厂提供B.母液可回收氯化铵C.氯化钠的利用率达96%以上D.以上全是二.填空题(共5小题)19.氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:(1)该流程中可以循环的物质是.电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果.(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).则B处产生的气体是,E电极的名称是.电解总反应的离子方程式为.(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为.(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为.20.纯碱是重要的化工厂产品,可用来制玻璃,制皂,造纸,纺织,印染等.其合成及其他综合利用过程如下图所示:(1)图中制取的原料气体是.原料气中的一种气体源于碳氢化合物和水.请写出甲烷和水在催化剂和高温条件下反应的方程式:.工业生产中,设备A中发生的化学反应方程式是,母液中可提取的副产品是化学方程式是.(3)尿素[CO(NH2)2]适用于各种土壤,在土壤中尿素发生水解,生成两种气体,其水解的化学方程式是.(4)纯碱的水溶液可用来洗涤油污,理由是(结合相关离子方程式解释).(5)上述流程中,可循环使用的物质是.(6)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品NaCl的质量分数.样品W克溶液沉淀固体m克样品中NaCl质量分数的表达式为.21.工业上用电解饱和NaCl溶液的方法来制取NaOH、H2和Cl2,并以它们为原料生产一系列化工产品,称为氯碱工业.(1)氯碱厂的盐酸车间可用氯气、氢气为原料进行生产,试写出其化合的化学方程式.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,其相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.①图中X、Y分别是、,分析比较图示中氢氧化钠质量分数a%与b%的大小;②分别写出燃料电池B中的电极反应,正极:;负极:.22.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如图:依据如图,完成下列填空:(1)在电解过程中,与电源正极相连的电极上发生的反应为.与电源负极相连的电极附近溶液c(OH﹣)(填“不变”、“升高”或“下降”)如果粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣,该钡试剂可以是(填字母).a.Ba(OH)2b.Ba(NO3)2c.BaCl2(3)为有效除去Ca2+、Mg2+、SO42﹣,加入试剂的合理顺序为(填字母).a.先加NaOH,后加Na2CO3,再加钡试剂,最后加盐酸调pH至溶液呈中性b.先加NaOH,后加钡试剂,再加Na2CO3,最后加盐酸调pH至溶液呈中性c.先加钡试剂,后加NaOH,再加Na2CO3,最后加盐酸调pH至溶液呈中性(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl.(5)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为.23.化工中把电解饱和食盐水的工业生产叫氯碱工业,其生产流程如下:(1)除去食盐水中的Ca2+、Mg2+、SO42﹣,应分别加入下列沉淀剂:①NaOH(aq)、②Na2CO3(aq)、③BaCl2(aq),加入沉淀剂的顺序为(填序号);加入盐酸的作用为.如图为实验室电解饱和食盐水的实验装置.X、Y均为石墨电极,两极周围溶液均滴有几滴酚酞试液.①电解一段时间后,X电极及附近溶液能观察到的现象是;Y电极上的电极反应式为,检验该极产生的气体的方法是.②电解饱和食盐水的离子方程式为;若饱和食盐水体积为200mL,且忽略电解过程中的体积变化及气体溶解,当两极共收集到气体(共两种)44.8mL(标准状况)时,溶液的pH=.三.解答题(共5小题)24.侯氏制碱法的生产流程可表示如下,请回答下列问题:(1)沉淀池中加入(或通入)有关物质的顺序为→→写出上述流程中X、Y的化学式:XY(3)写出沉淀池中发生的化学反应方程式(4)侯氏制碱法的生产流程中可以循环使用的物质主要为、(5)从沉淀池中取出沉淀的操作是,为了进一步提纯NaHCO3晶体,可采用法(6)若在煅烧炉中燃烧的时间较短,NaHCO3将化解不完全.现若取10.5g NaHCO3固体,加热一定时间后,剩余固体的质量为7.1g,如果把此剩余固体全部加入到200mL 1mol/L的盐酸中,充分反应后溶液中H+的物质的量浓度为mol/L(溶液体积变化忽略不计)25.1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家都创立了要为先进的侯德邦制碱法,也叫联合制碱法,两种制碱的生产流程可需要表示如图1:(1)向沉淀池中通入CO2和氮气时,应先通入氮气的原因是;沉淀池中发生反应的化学反应方程式是;(3)氨碱法生产流程示意图的Y是,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为;(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确的是(选填编号)A.常温时氯化铵的溶解度比氯化钠小B.通入氨气能增大NH4+的浓度,使氯化铵更多析出C.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出D.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度(5)联合剂碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环I.联合制碱法的另一项优点是.(6)从沉淀地析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g 试样,配制成100mL溶液,用标准盐酸溶液确定(用甲基酸提示剂),测定值记录如下:滴定次数待测液(mL)0.6000mol/L盐酸溶液的体积(mL)初读数终读数第一次20.00 1.00 21.00第二次20.00 如图2Ⅰ如图2Ⅱ①第二次滴定,从图Ⅰ图Ⅱ显示消耗的盐酸溶液体积为;②该实验测定NaHCO3含量的计算式为ω(NaHCO3)=.26.技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低.生产流程可简要表示如下图:(1)向沉淀池中要通入CO2和氨气,应先通入(填化学式).沉淀池中发生反应的化学方程式,煅烧炉中发生反应的化学方程式是.(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是,加入细小食盐颗粒的作用是.(4)写出路布兰制碱法的反应原理中属于氧化还原反应的化学方程式,该法与侯德榜制碱法相比的缺点是(写出两点即可)(5)候氏制碱法制得的纯碱中含有碳酸氢钠杂质.现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g.则此样品中的纯度表达式为:.27.氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.(1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等杂质,所以在进入电解槽前需要进行精制,通常可以选用Na2CO3、NaOH、BaCl2作为除杂质的试剂,则加入三种试剂的先后顺序为;加入Na2CO3后所发生反应的离子方程式为;若食盐水不经过精制就直接进入离子膜电解槽,可能出现的后果是.如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极用碳钢网制成),则B处产生气体的化学式为,C电极的名称是,电解总反应的化学方程式为;(3)从阳极槽出来的淡盐水往往含有少量的溶解氯,需要加入8%﹣9%的亚硫酸氢钠溶液将其彻底除去,该反应的离子方程式为;(4)已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度为1.45×104A,则该电解槽的电解效率η(NaOH)=.[提示:η=(产品的实际产量/产品的理论产量)×100%].28.氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:(1)该流程中可以循环的物质是.电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式、,若食盐水不经过二次精制,仍会有少量的Ca2+、Mg2+直接进入离子膜电解槽,这样产生什么后果是.(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).则B处产生的气体是,E电极的名称是极.电解总反应的离子方程式为.(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为.(5)已知在电解槽中,每小时通过1安培的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为.氯碱工业参考答案一.选择题(共18小题)1.B 2.D 3.C 4.BD 5.D 6.D 7.B 8.B 9.C 10.D 11.D 12.D 13.D 14.A 15.C 16.D 17.AC 18.D二.填空题(共5小题)19.氯化钠、氢氧化钠Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜H2阳极2Cl-+2H2O Cl2↑+H2↑+2OH-Na2SO3+Cl2+H2 O=Na2SO4+2HCl93.46%20.N2、H2CH4+2H2O CO2+4H2或CH4+H2O CO+3H2NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓NH4ClCO(NH2)+H2O=2NH3↑+CO2↑CO32-+H2OHCO3-+OH-,溶2液显碱性,促进油脂的水解N2、H2、CO2、NaHCO 3(1-)×100%21.H2+Cl22HClCl2H2b%>a%O2+2H2O+4e-=4OH-2H2+4OH--4e-=4H2O 22.2Cl--2e-=Cl2↑变大acbc蒸发过滤NaCl+H2O NaClO+H2↑23.①③②(或③①②或③②①)除去过量的OH-和CO32-(或NaOH和Na2CO3)X电极上有气泡产生,附近溶液逐渐变红色2Cl--2e-═Cl2↑用湿润的淀粉KI试纸检验,若试纸变蓝,证明该极产生Cl2(合理答案均给分)2Cl-+2H2O H2↑+Cl2↑+2OH-12三.解答题(共5小题)24.饱和食盐水NH3CO2CO2NH4ClNaCl+NH3+CO2+H2O=NH4 Cl+NaHCO3↓CO2NaCl过滤重结晶0.375mol/L25.二氧化碳溶解度小,氨气易溶于水,先通入氨气有利于二氧化碳的吸收NH3+CO2+NaCl+H2O═NaHCO3↓+NH4ClNH3C aCO3+2NaCl═Na2CO3+CaCl2BD避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备20.20ml×100%26.NH3NH3+CO2+NaCl+H2O=NaHCO3↓+NH4 Cl2NaHCO3Na2CO3+CO2↑+H2ONH4Cl增大Cl-浓度,使NH4Cl更多析出Na2SO4+2C Na2S+2CO2↑生产时需要高温、硫酸对设备腐蚀严重、CaS废弃物长期堆积臭气四溢、成本较高%27.NaOH、BaCl2、Na2CO3或者BaCl2、NaOH、Na2CO3CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓粗盐水中含有钙离子、镁离子,在碱性环境下生成沉淀,堵塞损坏离子交换膜H2阳极2NaCl+2H2O Cl2↑+H2↑+2NaOHHSO3-+Cl2+ H2O=SO42-+3H++2Cl-93.46%28.氯化钠、氢氧化钠(或NaCl、NaOH)Ca2++CO32-=CaCO3↓Mg2++2OH-=Mg(OH)2↓少量Mg2+、Ca2+在电解碱性条件下会生成沉淀,损害离子交换膜H2阳2Cl-+2H2O Cl2↑+H2↑+2OH-Na2SO3+Cl2+H2O=Na2SO4+2HCl93.46%。
