氢氧化钠滴定液标定记录
氢氧化钠标定数据记录结果

氢氧化钠标定数据记录结果氢氧化钠标定数据记录结果为了保证化学实验的准确性和精度,我们需要进行化学试剂的标定。
其中,氢氧化钠是一种常见的化学试剂,而其标定也是实验室必不可少的工作之一。
下面,就让我们来详细记录一下我们进行氢氧化钠标定的过程和结果吧。
实验设备及试剂准备本次实验所需设备如下:1. 50mL 稳定性较好的烧杯 1 只2. 电子天平 1 台3. 塑料吸管 1 根4. 10mL 容量瓶 1 个5. 磁力搅拌器和磁力子 1 台6. 0.1mol/L 氢氧化钠溶液 50mL 实验过程1. 用烧杯称取0.5g 左右的氢氧化钠,并加入10mL 的蒸馏水中,用塑料吸管搅拌均匀,直到溶解完全。
2. 把溶液转移至20mL 的容量瓶中,用蒸馏水补至刻度线,用于后续的标定。
3. 用电子天平称取 0.25g 左右的干燥草酸并加入50mL 蒸馏水中,用塑料吸管搅拌均匀,直到溶解完全。
4. 把溶液转移到 100mL 的烧杯中,并加入几滴菲嗪指示剂。
5. 在磁力搅拌器上加热烧杯中的溶液,加热至快速沸腾。
6. 开始进行标定。
将容量瓶中的氢氧化钠溶液均匀地滴加到烧杯中的草酸溶液中,直到溶液呈现浅粉色。
此时,记录加入的氢氧化钠溶液体积为 V mL。
7. 测定同样体积的蒸馏水的草酸标准溶液的滴定实验,同样操作,直至到达草酸标准溶液呈现相似的浅粉色,记录草酸标准溶液消耗的体积为 V1 mL。
结果记录与分析本次标定实验的结果记录如下:氢氧化钠滴加体积: V mL 草酸标准溶液滴定体积:V1 mL根据实验结果,可以计算出氢氧化钠标准溶液的浓度。
氢氧化钠和草酸的反应式如下:NaOH + H2C2O4 → Na2C2O4 + 2H2O草酸的摩尔质量为 90.03g/mol,氢氧化钠的摩尔质量为 40.01g/mol,且上述反应中草酸和氢氧化钠的摩尔比为1:2。
因此,可得:M(NaOH)×V(NaOH)×2= M(H2C2O4)×V1×1其中,M(NaOH)为氢氧化钠标准溶液的浓度,M(H2C2O4)为草酸标准溶液的浓度。
滴定液的配制与标定

滴定液的配制与标定0.1mol/L氢氧化钠滴定液的配制与标定【配制】取氢氧化钠40.00g,加水1000ml振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。
取澄清的氢氧化钠饱和溶液5.6ml,加新沸过的冷水使成1000ml,摇匀。
【标定】取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(0.1mol/L) 相当于20.42mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
如需用氢氧化钠滴定液(0.05mol/L、0.02mol/L或0.01mol/L)时,可取氢氧化钠滴定液(0.1mol/L)加新沸过的冷水稀释制成。
必要时,可用盐酸滴定液(0.05mol/L、0.02mol/L或0.01mol/L)标定浓度【贮藏】置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
0.1mol/L、0.2mol/L、0.5mol/L和1.0mol/L氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液。
浓度氢氧化钠饱和溶液注入不含CO2的水0.1mol/L量取5ml1000中摇匀0.2mol/L量取10ml1000中摇匀0.5mol/L量取26ml1000中摇匀1.0mol/L量取52ml1000中摇匀二、标定:1、原理:KHC8H4O4+NOH→KNaC8H4O4+H2O酸式酚酞碱式酚酞HIn→In-+H+(无色)(红色)酚酞为一有机弱酸,在酸性溶液中为无色,当碱色离子增加到一定浓度时,溶液即呈粉红色。
2、仪器:滴定管50ml;三角瓶250ml。
3、标定过程0.1mol/LNOH标准溶液称取0.4-0.6克;0.2mol/L称1-1.2克;0.5mol/L称取3克于105-110℃烘至恒重的苯二甲酸氢钾,称准至0.0002克,分别溶于50ml;80ml不含二氧化碳水中,加2滴1%酚酞指示剂,用配好的待标定溶液至溶液呈粉红色与标准色相同。
氢氧化钠标准溶液配制标定

实验0.1mol/L氢氧化钠标准溶液的配制与标定
一、目的要求
1.掌握配制标准溶液和用基准物质标定标准溶液浓度的方法。
2.掌握滴定操作和滴定终点的判断。
二、基本原理
本实验选用邻苯二甲酸氢钾作为标定NaOH标准溶液的基准物质。
它易于提纯,在空气中稳定、不吸潮、易于保存、摩尔质量大。
标定反应为:
计量点时由于弱酸盐的水解,溶液呈微碱性,应采用酚酞为指示剂。
为了消除测定误差,原则上,标定和测定时所采用的标准溶液和指示剂,应尽可能一致。
三、试剂
1.氢氧化钠:A.R.
2.邻苯二甲酸氢钾:A.R.
3.1%酚酞乙醇溶液
四、实验步骤
1.0.1mol/LNaOH标准溶液的配制(1份/4人)
粗称4.4g NaOH于量杯中,加新煮沸放冷的蒸馏水搅拌、溶解并稀释至1000ml。
2.0.1mol/LNaOH标准溶液的标定
取105~110℃干燥至恒重的基准邻苯二甲酸氢钾约0.40 g(±10%),精密称定,置250ml锥形瓶中。
加入50ml新鲜蒸馏水,振摇使之完全溶解,加1%酚酞指示剂2滴,用0.1mol/L NaOH标准溶液滴定使溶液由无色至微红色(30s 不褪),即为终点。
平行测定三次。
计算NaOH溶液的浓度,三次测定的相对平均偏差应小于0.2%。
五、数据记录和计算。
NaOH溶液的配制与标定记录
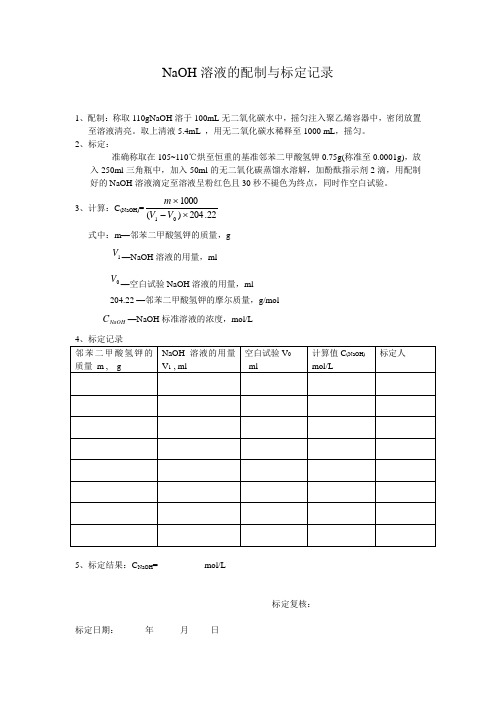
1、配制:称取110gNaOH 溶于100mL 无二氧化碳水中,摇匀注入聚乙烯容器中,密闭放置至溶液清亮。
取上清液5.4mL ,用无二氧化碳水稀释至1000 mL ,摇匀。
2、标定:准确称取在105~110℃烘至恒重的基准邻苯二甲酸氢钾0.75g(称准至0.0001g),放入250ml 三角瓶中,加入50ml 的无二氧化碳蒸馏水溶解,加酚酞指示剂2滴,用配制好的NaOH 溶液滴定至溶液呈粉红色且30秒不褪色为终点,同时作空白试验。
3、计算:C (NaOH)=22.204)(100001⨯-⨯V V m式中:m —邻苯二甲酸氢钾的质量,g1V —NaOH 溶液的用量,ml 0V —空白试验NaOH 溶液的用量,ml204.22 —邻苯二甲酸氢钾的摩尔质量,g/molNaOH C —NaOH 标准溶液的浓度,mol/L5、标定结果:C NaOH = mol/L标定复核:标定日期: 年 月 日1.配置:吸取浓盐酸9ml,缓缓注入适量水中,冷却用水稀释至1000ml,摇匀。
2.标定:吸取新配置的盐酸溶液25.0ml于250ml锥形瓶中,加入酚酞指示液2滴,以0.1mol/L的氢氧化钠标准溶液滴定至溶液呈现微红色且30秒不退,为其终点。
3.计算c(HCL)=C1V1/25其中c(HCL)---------盐酸标准溶液的浓度mol/LC1----------------------氢氧化钠标准溶液的浓度mol/LV1---------------------------------消耗氢氧化钠标准溶液的体积ml25 ---------------------取盐酸溶液的体积ml4.标定记录5、标定结果c(HCL)=mol/L标定复核:标定日期:年月日。
标准溶液配制与标定原始记录(氢氧化钠)

邯郸市丛台区安东食品加工厂
标准溶液配制与标定原始记录
标准溶液的配制
标准溶液名称预配浓度配制方法配制日期
氢氧化钠标准溶液0.1 mol/L GB/T601-2002年月日
标准溶液的标定
基准物名称温度℃湿度%所用仪器及试剂
邻苯二甲酸氢钾(99.9%)
1酚酞指示剂
2无二氧化碳水
3烘箱
标定标定日期:年月日
序号基准物质的质
量m ; (g)
消耗标准溶液的
体积V1 ; (ml)
空白消耗标准溶液
的体积V0 ;(ml)
计算结果
mol/L
平均结果
mol/L
1
2
3
4
复标复标日期:年月日1
2
配制人:标定人:复标人:如有侵权请联系告知删除,感谢你们的配合!。
氢氧化钠标准滴定溶液的标定

氢氧化钠标准滴定溶液的标定-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN氢氧化钠标准滴定溶液浓度的标定1.标定步骤称取(精确至)已于105℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,溶于70ml水中,加2~3滴10g/l酚酞指示剂后摇匀。
用配制好的l的氢氧化钠标准溶液滴定至溶液呈粉红色,并保持30s。
同时做空白实验。
2.计算公式氢氧化钠标准滴定溶液的浓度〔c(NaOH)〕,数值以摩尔每升(mol/l)表示,按下式计算:m × 1000C(NaOH)=( V1 - V2 ) · M式中:m——邻苯二甲酸氢钾的质量准确数值, gV1——氢氧化钠溶液的体积, mlV2——空白实验氢氧化钠溶液的体积, mlM——邻苯二甲酸氢钾的摩尔质量数, g/ml(M =)硫酸溶液含量的测定1.方法提要以甲基红-次甲基蓝为指示剂,用氢氧化钠标准滴定溶液中和滴定以测得硫酸含量。
2.试剂和溶液氢氧化钠标准滴定溶液:c(NaOH)=l;甲基红-次甲基蓝混合指示剂。
3.分析步骤用已称重的带磨口盖的小称量瓶,称取约试样(精确至),小心移入装有50ml水的250ml锥形瓶中,冷却至室温后,加入2~3滴混合指示剂摇匀,用氢氧化钠标准滴定溶液滴定至溶液呈灰绿色为终点。
4.计算公式硫酸溶液的质量分数w1按照下式计算:V × C × Mw1= × 100m × 1000式中:V——滴定耗用的氢氧化钠标准滴定溶液的体积,ml;C——氢氧化钠标准滴定溶液的浓度,mol/l;m——试样的质量,g;M——硫酸的摩尔质量数,g/mol(M=5.本方法平行测定结果的允许绝对差值不大于%。
氢氧化钠标准溶液的配制和标定
氢氧化钠标准溶液的配制和标定取氢氧化钠液适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,澄清后备用。
氢氧化钠滴定液配制:氢氧化钠滴定液(1mol/l)取澄清的氢氧化钠饱和溶液56ml,加新沸过的冷水使成1000ml,摇匀氢氧化钠滴定液(0.5mol/l)取澄清的氢氧化钠饱和溶液28ml,加新沸过的冷水使成1000ml,摇匀氢氧化钠滴定液(0.1mol/l)取澄清的氢氧化钠饱和溶液5.6ml,加新沸过的冷水使成1000ml,摇匀氢氧化钠滴定液(0.05mol/l)取澄清的氢氧化钠饱和溶液2.8ml,加新沸过的冷水使成1000ml,摇匀标定:氢氧化钠滴定液(1mol/l):取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(1mol/l)相等于204.2mg的邻苯二甲酸氢钾。
根据本液的消耗与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得氢氧化钠滴定液(0.5mol/l)取在105℃干燥至恒重的基准邻苯二甲酸氢钾约3g,照上法标定。
每1ml氢氧化钠滴定液(0.5mol/l)相等于102.1mg的邻苯二甲酸氢钾氢氧化钠滴定液(0.1mol/l)取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,照上法标定。
每1ml氢氧化钠滴定液(0.1mol/l)相等于20.42mg的邻苯二甲酸氢钾氢氧化钠滴定液(0.05mol/l)取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.3g,照上法标定。
每1ml氢氧化钠滴定液(0.05mol/l)相等于10.21mg 的邻苯二甲酸氢钾。
氢氧化钠滴定液配制与标定
Preparation and Standardization for Sodium Hydroxide Volumetric Solution (氢氧化钠滴定液配制与标定)Author 作者:Date日期:AC Analyst/AC分析员Approved by 批准人:Date日期:AC Director/ AC主管Approved by 批准人:Date日期: EHS VP & QA Director/EHS副总兼QA主管Approved by 批准人:Date日期: 杨蕊,Executive VP/常务副总经理Change修改内容:Update the version/更新旧版本Objective/Scales 目标/范围:Be applicable to preparation,standardization, and re-standardization for NaOH standard solution.适用于氢氧化钠滴定液(0.5mol/L)的配制,标定与复标。
Definitions术语定义:N/A Applicable to适用对象:AC /分析化学部Attachment 附件:A: Error Criteria for Standard Solution Standardization/滴定分析用标准溶液标定的误差要求B: Logbook for Preparation and Standardization of NaOH Volumetric Solution /氢氧化钠滴定液配制和标化记录Reference Standard 参考标准Procedure 程序:Responsibility 执行人Step步骤Action执行内容Analyst 分析员1 Sample appropriate sodium hydroxide, add definite water, surge andshake, until saturated solution is produced. Cool it, put it in a plastic bottle made of ethane, deposit it, make it clarify,Preparation and Standardization for Sodium Hydroxide Volumetric Solution (氢氧化钠滴定液配制与标定)Responsibility 执行人Step步骤Action执行内容取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后臵乙烯塑料瓶中,静臵,澄清后备用。
滴定液的配制与标定
0.1mol/L氢氧化钠滴定液的配制与标定【配制】取氢氧化钠40.00g,加水1000ml振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。
取澄清的氢氧化钠饱和溶液5.6ml,加新沸过的冷水使成1000ml,摇匀。
【标定】取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(0.1mol/L) 相当于20.42mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
如需用氢氧化钠滴定液(0.05mol/L、0.02mol/L或0.01mol/L)时,可取氢氧化钠滴定液(0.1mol/L)加新沸过的冷水稀释制成。
必要时,可用盐酸滴定液(0.05mol/L、0.02mol/L或0.01mol/L)标定浓度【贮藏】置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
0.1mol/L、0.2mol/L、0.5mol/L和1.0mol/L氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液。
浓度氢氧化钠饱和溶液注入不含CO2的水0.1mol/L量取5ml1000中摇匀0.2mol/L量取10ml1000中摇匀0.5mol/L量取26ml1000中摇匀1.0mol/L量取52ml1000中摇匀二、标定:1、原理:KHC8H4O4+NOH→KNaC8H4O4+H2O酸式酚酞碱式酚酞HIn→In-+H+(无色)(红色)酚酞为一有机弱酸,在酸性溶液中为无色,当碱色离子增加到一定浓度时,溶液即呈粉红色。
2、仪器:滴定管50ml;三角瓶250ml。
3、标定过程0.1mol/LNOH标准溶液称取0.4-0.6克;0.2mol/L称1-1.2克;0.5mol/L称取3克于105-110℃烘至恒重的苯二甲酸氢钾,称准至0.0002克,分别溶于50ml;80ml不含二氧化碳水中,加2滴1%酚酞指示剂,用配好的待标定溶液至溶液呈粉红色与标准色相同。
1mol氢氧化钠滴定液的配制与标定
1mol氢氧化钠滴定液的配制与标定一、实验目的1. 了解氢氧化钠的性质及其在化学分析中的应用;2. 学习配制氢氧化钠滴定液的方法;3. 掌握氢氧化钠滴定液的标定方法。
二、实验原理氢氧化钠(NaOH)为一种强碱性物质,常用于酸碱滴定分析中作为滴定剂。
其化学式为NaOH,为白色固体,易溶于水,呈碱性。
氢氧化钠滴定液的配制方法:在滴定前,首先需要配制所需的氢氧化钠滴定液。
一般情况下,氢氧化钠滴定液的浓度为0.1mol/L。
其配制方法如下:1. 称取所需量的氢氧化钠粉末,加入约200ml蒸馏水中;2. 搅拌使氢氧化钠充分溶解,注意不要溶解过度;3. 将溶液转移至1L容量瓶中;4. 加入适量蒸馏水,使溶液体积达到1L;5. 用盖子盖好容量瓶,彻底摇匀。
氢氧化钠滴定液的标定方法:在标定之前,需要先准确地测量出氢氧化钠滴定液的浓度。
其标定方法如下:1. 将一定体积的氢氧化钠滴定液取出,转移到滴定瓶中;2. 加入几滴酚酞指示剂,并用标准盐酸溶液进行滴定;3. 滴定至酚酞由粉红色变为无色,记录所需的标准盐酸溶液的体积;4. 根据反应方程式,计算出氢氧化钠滴定液的浓度。
三、实验步骤1. 称取适量的氢氧化钠粉末,加入约200ml蒸馏水中,搅拌使氢氧化钠充分溶解;2. 将溶液转移至1L容量瓶中,并加入适量蒸馏水,使溶液体积达到1L;3. 用盖子盖好容量瓶,彻底摇匀,即为氢氧化钠滴定液;4. 取一定体积的氢氧化钠滴定液,放入滴定瓶中;5. 加入几滴酚酞指示剂,并用标准盐酸溶液进行滴定;6. 滴定至酚酞由粉红色变为无色,记录所需的标准盐酸溶液的体积;7. 根据反应方程式,计算出氢氧化钠滴定液的浓度。
四、实验注意事项1. 操作过程中要注意安全,避免氢氧化钠溶液溅入眼睛或皮肤;2. 在配制氢氧化钠滴定液时,应注意控制氢氧化钠的溶解度,避免溶解过度;3. 在滴定过程中,应注意控制滴定速度,以免过度或不足;4. 在滴定过程中,应注意观察酚酞指示剂的颜色变化,避免过度滴定;5. 滴定前应先进行标准化,保证滴定结果的准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢氧化钠滴定液标定记录
标定: 105℃干燥至恒重的称量瓶与基准邻苯二甲酸氢钾重:
g/ g;
精密称取: ⑴⑵⑶
-) -) -)
加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定,在接近终点时,使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(0.1mol/L)相当于20.43mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液浓度,即得。
消耗氢氧化钠滴定液(0.1mol/L)的毫升数:
⑴ml; ⑵ml; ⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应 %。
标定结果。
标定人:。
