1.1第一课时 原子结构(1) 课件
合集下载
《原子的结构》公开课一等奖课件
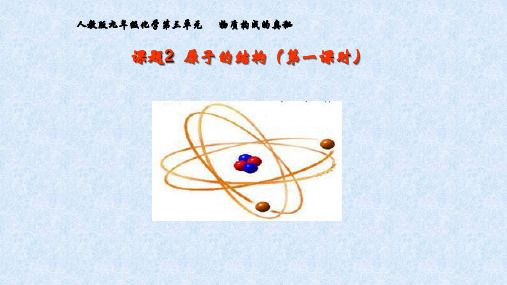
人教版九年级化学第三单元 物质构成的奥秘
课题2 原子的结构(第一课时)
原子的发现历程
道尔顿于1803 年提出科学假 说:物质由原子 组成,原子是不 可分割的实心 球体,同种原子 的性质和质量 相同.
•改写这一论断的是科学家汤姆生。
原子的发展历程
原子是不是不可分割的实心球体?
1897年,英国物 理学家汤姆生发现电 子,认为原子的模型 为西瓜型,原子是一 个平均分布着正电荷 的粒子,其中镶嵌着 许多电子,中和了正 电荷,从而形成了中 性原子
练习:下列五种微粒中易失去电子的是A、D,易得到 电子的是 E , 达到稳定结构是 B、C .
A
B
C
D
E
根据下列结构示意图判断
A
B
C
D
E
F
其中属于稀有气体的是_D__F_____属于金属元素 的是_B__C___,属于非金属元素的是__A__E___
2、少数带正电的α粒子发生方向上 的偏转;(说明原子核带正电, α 粒子途经原子核附近时,受到斥力 改变了运动方向)
3、极少数带正电的α粒子被反弹。(说明金原子 核质量比α粒子大得多, α粒子正好碰到金原子核 被弹了回来)
一、原子的构成
质子(带正电) 每个质子带一个
原子核
单位正电荷
(带正电)
原子
中子(不带电)
⑶ 第二层上最多排8个电子;
⑷ 最外层上最多排8个电子.
原子结构示意图的涵义
原子核 电子层 在该电子层上 运动的电子数 最外层电子数
核电荷数
稀有气体元素的原子结构示意图
+2 2 +10 2 8
氦He
氖Ne
+18 2 8 8
课题2 原子的结构(第一课时)
原子的发现历程
道尔顿于1803 年提出科学假 说:物质由原子 组成,原子是不 可分割的实心 球体,同种原子 的性质和质量 相同.
•改写这一论断的是科学家汤姆生。
原子的发展历程
原子是不是不可分割的实心球体?
1897年,英国物 理学家汤姆生发现电 子,认为原子的模型 为西瓜型,原子是一 个平均分布着正电荷 的粒子,其中镶嵌着 许多电子,中和了正 电荷,从而形成了中 性原子
练习:下列五种微粒中易失去电子的是A、D,易得到 电子的是 E , 达到稳定结构是 B、C .
A
B
C
D
E
根据下列结构示意图判断
A
B
C
D
E
F
其中属于稀有气体的是_D__F_____属于金属元素 的是_B__C___,属于非金属元素的是__A__E___
2、少数带正电的α粒子发生方向上 的偏转;(说明原子核带正电, α 粒子途经原子核附近时,受到斥力 改变了运动方向)
3、极少数带正电的α粒子被反弹。(说明金原子 核质量比α粒子大得多, α粒子正好碰到金原子核 被弹了回来)
一、原子的构成
质子(带正电) 每个质子带一个
原子核
单位正电荷
(带正电)
原子
中子(不带电)
⑶ 第二层上最多排8个电子;
⑷ 最外层上最多排8个电子.
原子结构示意图的涵义
原子核 电子层 在该电子层上 运动的电子数 最外层电子数
核电荷数
稀有气体元素的原子结构示意图
+2 2 +10 2 8
氦He
氖Ne
+18 2 8 8
《原子的结构》(第一课时)教学课件
3.科学家将铅和氪的原子核对撞,获得了一种质子数为118、中
子数为175的超重原子。则该原子的核内中子数与核外电子数之
差是(A )
原子并不是构成物质的最小微粒
——汤姆生发现了电子(1897年)
•电子是种带负电、有一定 质量的微粒,普遍存在于 各种原子之中。 •汤姆生原子模型:原子是 一个平均分布着正电荷的 粒子,其中镶嵌着许多电 子,中和了电荷,从而形 成了中性原子。
英国物理学家汤姆生 (J.J.Thomson ,1856~1940)
知识讲解
道尔顿原子模型 1803年
汤姆生原子模型 1904年
卢瑟福原子模型 1911年
玻尔原子模型 1913年
电子云模型
1927-1935年
近代科学原子论(1803年) •一切物质都是由最小的 不能再分的粒子——原子 构成。 •原子模型:原子是坚实 的、不可再分的实心球。
英国化学家道尔顿 (J.Dalton , 1766~1844)
α粒子散射实验(1909年) ——原子有核
•卢瑟福和他的助手做了著名α粒子 散射实验。根据实验,卢瑟福在 1911年提出原子有核模型。 •卢瑟福原子模型(又称行星原子 模型):原子是由居于原子中心的 带正电的原子核和核外带负电的电 子构成。原子核的质量几乎等于原 子的全部质量,电子在原子核外空 间绕核做高速运动。
中子
原子
位正电荷,________不带电,所以整个________不显电性。
课堂练习1 核电荷数(Z)=质子数 = 核外电子数
原子种类 质子数 中子数 电子数
H
101
C
666
分子种类
H2 H2O
质子数 中子数 电子数
2
0
1.1第1课时 原子结构——原子核 核素课件高一下学期鲁科版化学必修第二册

32
(3)确定磷在植物中的作用部位: 15 P。
【微思考1】是不是所有原子都是由质子、中子和电子构成的?
1
提示 不是。如氕( 1H)原子核内无中子。
【微思考2】对于分子或离子来说,质子数与核外电子数一定相等吗?
提示 不一定。分子的质子数=核外电子数,但是对于离子来说质子数一定
不等于核外电子数。
【微思考3】质子数相同的微粒一定属于同一种元素吗?
(1)上述所给微粒中元素种类有多少种?
提示 有氢、氧两种元素。
(2)上述所给微粒中核素种类有多少种?
提示 一种原子就是一种核素,故有六种核素。
(3)上述所给微粒中哪些互为同位素?
提示 三种氢元素的核素互为同位素,三种氧元素的核素互为同位素。
(4)这些原子可以构成的水分子有多少种?
1
2
3
提示 1 H、1 H、1 H 三种原子可以形成六种组合,分别为:
(3)元素的相对原子质量是各种核素的相对原子质量分别与各种核素在自
然界里丰度的乘积的加和。
变式训练1-1(2021北京昌平区高一期末)稀土被称为“工业黄金”和“新材料
之母”,稀土资源在我国有丰富的储量。其中钇(Y)是重稀土元素的代表。
89
下列关于 39 Y 的说法不正确的是( C )
A.质子数为39
量有七种情况。
【深化拓展】
元素、核素、同位素的比较
概念 元素
核素
具有相同数目的质
质子数相同的同
定义
子和相同数目的中
一类原子
子的一类原子
范围 游离态或化合态 原子
只有种类,没有 化学反应中的最小
特性
个数
微粒
决定
质子数
(3)确定磷在植物中的作用部位: 15 P。
【微思考1】是不是所有原子都是由质子、中子和电子构成的?
1
提示 不是。如氕( 1H)原子核内无中子。
【微思考2】对于分子或离子来说,质子数与核外电子数一定相等吗?
提示 不一定。分子的质子数=核外电子数,但是对于离子来说质子数一定
不等于核外电子数。
【微思考3】质子数相同的微粒一定属于同一种元素吗?
(1)上述所给微粒中元素种类有多少种?
提示 有氢、氧两种元素。
(2)上述所给微粒中核素种类有多少种?
提示 一种原子就是一种核素,故有六种核素。
(3)上述所给微粒中哪些互为同位素?
提示 三种氢元素的核素互为同位素,三种氧元素的核素互为同位素。
(4)这些原子可以构成的水分子有多少种?
1
2
3
提示 1 H、1 H、1 H 三种原子可以形成六种组合,分别为:
(3)元素的相对原子质量是各种核素的相对原子质量分别与各种核素在自
然界里丰度的乘积的加和。
变式训练1-1(2021北京昌平区高一期末)稀土被称为“工业黄金”和“新材料
之母”,稀土资源在我国有丰富的储量。其中钇(Y)是重稀土元素的代表。
89
下列关于 39 Y 的说法不正确的是( C )
A.质子数为39
量有七种情况。
【深化拓展】
元素、核素、同位素的比较
概念 元素
核素
具有相同数目的质
质子数相同的同
定义
子和相同数目的中
一类原子
子的一类原子
范围 游离态或化合态 原子
只有种类,没有 化学反应中的最小
特性
个数
微粒
决定
质子数
人教版高中化学选修三1.1《原子结构》课件 (共106张PPT)

电子排布式
电子排布图
小结:
方法导引
解答基态原子电子排布问题的一般思路:
能量最低原则
确定原子序数 泡利不相容原理 洪特规则
能级排布
电子排布
巩固练习
1、某元素原子序数为24,试问:
(1)该元素电子排布式: 1s2 2s22p6 3s23p63d5 4s1
(2)它有 4 个能层; 7 个能级;占有 15 个原子轨道。 (3)此元素有 6 个未成对电子;它的价电子 数是 6 。
洪特规则
对于基态原子,电子在能量相同 的轨道上排布时,将尽可能分占不同 的轨道并且自旋方向相同。
C :1s2 2s22p2
√
科学研究
C
N
O
1.每个原子轨道上最多能容纳____ 2 个电子, 且自旋方向_______ 不同 ——泡利原理 2.当电子排在同一能级时有什么规律? 当电子排布在同一能级的不同轨道时, 首先单独占一个轨道,而且自旋 总是___________________ 相同 ——洪特规则 方向______
铁Fe: 1s22s22p63s23p63d64s2 钴Co:
;
; ; ;
1s22s22p63s23p63d74s2
镍Ni: 1s22s22p63s23p63d84s2
练习:请写出第四周期21—36号元素原子 的基态电子排布式。
铜Cu:1s22s22p63s23p63d104s1 锌Zn:1s22s22p63s23p63d104s2 ; ;
钠 Na
铝 Al
原子结构示意图
电子排布式
Li: 1s22s1
练一练
请写出4~10号元素原子的电子排布式。
4
铍Be
1s2 2s2
第一章原子的结构与键合ppt课件

(1)共价键的定义 ➢ 有些同类原子,例如周期表IVA,VA,VIA族中大多数元
素或电负性相差不大的原子互相接近时,原子之间不产生 电子的转移,此时借共用电子对所产生的力结合。
(2)共价键的特点 ➢ 共价键键合的基本特点是核外电子云达到最大的重叠,形
成“共用电子对”,有确定的方位,且配位数较小。
由于金属键即无饱和性又无方向 性,因而每个原子有可能同更多 的原子结合,并趋于形成低能量 的密堆结构,当金属受力变形而 改变原子之间的相互位置时不至 于破坏金属键,这就使金属具有 良好的延展性。
金属变形时,由金属键结 合的原子可变换相对位置
(3)金属键型晶体的特征 良好的导电、导热性:
自由电子定向运动(在电场作用下)导电、(在热场作 用下)导热。
金属键模型
电子气 金属离子
图 金属键与金属晶体
© 2003 Brooks/Cole Publishing / Thomson Learning™
图 金属键与金属晶体
图 金属键、金属的导电性和金属的变形
问题1:金属具有良好导电、导热性能的原因? (自由电子的存在)
问题2:金属具有良好延展性的原因?
Pauli不相容原理(Pauli principle) 在一个原子中,不可能存在四个量子数 完全相同的两个电子。
Hund规则(Hund ’s rule) 在同一亚层中的各个能级中, 电子的排布尽可能分占不同 的能级,而且自旋方向相同
IA
1 H IIA 2 Li Be
碱金属
碱土金属 过渡元素
主族金属
第一节 原子结构
1.1.1 物质的组成
一切物质都是由无数微粒按一定 的方式聚集而成的。这些微粒可能 是分子、原子或离子。
第一节 原子结构(第一课时)

2.某二价阳离子含有10个电子,12个中子,求质量数。 3.元素R的一个原子,质量数为 a ,其阴离子R 有 b个电子,求中子数。
n37
பைடு நூலகம்
2、核素 思考: 1、元素的种类是由什么决定的? 2、同种元素的原子中的中子数也相同吗? 交流:
三种不同的氢原子
核素: 具有一定数目质子和一定数目中子 的一种原子 如:氢元素的三种核素 氕
A
14 N、14 C 7 6
),属于
B
40
Ar、4020Ca 18
35 Cl、37 Cl 17 17
C O2、O3
D
E、Fe、Fe2+、Fe3+ 5、3919K的中子数为 。 6、某元素原子的质量数为A,它的离子Xn+的 和外有y个电子,Wg这种种元素的原子核内的 中子数为 。
试一试
1. 下列各组物质中,互为同位素的是( D )
第一章 第一节 原子结构
第一讲 原子结构
help!
两千多年以来,科学家 一直在思考一个问题:如果 把一个物体一直分割下去, 将会怎样?能不能找到一种 组成物质的最基本粒子?
原子结构模型的演变
公元前5世纪,希腊哲学家 德谟克利特等人认为 :万物 是由大量的不可分割的微粒 构成的,即原子。
1897年,英国科学家汤姆生发现了电子。
“葡萄干布丁”模型
卢瑟福α粒子散射实验
ks5u精品课件
第一节 原子结构
交流与质疑: 1、构成物质的基本微粒有哪些? 2、三种微粒的组成和结构如何? 3、物质的性质与哪种微粒的结构有密切 的关系? 4、原子的结构如何?
一
原子核 核素
1.原子的构成
阅读P3 交流·研讨
名词解释:相对质量 相对原子质量= 一个原子的质量
n37
பைடு நூலகம்
2、核素 思考: 1、元素的种类是由什么决定的? 2、同种元素的原子中的中子数也相同吗? 交流:
三种不同的氢原子
核素: 具有一定数目质子和一定数目中子 的一种原子 如:氢元素的三种核素 氕
A
14 N、14 C 7 6
),属于
B
40
Ar、4020Ca 18
35 Cl、37 Cl 17 17
C O2、O3
D
E、Fe、Fe2+、Fe3+ 5、3919K的中子数为 。 6、某元素原子的质量数为A,它的离子Xn+的 和外有y个电子,Wg这种种元素的原子核内的 中子数为 。
试一试
1. 下列各组物质中,互为同位素的是( D )
第一章 第一节 原子结构
第一讲 原子结构
help!
两千多年以来,科学家 一直在思考一个问题:如果 把一个物体一直分割下去, 将会怎样?能不能找到一种 组成物质的最基本粒子?
原子结构模型的演变
公元前5世纪,希腊哲学家 德谟克利特等人认为 :万物 是由大量的不可分割的微粒 构成的,即原子。
1897年,英国科学家汤姆生发现了电子。
“葡萄干布丁”模型
卢瑟福α粒子散射实验
ks5u精品课件
第一节 原子结构
交流与质疑: 1、构成物质的基本微粒有哪些? 2、三种微粒的组成和结构如何? 3、物质的性质与哪种微粒的结构有密切 的关系? 4、原子的结构如何?
一
原子核 核素
1.原子的构成
阅读P3 交流·研讨
名词解释:相对质量 相对原子质量= 一个原子的质量
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第1课时)精品PPT课件

17
开天辟地—原子的诞生
质子(正电) 原子核 原子 (正电) 中子(不带电) 不显 电性 核外电子 分层排布 (负电) 与物质化学性质密切相关
2020/10/26
18
能层与能级
二、能层与能级
(1)能层
在多电子的原子核外电子的能量是不同的, 按电子的能量差异,可以将核外电子分成不 同的能层。
2020/10/26
开天辟地—原子的诞生
问题:宇宙大爆炸是怎么回事?物质是由原子构成的,那 么原子是怎样诞生的呢? P4
1932年勒梅特首次提出了现代大爆炸宇宙理论
宇宙大爆炸
2h后 诞生
大量的氢 大量的氦 极少量的锂
原子核的 熔合反应
合成
其他元素
2020/10/26
4
开天辟地—原子的诞生
一、开天辟地—原子的诞生
思考与交流 阅读课本P4
2020/10/26
5
开天辟地—原子的诞生
人类认识原子的过程
人类在认识自然的过 程中,经历了无数的艰 辛,正是因为有了无数 的探索者,才使人类对 事物的认识一步步地走 向深入,也越来越接近 事物的本质。随着现代 科学技术的发展,我们 现在所学习的科学理论, 还会随着人类对客观事 物的认识而不断地深入 和发展。
19
能层与能级
核外电子分层排布
依据核外电子的能量不同:
离核远近:近
远
能量高低:低
高
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
2020/10/26
20
能层与能级
原子核外电子分层排布规律:
(1)各能层最多能容纳2n2个电子。
开天辟地—原子的诞生
质子(正电) 原子核 原子 (正电) 中子(不带电) 不显 电性 核外电子 分层排布 (负电) 与物质化学性质密切相关
2020/10/26
18
能层与能级
二、能层与能级
(1)能层
在多电子的原子核外电子的能量是不同的, 按电子的能量差异,可以将核外电子分成不 同的能层。
2020/10/26
开天辟地—原子的诞生
问题:宇宙大爆炸是怎么回事?物质是由原子构成的,那 么原子是怎样诞生的呢? P4
1932年勒梅特首次提出了现代大爆炸宇宙理论
宇宙大爆炸
2h后 诞生
大量的氢 大量的氦 极少量的锂
原子核的 熔合反应
合成
其他元素
2020/10/26
4
开天辟地—原子的诞生
一、开天辟地—原子的诞生
思考与交流 阅读课本P4
2020/10/26
5
开天辟地—原子的诞生
人类认识原子的过程
人类在认识自然的过 程中,经历了无数的艰 辛,正是因为有了无数 的探索者,才使人类对 事物的认识一步步地走 向深入,也越来越接近 事物的本质。随着现代 科学技术的发展,我们 现在所学习的科学理论, 还会随着人类对客观事 物的认识而不断地深入 和发展。
19
能层与能级
核外电子分层排布
依据核外电子的能量不同:
离核远近:近
远
能量高低:低
高
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
2020/10/26
20
能层与能级
原子核外电子分层排布规律:
(1)各能层最多能容纳2n2个电子。
(鲁科版)高中化学必修二:1.1原子结构【第一课时+第二课时】课件
化学 必修2
第1章 原子结构与元素周期律
自主预习区 互动探究区 巩固训练区 课时作业
已知R2+离子核外有a个电子,它含有b个中子。 表示R原子符号正确的是( )
解析:
R2+的电子数为a―→R原子的质子数为a+
N=b 2――→A(R)=a+2+b。
答案: C
化学 必修2
第1章 原子结构与元素周期律
自主预习区 互动探究区 巩固训练区 课时作业
二、核素
[填一填]
1.元素 质子数(或核电荷数) 的同一类原子 (1)定义:具有相同______________________
的总称。
原子核内的质子数 。 (2)决定元素种类的微粒:_____________________ 2.核素 质子 和一定数目______ 中子 的一种原 (1)定义:具有一定数目_____ 子。
1 1H 2 1H 3 1H
名称 俗称 符号
氕 ____
氘 ____ 重氢 ______
氚 ____ 超重氢 ________ T ____
H ____
D ___
化学 必修2
第1章 原子结构与元素周期律
自主预习区 互动探究区 巩固训练区 课时作业
4.几种重要的核素 (1)作为相对原子质量和阿伏加德罗常数测定用的标准原
12 14 6C ;考古中常测量______ 子为______ 6C 的数量来推断生物体的存
在年代。
2 3 H 1 1H 。 (2)制造氢弹的原料为_____、_____
235 92 U (3)原子弹、核反应堆的燃料:_____
自主预习区 互动探究区 巩固训练区 课时作业
自主预习区 互动探究区 巩固训练区 课时作业
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“葡萄干布丁”模型 葡萄干布丁” 葡萄干布丁
卢瑟福α粒子散射实验 卢瑟福
一
原子核 核素
1.原子的构成 原子的构成
阅读P3 交流 研讨 交流·研讨 阅读
构成原子的微粒--------电子、质子和中子的基本数据:
微粒 质量(kg) 相对质量 电量(C) 电荷 电子 9.109×10-31 0.005484 1.602×10-19 -1 质子 1.673×10-27 1.007 1.602×10-19 +1 中子 1.675×10-27 1.008 0 0
同位素、元素、 同位素、元素、同素异形体的比较
元素 定义对象 广义的原子 定义 具有相同核电荷 数的同一类 一类原子 数的同一类原子 的总称 H C 同位素 原子 质子数相同, 质子数相同,中子 数不同的同一元素 的不同原子
1 2 3 1H 、 1H 、 1H
同素异形体 单质 由同种元素组成的 结构和性质不同的 单质 金刚石与石墨 氧气与臭氧
中子数= A - Z 中子数
【迁移与应用】 迁移与应用】 1.在科学研究中,人们常用3717Cl符号表示 在科学研究中, 符号表示 在科学研究中 某种原子,请你谈谈图中符号和数字的含义。 某种原子,请你谈谈图中符号和数字的含义。
2.某二价阳离子含有 个电子 个中子 求质量数。 某二价阳离子含有10个电子 个中子,求质量数 某二价阳离子含有 个电子,12个中子 求质量数。 3.元素 的一个原子,质量数为 a ,其阴离子 元素R的一个原子 其阴离子Rn-有 元素 的一个原子, 有 b个电子,求中子数。 个电子, 个电子 求中子数。
在 ① 36Li ② 714N ③ 1123Na ④ 1224Mg ⑤ 37Li ⑥ 614C,几种核素中 , 1)( )和( )互为同位素 ( 2) ( )和( )质量数相等,但不能互 质量数相等, 称同位素 3) ( )和( )中子数相等,但质子数 中子数相等, 不等, 不等,所以非同一种元素
三种不同的氢原子
2、核素 、
(思考) 思考)
2 1 3 是同一种元素吗? 、 、 是同一种元素吗 1H、1H、1H是同一种元素吗
元素:具有相同质子数(核电荷数) 元素:具有相同质子数(核电荷数)的同一 类原子的总称。 类原子的总称。 元素种类由质子数决定的 核素: 具有一定数目质子和一定数目中子 的一种原子。 的一种原子。
第一章
第一节 原子结构(1)
沾化一中: 沾化一中:孔令杰
help!
两千多年以来, 两千多年以来,科学家 一直在思考一个问题: 一直在思考一个问题:如果 把一个物体一直分割下去, 把一个物体一直分割下去, 将会怎样? 将会怎样?能不能找到一种 组成物质的最基本粒子? 组成物质的最基本粒子?
原子结构模型的演变
关系: 关系:
1、核电荷数=质子数=核外电子数 核电荷数=质子数= =原子序数 原子质量主要在原子核上, 2、原子质量主要在原子核上,由质子和中 子的质量决定 3、原子的近似相对质量在数值上 质子数+ =质子数数(Z) + 中子数(N) ═ 质量数(A) 中子数(N) 质量数(A)
同位素:质子数相同而 同位素:质子数相同而中子数不同 同一元素的不同核素互为同位 的不同核素互为 的同一元素的不同核素互为同位 素。
如:碳 12C 13C 14C 氯 35Cl 37Cl 铀 234U 235U 238U
同位素的特点 同位素的特点
1、同种元素的各种同位素化学性质几乎完全 相同,物理 、 相同, 性质有差异。 性质有差异。 2、在天然存在的某种元素里,不论是游离态 还是化合态, 、在天然存在的某种元素里, 还是化合态, 各种同位素的原子个数百分比(丰度 一般为定值。 丰度)一般为定值 各种同位素的原子个数百分比 丰度 一般为定值。 3、同种元素的不同的同位素原子也可组成不同的单质或化 、 合物的分子。 合物的分子。 如单质: 如单质:H2、O2、T2、H-D、H-T、D-T、 D2、T2 、 、 、 化合物: 化合物:H2O、D2O、T2O、HDO、DTO 、 、 、 、
实例
区别与联系: 区别与联系: 联系:同位素属于同一元素的原子; 1、联系:同位素属于同一元素的原子; 同素异形体由同一元素的原子构成。 同素异形体由同一元素的原子构成。 区别: 余种, 多种。 2、区别:同位素有1800余种,元素只有100多种。
试一试
1. 下列各组物质中,互为同位素的是( D . 下列各组物质中,互为同位素的是( ) (A)O2、、O3 、O4 ) 、 2.下列说法正确的是( .下列说法正确的是( (B)H2、D2、T2 )
40 42
(C)H2O、D2O、 T2O (D) 20Ca 和20 Ca ) 、 、 )
A)
(A)同种元素的质子数必定相同 ) (B)不同元素原子的质量数必定不同 ) (C)原子核都是由质子和中子构成的 ) (D)凡是核外电子数相同的微粒必定属于同一 ) 元素
公元前5世纪,希腊哲学家 德谟克利特等人认为 :万物 是由大量的不可分割的微粒 构成的,即原子。
19世纪初,英国科学家道尔顿提出原 19世纪初,英国科学家道尔顿提出原 世纪初 道尔顿 子学说, 子学说,他认为原子是微小的不可分 割的实心球体。 割的实心球体。
1897年,英国科学家汤姆生发现了电子。 1897年 英国科学家汤姆生发现了电子。 汤姆生发现了电子
