氨的物理化学性质
新版高中化学讲义:氨
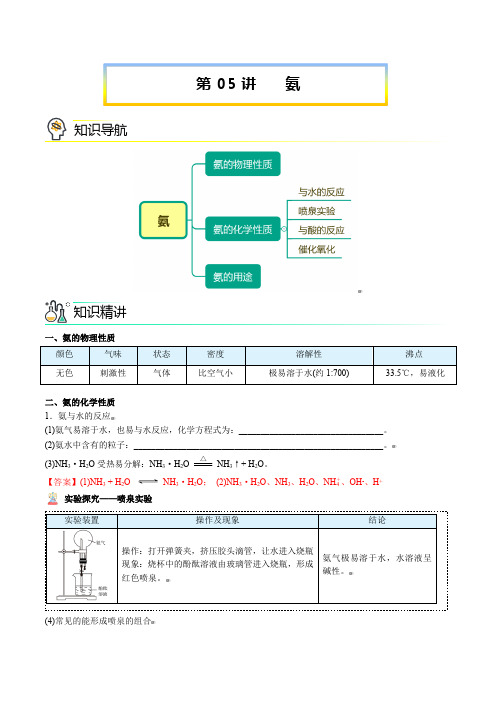
一、氨的物理性质 颜色 气味 状态 密度 溶解性沸点 无色 刺激性气体比空气小极易溶于水(约1:700)-33.5℃,易液化二、氨的化学性质 1.氨与水的反应(1)氨气易溶于水,也易与水反应,化学方程式为:_________________________________。
(2)氨水中含有的粒子:_________________________________________________________。
(3)NH 3·H 2O 受热易分解:NH 3·H 2O NH 3↑+ H 2O 。
【答案】(1)NH 3 + H 2ONH 3·H 2O ; (2)NH 3·H 2O 、NH 3、H 2O 、NH +4、OH -、H +实验探究——喷泉实验 (4)常见的能形成喷泉的组合△第05讲 氨知识导航知识精讲实验装置操作及现象结论操作:打开弹簧夹,,挤压胶头滴管,让水进入烧瓶 现象:烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
氨气极易溶于水,水溶液呈碱性。
气体 HCl NH 3 CO 2、Cl 2、H 2S 、SO 2NO 2 溶液 水或碱水或酸碱水或碱实验探究——NH 3与HCl 反应【答案】产生大量白烟2.氨与酸的反应氨几乎能与所有的酸(难溶性酸如H 2SiO 3除外)反应生成盐,如:NH 3 + HCl === NH 4Cl NH 3 + HNO 3 === NH 4NO 3 2NH 3 + H 2SO 4 === (NH 4)2SO 43.氨的催化氧化化学方程式:________________________________________。
【答案】4NH 3 + 5O 2 =======催化剂△4NO + 6H 2O 思考与交流:如何检验氨气?【答案】①将湿润的红色石蕊试纸靠近,试纸变蓝;②用蘸有浓盐酸的玻璃棒靠近,有白烟产生。
三、氨的用途1.氨易液化,当液氨汽化时要吸收大量的热,使周围温度急剧降低,因此液氨常用作__________。
氨的物理化学性质

氨的物理化学性质氨(NH3)是一种无色气体,具有特殊的物理化学性质。
在这篇文章中,我们将探讨氨的物理化学性质,包括氨的熔点、沸点、溶解性、酸碱性以及重要的应用领域。
熔点和沸点氨的熔点为-77.7摄氏度,沸点为-33.3摄氏度。
这意味着在常温下,氨呈气态存在。
当氨被冷却至低于熔点时,它会转变为液态。
随着温度的降低,氨会继续凝固成固体状态。
而当氨被加热至高于沸点时,它会迅速蒸发成气态。
溶解性氨具有很高的溶解度。
它可以溶解在水中,形成氨水。
氨的溶解度随着温度的升高而增加,这意味着在高温下,溶解氨的能力更强。
溶解氨水可以产生一种碱性溶液,这种溶液常常用于实验室和工业应用中。
酸碱性尽管氨经常被称为氨水,但它实际上是一种碱性物质。
它具有强碱性,可以中和酸性物质。
氨在水中形成氢氧化铵(NH4OH),这是一种弱碱。
当氨与酸反应时,它可以接受酸中的氢离子,并形成相应的盐。
重要应用领域氨在工业及其他领域中有着广泛的应用。
以下是一些重要的应用领域:1. 化肥生产:氨是制造氮肥的重要原料。
它可以与二氧化碳反应形成尿素,成为一种重要的氮肥源。
2. 清洁剂和溶剂:氨水作为一种清洁剂和溶剂被广泛用于家庭和工业场所。
它可以去除油脂和污渍,并具有杀菌作用。
3. 制冷剂:氨被广泛用作制冷剂,尤其在大型冷库和工业冷却系统中。
由于其高热传导性和低环境影响,氨被认为是一种环保的制冷剂。
4. 医药和生物化学研究:氨在医药和生物化学研究中具有重要的应用。
它可以用作药物的催化剂和中间体,并用于DNA和RNA的萃取和纯化过程中。
总结氨是一种重要的化学物质,具有特殊的物理化学性质。
它具有较低的熔点和沸点,高溶解度以及强碱性。
氨在化肥生产、清洁剂和溶剂、制冷剂以及医药和生物化学研究中都有着重要的应用。
通过深入了解氨的物理化学性质,我们可以更好地理解和应用这种重要的化学物质。
氨的知识

氨轻度中毒的症状
• 出现流泪、咽痛、声音嘶哑、咳嗽、咯 痰等;眼结膜、鼻粘膜、咽部充血、水 肿;胸部X线征象符合支气管炎或支气管 周围炎。
氨中度中毒的症状
• 上述轻度中毒的症状加剧,出现呼吸困 难、紫绀;胸部X线征象符合肺炎或间质 性肺炎。
氨严重中毒的症状
• 发生中毒性肺水肿,或有呼吸窘迫综合 征,患者剧烈咳嗽、咯大量粉红色泡沫 痰、呼吸窘迫、谵妄、昏迷、休克等。 可发生喉头水肿或支气管粘膜坏死脱落 窒息。高浓度氨可引起反射性呼吸停止。 液氨或高浓度氨可致眼灼伤;液氨可致 皮肤灼伤。
氨的化学性质
• 氨的分子式:NH3,氨分子的空间结构是 三角锥形,三个氢原子处于锥底,氮原 子处在锥顶。每两个N—H键之间夹角为 107°18’,因此,氨分子属于极性分子 。
氨的化学性质
• 跟水(NH3•H2O), 一水合氨能小部分电离成铵离子和氢氧 根离子,所以氨水显弱碱性,能使酚酞 溶液变红色。
氨的泄漏事故案例
• 2006年11月1日7时50分,湖北省大悟县 城南端的黄麦岭磷化工(集团)公司氮 肥厂发生液氨泄漏事故,造成1人死亡, 6人受伤,城区2万居民紧急疏散。泄漏 原因是液氨输送管突然破裂,漏氨量约 10吨。
氨的泄漏事故案例
• 2009年6月5日晚8时55分,河池化工集团公司 发生氨气泄漏事故,致三名工人死伤,其中一 人死亡,一人重伤,一人轻伤。事故发生于该 公司的合成车间,当天该车间供气管道发生故 障,工人们在维修过程中,一条供气管道突然 破裂,氨气喷射而出,正在操作的那名男工瞬 间吸入大量氨气,摇摇晃晃走出几米后倒地昏 死过去。在他身旁协助操作的两名男工亦受伤。 他们身后的女工因距离破裂的管道稍远,且反 应敏捷逃生及时,所以没有受伤。
氨气
(2)增大容器内压强(如下面例 2 中乙图) 容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精 等)或由于发生化学反应,容器内产生大量气体,使容器内 压强迅速增大,促使容器内液体迅速向外流动,也能形成 喷泉。例如喷雾器、人造喷泉等均是利用了此原理。
第四章 第 5 讲
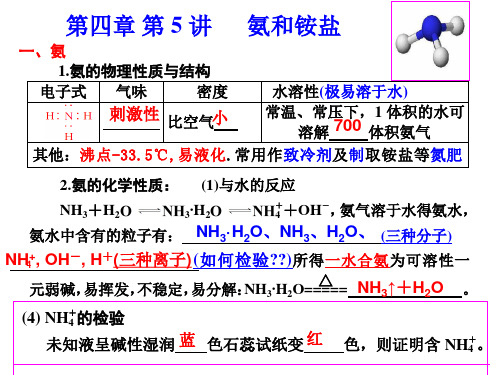
一、氨 1.氨的物理性质与结构 电子式 气味 密度
氨和铵盐
水溶性(极易溶于水) 常温、常压下,1 体积的水可 刺激性 比空气小 溶解 700 体积氨气 其他:沸点-33.5℃,易液化.常用作致冷剂及制取铵盐等氮肥
2.氨的化学性质: (1)与水的反应
+ NH3+H2O NH· 2O NH +OH-, H 氨气溶于水得氨水, 3 4
+ 色,则证明含 NH4 。
(2)氨气与酸反应 ①蘸 有 浓盐 酸的 玻 璃棒 与 蘸有 浓 氨 水的 玻 璃棒 靠 近, 其现象 为 有白烟生成 , 将浓盐酸改为 浓硝酸 , 也会出现相同的现象。 化学方程式为:HCl+NH3==NH4Cl; NH3+HNO3==NH4NO3
②与 CO2 等酸性氧化物反应:NH3+CO2+H2O==NH4HCO3 或 2NH3+CO2+H2O===(NH4)2CO3。 意义何在??
①在图乙的锥形瓶中,分别加入足量的下列物 质,反应后可能产生喷泉的是 ( A.Cu 与稀盐酸 C.CaCO3 与稀硫酸 ) B.NaHCO3 与 NaOH 溶液 D.NH4HCO3 与稀盐酸
这种方法产生喷泉的原理是______________。
②在图乙锥形瓶外放一水槽,瓶中加入酒精,水槽中加 入水后,再加入足量的下列物质,结果也产生喷泉。水槽中 加入的物质可以是 ( A.浓硫酸 B.食盐 ) C.硝酸钾 D.硫酸铜
氨气资料

一、氨的分子结构氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。
氨分子的空间结构是三角锥形,三个氢原子处于锥底,氮原子处在锥顶。
每两个N—H键之间夹角为107°18’,因此,氨分子属于极性分子。
H H.. |电子式: H:N:H 结构式: H-N-H..二、氨的性质化学式NH31、物理性质相对分子质量17.031氨气在标准状况下的密度为0.7081g/L氨气极易溶于水,溶解度1:7002、化学性质(1)跟水反应氨溶于水时,氨分子跟水分子通过*氢键结合成一水合氨(NH3•H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。
氨在水中的反应可表示为:一水合氨不稳定受热分解生成氨和水氨水中存在三分子、三离子、三平衡分子:NH3、NH3•H2O、H2O;离子:NH4+、OH-、H+;三平衡:NH3+H2O NH3•H2O NH4++OH-H2O H++OH-氨水在中学化学实验中三应用①用蘸有浓氨水的玻璃棒检验HCl等气体的存在;②实验室用它与铝盐溶液反应制氢氧化铝;③配制银氨溶液检验有机物分子中醛基的存在。
(2)跟酸反应2NH3+H2SO4===(NH4)2SO43NH3+H3PO4===(NH4)3PO4NH3+CO2+H2O===NH4HCO3(反应实质是氨分子中氮原子的孤对电子跟溶液里具有空轨道的氢离子通过配位键而结合成离子晶体。
若在水溶液中反应,离子方程式为:8NH3+3Cl2===N2+6NH4Cl(黄绿色褪去,产生白烟)反应实质:2NH3+3Cl2===N2+6HClNH3+HCl===NH4Cl总反应式:8NH3+3Cl2===N2+6NH4Cl三、氨的制法1.工业制法:工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成:工业上制氨气高温高压N2(g)+3H2(g)========2NH3(g)(可逆反应)催化剂△rHθ =-92.4kJ/mol2. 实验室制备:实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备:△2NH4Cl + Ca(OH)2===2NH3↑+ CaCl2 + 2H2O↑Li3N + 3H2O === LiOH + N H3↑四、铵盐铵盐是氨与酸作用得到铵盐,铵盐是由铵离子(NH4+)和酸根离子组成的化合物。
氨气化学知识点总结

氨气化学知识点总结一、氨气的化学性质1.氨气的物理性质氨气是一种无色、有刺激性气味的气体,比空气轻,密度约为0.589g/L。
它在常温下是一种弱碱性气体,可以与水反应生成氢氧化铵(NH4OH),而且溶解度很大(1mol/L NH3)2.氨气的化学性质氨气是一种具有还原性和碱性的化合物,它可以与许多化合物发生反应,如与酸、酮、酯、酰氯烷基醚、对二醇、水蒸气、氰化物、羧酸、羧酸酯、醛、乙二醇酯等一系列有机物均发生反应。
氨气还能和酸根形成易溶的氨盐,在与银盐溶于氨水时鉴银。
与氧和氯气在较高温度条件下反应,生成一氧化氮N2O和氮氧化氮NO。
与氟在高温可以反应,生成NF3。
另外由于氮原子的价电子结构较稳定,所以,氨气与点火时的灯芯和气体电电话开关电弧可以进行顺热氧化反应,生成一定量的氮氧化物。
另外由于其具有碱性也可以与各种硫酸、盐酸等强酸都能缓和。
3.氨气的还原性氨气是一种强还原剂,它能够与一些金属和非金属氧化物反应,发生还原反应,如与二氧化铜反应生成氨合成铜,还原CuO为Cu2O。
对于部分氧化物,氨能够表现出复杂的还原性,如与氧氮化物反应可以燃烧成N2和H2O等。
4.氨气的碱性氨气是一种碱性气体,它能够与酸性物质反应生成盐和水,如与盐酸反应生成氯化铵和水,与硫酸反应生成硫酸铵和水,与硝酸反应生成硝酸铵和水。
氨气还能够与一些酸性离子生成相应的氨盐,如与氨基甲酸反应生成氨基甲酸铵。
此外,氨气可以将其自由电子提供给其他化合物,从而表现出一定的还原性。
二、氨气的制备方法1.哈柴氨法哈柴氨法是一种通过焦炭和氮气在高温高压条件下反应合成氨气的方法。
该方法是由德国化学家哈柴于1903年首先提出,后经过不断改进,成为了目前最重要的工业制氨方法之一。
哈柴氨法的反应条件为400-500℃、200-1000atm,使用的催化剂一般为Fe3O4,K2O和Ca3(PO4)2等。
2.王水法王水法是一种利用王水(HNO3+HCl)氧化还原反应合成氨气的方法。
氨的安全使用与管理

氨的安全使用与管理氨 (NH3) 是一种常见的化学物质,可用于合成化学品、肥料和清洁剂等。
但氨气有强烈的刺激性和腐蚀性,因此使用和管理氨的安全性十分重要。
本文将介绍一些氨的安全使用与管理的基本知识。
氨的物理和化学性质氨是一种具有刺激性和腐蚀性的无色气体,常温常压下为气态。
氨是弱碱性物质,和酸发生反应可形成盐类。
氨在空气中易挥发,它的液态密度为0.681 g/cm³,即比空气重,所以比空气下沉。
氨的主要危害氨气有很强的刺激性和腐蚀性,对人体、动物和植物都有危害。
以下是氨气的主要危害:1.刺激眼睛和呼吸道:氨气具有刺激性,进入眼睛和呼吸道时,会导致眼部疼痛、流泪、咳嗽、呼吸困难等症状。
2.皮肤腐蚀:接触氨气可以引起皮肤腐蚀,出现红肿、疼痛、烧灼感等症状。
3.爆炸和火灾:在氧气充足的情况下,氨气可以形成爆炸性混合物,火源会导致爆炸和火灾。
氨的安全使用和管理氨气是一种危险的化学品,因此在使用和管理氨气时应格外小心。
以下是一些氨的安全使用和管理的建议:1.安全存储氨气应存储在密封和通风良好的区域内,并分类存储。
在存储氨气时应避免和易燃、易爆和有毒物品混存。
2. 强化培训所有接触氨气的员工都应该接受严格的培训,了解氨气的危害和安全管理措施。
员工必须知道如何正确穿戴个人防护设备,如呼吸器、手套,以及如何处理气体泄漏等紧急情况。
3.监测气体浓度在使用氨气时,应该安装气体浓度监测设备,及时监测氨气的浓度。
如发现氨气浓度超过底线或警戒线,应立即采取相应的措施,如通风换气等。
4. 合理操作在使用氨气时,应遵循操作规程,避免将氨气接触到肌肤或眼睛,以及不要吸入氨气。
在氨气的倒装、转移和传输过程中,应严格遵守安全规程。
5.紧急处理如发生氨气泄漏,应迅速停止所有操作,并采取相应的应急措施,包括通风换气、穿上个人防护设备、用稀释剂稀释泄漏物等。
氨的安全使用和管理十分重要。
必须遵守氨气的安全使用规程,培训员工,及时监测气体浓度,并采取紧急处理措施,以确保工作场所的安全。
氨性质总结

氨性质总结一、物理性质1. 外观与气味氨(NH3)是一种无色气体,散发着刺激性的刺鼻气味。
在常温常压下,氨呈现为无色透明的气体。
2. 氨的溶解性氨具有较高的水溶解度。
在常温常压下,约有700倍的氨气能够溶解于水中,形成氨水。
氨水呈碱性,可以与酸反应。
3. 沸点和熔点氨的沸点为-33.34°C,熔点为-77.73°C。
由于氨是无色气体,所以其存在于液态或固态时并不直观。
4. 密度氨的密度比空气小,大约为0.73 g/L。
这也是为什么氨气会上升的原因。
二、化学性质1. 稳定性氨是一种相对不稳定的物质,在高温或高压下容易分解。
此外,氨容易发生自燃并和氧气发生反应,产生氮气和水。
2. 与酸的反应氨具有碱性,可以和酸发生酸碱反应。
例如,氨和盐酸反应生成氯化铵(NH4Cl),氨和硫酸反应生成硫酸铵((NH4)2SO4)等。
3. 与金属的反应氨能够与金属发生反应,生成硝酸盐和铵盐。
例如,氨和银离子反应生成白色的银氨合物。
4. 与氧化剂的反应氨具有还原性,在存在氧化剂的条件下能够发生反应。
例如,氨与氯元素反应生成氯氨,氨与过氧化氢反应生成氮气和水。
三、应用1. 化学工业氨广泛用于化学工业的合成反应中。
例如,氨是合成尿素和硝酸等化肥的原料。
此外,氨还可用于制造合成纤维和合成树脂等。
2. 医药领域氨在医药领域也有一定的应用。
例如,氨能够用作制备某些药物的中间体,或用于药物的稀释剂。
3. 农业氨被广泛应用于农业领域。
氨作为氮源,可作为农田土壤的肥料,并且也用于动物饲料的添加剂。
4. 清洁剂和消毒剂由于氨具有杀菌和去除异味的特性,它常被用作清洁剂和消毒剂。
例如,在家庭中,氨可用于清洗玻璃、擦拭金属等。
综上所述,氨是一种具有刺激性气味的无色气体,具有较高的水溶解度和碱性。
在化学性质方面,氨具有不稳定性,可与酸、金属和氧化剂发生反应。
在应用方面,氨广泛用于化学工业、医药领域、农业以及作为清洁剂和消毒剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨的物理化学性质
氨是一种无色气体,在常温下呈现出刺激性气味。
它是一种高度反应性的化合物,可以被用于各种工业和实验室应用中。
这篇文章将介绍一些氨的物理和化学性质。
1. 物理性质
氨的化学式为NH3,在标准条件(温度为25摄氏度,压力为1 atm)下,它是一种无色具有强烈臭味的气体。
它的密度比空气小,摩尔质量为17.03 g/mol。
氨具有较高的气味阈值,即当其浓度小于5 ppm时就能被人感知到。
氨的沸点为-33.34摄氏度,凝固点为-77.73摄氏度。
氨的汽化热为23.35 kJ/mol,它是一种较好的溶剂,可以溶解许多有机和无机化合物。
2. 化学性质
氨是一种亲电性较强的化合物,在许多氧化还原反应和酸碱中都起着重要的作用。
下面是氨的一些主要化学性质。
2.1 氨的碱性
氨是一种弱碱,它与酸反应可以形成盐和水。
例如,氨和盐酸反应可以形成氯化铵:
NH3 + HCl → NH4Cl
氨的碱性可以用pH值来描述。
在水中,氨化反应的化学平衡可以表示为:
NH3 + H2O ⇔ NH4+ + OH-
在这个反应中,NH4+是酸性离子,而OH-是碱性离子。
氨的pH值为11.6,比氢氧化钠(NaOH)稍微弱一些。
2.2 氨的还原性
氨是一种良好的还原剂,它可以参与许多氧化还原反应。
例如,它可以还原Cu2+离子,产生Cu:
2NH3 + Cu2+ → Cu + 2NH4+
氨还可以还原NO2离子,生成氮气:
4NH3 + 2NO2 → 3N2 + 2H2O
这些反应都是氨在电子上的剩余性质使其成为一种良好的还原剂。
2.3 氨与酸的反应
氨可以与不同的酸反应,生成相应的盐和水。
例如,它可与硫酸反应,形成硫酸铵:
2NH3 + H2SO4 → (NH4)2S O4
氨可与硝酸反应,形成硝酸铵:
NH3 + HNO3 → NH4NO3
这些反应中,NH3作为碱中和了酸受体的质子(H+),从而生成了相应的盐。
2.4 氨的氧化性
虽然氨是一种良好的还原剂,但它也可以参与氧化反应。
例如,氨与氯气反应,形成氮气和盐酸:
2NH3 + 3Cl2 → N2 + 6HCl
在这个反应中,氨被氯气氧化成氮气,氯气则被还原成了盐酸(HCl)。
总之,氨是一种广泛使用的化合物,具有强烈的气味和高度的反应性。
它可用于许多工业和实验室应用中。
氨的物理和化学性质对于理解其在不同应用中的行为有很大的帮助。
