溴乙烷的制备PPt
溴乙烷的制备

H2SO4 H2SO4
实验报告溴乙烷的制备
一、实验目的
1、学习蒸馏装置和分液漏斗的使用方法。
2、学习以醇为原料制备溴乙烷的方法和原理。
二、实验原理
醇和氢卤酸的反应是一个可逆反应。
为了使反应平衡向右方向移动,可以增加醇或氢卤酸的浓度,也可以设法不断地除去生成的卤烷或水,或两者并用。
在制备溴乙烷时,采用溴化钠—硫酸法制备。
主要反应:
NaBr + H2SO4HBr + NaHSO4
C2H5OH + HBr C2H5Br + H2O
副反应:
2C2H5OH C2H5OC2H5+ H2O
C2H5OH CH2=CH2+ H2O
三、实验药品的物理常数
四、主要仪器和药品
1.仪器
100ml和50ml 圆底烧瓶各一个;锥形瓶;75°弯管;直形冷凝管;接引管;分液漏斗;蒸馏头;尾接管;温度计套管。
2.药品
乙醇10ml(7.9g,0.165mol);溴化钠(无水):13g(0.136mol);浓硫酸(d=1.84):19ml(0.34mol) 饱和亚硫酸氢钠溶液
六、实验装置图
图1 反应装置图2 蒸馏装置
七、实验步骤、现象记录
八、产率计算:
九、思考题
1、本实验中得到的产品溴乙烷产量往往不高,试分析可能的几种因素?
答案:高浓度盐会降低醇在反应体系的溶解度;温度太高,会使HBr大量挥发.。
溴乙烷的制备
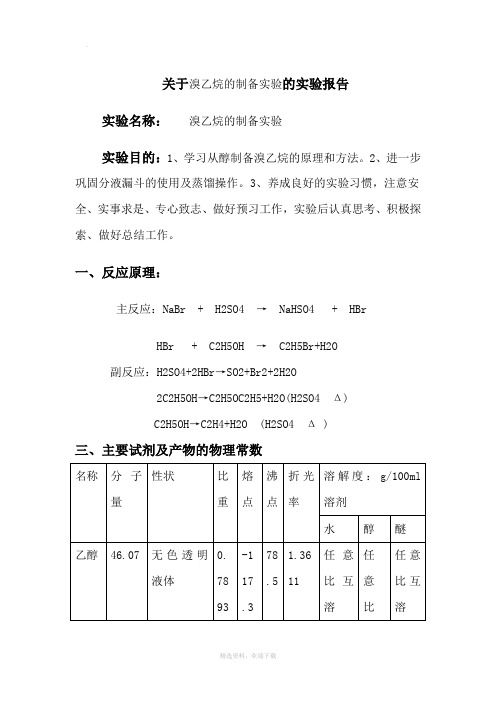
关于溴乙烷的制备实验的实验报告实验名称:溴乙烷的制备实验实验目的:1、学习从醇制备溴乙烷的原理和方法。
2、进一步巩固分液漏斗的使用及蒸馏操作。
3、养成良好的实验习惯,注意安全、实事求是、专心致志、做好预习工作,实验后认真思考、积极探索、做好总结工作。
一、反应原理:主反应:NaBr + H2SO4 → NaHSO4 + HBrHBr + C2H5OH → C2H5Br+H2O副反应:H2SO4+2HBr→SO2+Br2+2H2O2C2H5OH→C2H5OC2H5+H2O(H2SO4 Δ)C2H5OH→C2H4+H2O (H2SO4 Δ )三、主要试剂及产物的物理常数名称分子量性状比重熔点沸点折光率溶解度:g/100ml溶剂水醇醚乙醇46.07 无色透明液体0.7893-117.378.51.3611任意比互溶任意比任意比互溶互溶溴化钠102.89白色结晶或粉末。
有咸味或微带苦味3.203755℃1390°C1.361490.3(20℃)微溶浓硫酸98 无色黏稠,油状液体 1.8410℃338℃任意比互溶亚硫酸氢钠103.0535白色结晶粉末,有二氧化硫的气味。
1.4815℃易溶微溶微溶溴乙烷108.9651无色油状液体1.4612-119℃38.2℃1.42420.914(20℃)能溶能溶四、主要试剂用量及规格:主要药品:乙醇(95%)4.8g 6.2ml (0.10mol)溴化钠(无水)8.2g (0.08mol)浓硫酸(d=1.84) 11ml (0.2mol)饱和亚硫酸钠溶液五、实验仪器及装置图:50ml圆底烧瓶,75°弯管,直形冷凝管,接引管,接受器,石棉网,分液漏斗,小锥形瓶,温度计,蒸馏头,烧杯,胶头滴管,30ml圆底烧瓶六、实验步骤及现象、原因在50ml圆底烧瓶中,放入4ml水,在冷却和不断振摇下,慢慢地加入11ml浓硫酸。
冷至室温后,在加入6.2ml95%乙醇,在不断冷却并搅拌下加入8.2g研细的溴化钠及两粒沸石。
《高二化学溴乙烷》课件

这是一份《高二化学溴乙烷》的PPT课件,将带领你了解溴乙烷的性质、用 途、反应机理、实验操作和结果、以及在实际生产中的应用价值。
概述
溴乙烷是一种有机化合物,具有特殊的性质和广泛的用途。本部分将简要介绍溴乙烷的性质和用途,并 介绍制备溴乙烷的方法。
反应机理
溴乙烷的反应机理是理解其性质和反应过程的关键。我们将描述溴乙烷的反 应机理,并介绍SN1反应和SN2反应。
பைடு நூலகம் 结论
通过总结实验过程和结果,我们将强调溴乙烷的重要性和应用价值,以及如 何在化学实践中加以应用。
实验操作
通过展示实验装置和实验步骤,以及演示操作过程和安全注意事项,我们将带你了解制备溴乙烷的实验 操作。
实验结果
通过展示实验结果和数据,我们将通过结果分析来揭示溴乙烷的反应机理。
应用领域
除了了解其性质和反应机理外,我们还将探讨溴乙烷在实际生产中的应用和 价值,以及在医药、化妆品等领域中的广泛应用。
溴乙烷制备(共7张PPT)

也不允许用布用力来回擦,防止损伤皮肤。实验室 教学目的:1、掌握实验室以相应结构的醇为原料制备卤代烃的方法;
通过石棉网小火加热,使反应平稳发生至接受器内无油滴滴出。
杜绝使用硫酸或其他药品威胁别人,杜绝将硫酸或 1、接收溴乙烷的部分,包括制备的蒸馏接收部分、分液的接收部分、干燥和提纯蒸馏的接收部分,外部一定要使用冰水冷却,防止溴乙烷
Br2 + SO2 + H2O
第4页,共7页。
实验步骤:
在100ml圆底烧瓶中加入10ml(0.17 mol)95%的 乙醇和9 ml 的水。在不断振荡和冷却下,缓缓加入浓硫 酸19ml(0.34mol),混合物冷却到室温,在搅拌情 况下加入研细的溴化钠15 g(0.15mol)和几粒沸石, 按图3-1装配成蒸馏装置(事先在接收瓶中加入少量的冰 水)。通过石棉网小火加热,使反应平稳发生至接受器 内无油滴滴出。将馏出液小心转入分液漏斗中,分出有 机层,在震荡下滴入浓硫酸1-2ml,分出有机层转入蒸 馏烧瓶,加入沸石,在水浴中加热收集35~40馏分的液 体,计算体积、产量和产率。
第3页,共7页。
教学实验原理:
反应方程式:
N aB r +H 2S O 4
H B r +N aH S O 4
H B r +C 2H 5O H
C 2H 5B r +H 2O可 Nhomakorabea的副反应
H2SO4 C2H5OH
C2H5OC2H5 + H2O
C2H5OH H2SO4 CH2=CH2 + H2O
HBr + H2SO4
教学难点:醇为原料制备卤代烃的原理
第2页,共7页。
教学安全环节:
实验三 溴乙烷的制备

实验三溴乙烷的制备一、实验目的:1.了解有机反应产物的提纯和少量杂质的分离;2.了解分馏原理及操作技术;3.熟悉标准磨口仪器和分液漏斗的使用。
二、实验原理:主反应:副反应:三、实验药品:10mL 95%乙醇,9mL蒸馏水,13g NaBr, 19mL浓硫酸,,5mL饱和亚硫酸氢钠,凡士林四、实验仪器:粗产品反应装置:100mL圆底烧瓶,分馏柱,真空塞,直形冷凝管,燕尾管,150mL锥形瓶分液装置:分液漏斗,50mL锥形瓶蒸馏装置:50mL圆底瓶,蒸馏头,温度计,真空接引管,100mL锥形瓶其他:100mL量筒,10mL量杯,研钵,玻璃棒,电加热套,水浴锅,橡胶管,电子天平五、实验操作与现象:1. 洗涤并烘干100 ml圆底瓶,并清洁仪器按实样从反应瓶一端开始安装粗产品反应装置,尾接管末端应浸入装有冰水的接收瓶1 cm,接收瓶置于盛有冰水的水浴锅中,水浴锅可置于铁架台的大铁环上;检查上下水及连接处;2. 取下反应瓶,加入10 mL 95%乙醇和9 mL水,将反应瓶置于水浴锅冰水中边摇边加入19 mL浓硫酸,约5~6 min加完,加酸时应在水边并防止局部过热;3. 称取14 g研细的NaBr,待反应瓶冷却至室温时,分次加入防止产生烟雾及结块,并注意玻璃棒上的酸液切勿滴在台面上,加料后用软纸擦干净反应瓶口,加入沸石,迅速连接好仪器,检查无误后开始加热;4. 调电压为100 V左右,约10 min开始产生气泡,反应液变黄,控制电压,勿使黄色沫冲到分馏柱口;5. 当无乳油珠状物滴入接收瓶水面时,先移开接收瓶,再停止加热;6. 反应加热时,洗涤烘干50 ml圆底瓶及100 ml锥形瓶,并将锥形瓶称重记录重量。
7. 将分液漏斗下涂凡士林备用,将接收瓶的余水倒掉,粗产品倒入分液漏斗中,分出下层粗产品于50 ml滴瓶中,加入2 ml浓硫酸,洗涤再进行二次分液;8 将反应瓶中液体倒入废液瓶,按照蒸馏装置安装仪器,二分液下面的液体倒入废液瓶,粗产品从上口倒入反应瓶(50 ml圆底瓶),连接无误后开始加热,调电压50V左右,收集馏分,勿将反应瓶中液体蒸干;9. 称重并记录,拆卸清洗仪器。
烃的衍生物-溴乙烷PPT教学课件

精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
精原细胞 初级精母细胞
第六章 烃的衍生物
你能说出除烃外的其它一些有机物吗?
如前面学到的氯乙烷、乙醇、乙酸、 乙醛、硝基苯、溴苯等。
烃分子里的氢原子被其它原子或原子团 取代而衍变成的化合物---烃的衍生物
上述有机物中的—X、—OH、—COOH、 —NO2、碳碳双键、碳碳双键、苯环等往往 决定化合物的特殊性质。
化学上把这种决定化学性质的原子或 原子团称为---官能团
4N
DNA 2N
染色体
间 二倍体生物
前 中后末 文字+识图+数量
动植物细胞有丝分裂的不同点
前期
末期
区别点 纺锤体的形成方式
子细胞形成方式
植物
两极直接发出纺锤丝, 构成纺锤体
细胞板向周围扩散 形成细胞壁
动物
中心粒周围发出星射线, 细胞膜凹陷缢裂成两
构成纺锤体
个子细胞
减数分裂的过程
起点
精原细胞 体细胞卵原细胞
注意点:配对,联会,成双出现,等位基因 特殊情况:XY
四分体
联会后的一对同源染色体,一定要联会后
A AB’ B’ b b’ a a’ A A’ a Ba’ B’ b b’
1 23 4
14
23
• 注意点:有丝分裂中不存在 有交叉互换现象出现
细胞增殖(分裂)的方式
(整理)3溴乙烷的制备(ywt).
直型冷凝管
#14
沸石
接引管
#14
锥型瓶
#14,50Φml
分液漏斗
250ml
温度计
100℃
蒸馏头
#14,75o
沸石和玻璃漏斗
长颈
研钵和烧杯
400ml
台秤连砝码
0-200g
电热套
100ml
铁方座铁夹圈
制冰机
五、实验原理及原始计算数据、所应用的公式
溴乙烷制备原理
由于副反应存在,乙醇和硫酸需过量,所以溴化钠用0.126mol,而硫酸要用0.34mol,乙醇要用0.165mol。
c、蒸馏与加热速度不能太快
d、加浓硫酸洗涤时应在冷却下进行
八、对实验结果和实验中某些现象的分析讨论
产率73%左右的原因是:
(1)有副反应的存在,因此反应初级阶段必须要小火,否则主反应损失大
1)采取防护措施。(2)冷却不够完善,因溴乙烷沸点低易挥发而损失
表四:项目排污情况及环境措施简述。(3)用浓硫酸洗涤前,在分液漏斗中水分一定要分清,否则在洗涤时,浓硫酸放热使溴乙烷挥发而损失。
2.这是首次合成实验,通过实验掌握有机反应原理,用所学理论知识指导整个实验操作,并记录,观察实验发生的现象。
3.分液漏斗使用前要检查是否漏水,并在活塞处正确涂抹凡士林,要用正确的手势和方法使用分液漏斗。
4.实验完毕后,要在分液漏斗的塞子和活塞处垫一点纸,以防下次使用时粘住。
一十二、参考文献
有机化学实验,兰州大学,复旦大学(第二版)P125-129
整个制备实验需要6学时。
本实验是学生所接触的第一次合成实验,因此在基本操作方面要严格要求,以求良好开始。
可涉及的基本操作有:
1.蒸馏2.萃取-分液漏Fra bibliotek操作及各步洗涤
溴乙烷 PPT课件-人教版
是不是所有的一卤代烃都能发生消去反应? 例2·是不是所有的一卤代烃都能发生消去反应? 是不是所有的一卤代烃都能发生消去反应 解析:不是。根据消去反应特点, 解析 不是。根据消去反应特点,可以总结出发 不是 生消去反应的条件: 生消去反应的条件:与卤素原子所连碳原子的邻 位碳原子上必须有H原子 原子。 位碳原子上必须有 原子。如CH3Cl、 、 (CH3)3CCH2Br等不能发生消去反应。 等不能发生消去反应。 等不能发生消去反应
卤代烃与强碱(NaOH或KOH)的醇溶液共热,从分子 或 共热, 卤代烃与强碱 的醇溶液共热 中脱去HBr,生成烯烃。 中脱去 ,生成烯烃。
以溴乙烷为例: 以溴乙烷为例:
CH2 CH2 + NaOH
H Br
醇 △
CH2
CH2 + NaBr + H2O
练习 写出 氯丙烷,2-氯丙烷分别和 写出1-氯丙烷 氯丙烷, 氯丙烷分别和
NaOH醇溶液共热的化学方程式 醇溶液共热的化学方程式
CH3CH2CH2Cl + NaOH CH3CHClCH3 + NaOH
醇 △ 醇 △
CH3CH CH3CH
CH2 + NaCl + H2O CH2 + NaCl + H2O
溴丁烷( 与下列溶液共热, 例 :2—溴丁烷(CH3CHBrCH2CH3)与下列溶液共热, 溴丁烷 各得到什么产物?写出有关的方程式,注明反应类型: 各得到什么产物?写出有关的方程式,注明反应类型: 水溶液( ) 醇溶液。 (1)NaOH水溶液(2)NaOH醇溶液。 ) 水溶液 醇溶液 解析: 解析:(1)发生水解反应(取代反应) )发生水解反应(取代反应) (2)发生消去反应,可以得到两种产物: )发生消去反应,可以得到两种产物: CH2=CH—CH2—CH3 或 CH3—CH=CH—CH3
溴乙烷的制备与2-甲基-2-丁醇的制备和性能分析.
用干燥的分液漏斗是为了防止浓硫酸遇水放热使溴乙烷挥发
6
将有机层转入5ml干燥的原口烧瓶中,加入几粒沸石,按纯化装置连接仪器,水浴加热蒸馏,接收瓶浸入冰水浴冷却,收集37——40℃的馏分
33℃有物质馏出,34℃换接收瓶;收集37——40℃的馏分,产量约为1.4g
接收瓶用冰水浴是为了提高溴乙烷的产率
2.4具体操作步骤及现象如下:
①溴乙烷的制备:
步骤
现象
注释
1
在25ml圆底烧瓶中加入研细的3g溴化钠,然后加入2ml 95%乙醇,置于冷水浴中,分次加入5ml 78%硫酸,冷却至室温,,加入两粒沸石;摇荡加入6.0gNaBr(研细的粉末)。
NaBr粉末结块,溶液中有淡黄色
2 HBr + H2SO4——Br2 + SO2 + 2 H2O
该反应剧烈,随着丙酮乙醚溶液的加入反应瓶内出现白色固体。反应放热,冷凝管中不时有液滴滴下。
该反应剧烈,随着丙酮乙醚溶液的加入反应瓶内出现白色固体。反应放热,冷凝管中不时有液滴滴下。
6
将反应烧瓶再置于冰水浴上。关闭恒压滴液漏斗活塞,向其中加入50mL的10%硫酸。将恒压滴液漏斗中的硫酸小心的加入反应烧瓶中,边加边摇动,使烧瓶充分冷却。
3 实验结果
①溴乙烷:
实验共获得产品0.8g,产品呈无色油状液体。
理论产量:1.4g。
产率:0.8/1.4*100%=57%。
②2-甲基2-丁醇:
实验共获得产品1.0g,产品呈无色透明状,有类似樟脑气味。
理论产量:6.0g。
产率:1.0/6.0*100%=17%。
4实验结果分析及讨论①溴乙源自:本次实验产率较低,是由于加热过快过猛,使低沸点反应物未反应便被蒸出,同时使大量副反应剧烈发生。装置密闭性不是很好,导致一些物质逸出。分液时没有很好的控制开关,使所需溶液未完全分开。加浓硫酸除杂时未冷却,使产物挥发出去。有少量硫酸未吸出,蒸馏时,氧化产物,造成产率很低。蒸馏前,所有装置未完全干燥,使产物中混有少量的水。
实验八 溴乙烷的制备
讲授内容备注
实验八溴乙烷的制备
一、实验目的
1、学习用乙醇为原料制备溴乙烷的原理和方法
2、复习蒸馏,常用仪器的安装,拆卸
3、学习分液漏斗的使用及处理低沸点有机物的方法
二、反应原理
主反应:
副反应:
三、实验仪器药品
磨口玻璃仪器一套,分液漏斗,石棉网,电热套,烧杯,温度计;锥形瓶;
乙醇(95%)10mL(7.9 g,0.17mol)溴化钠(无水)15 g(0.15mol)
浓硫酸(d=1.84)19 mL 硫酸2mL
四、本实验所涉及的物理常数
讲授内容备注
表8-1 主要试剂的物理常数
名称相对密度熔点(℃)沸点(℃)折光率20(℃)
乙醇0.79 -117.30 78.4 1.3605
硫酸 1.84 10.38 340℃分解
乙醚0.71 -116 34.6 1.352 6
乙烯-169 -103.7
溴乙烷 1.461 38.4℃ 1.4239
五、实验装置图
六、实验步骤:
(一)粗产品合成
1、在100ml圆底烧瓶中,加入10ml 95%乙醇和9ml水,慢慢加入19ml
浓H2SO4,混匀冷至室温。
2、混合后加入15g研细的溴化钠,充分振荡。
加入几颗沸石。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
加入浓硫酸精制时一定注意冷却,以避
免溴乙烷损失。
实ห้องสมุดไป่ตู้过程采用两次分液,第一次保留下
层,第二次要上层产品,事先头脑要清楚。
在反应过程中,既不要反应时间不够, 也不要蒸馏时间太长,将水过分蒸出造成 硫酸钠凝固在烧瓶中。
浓硫酸(d=1.84)4 mL
78%硫酸 28mL
饱和亚硫酸氢钠 5mL
三、反应原理
主 反 应 : NaBr + H2SO4
HBr
+
Na2SO4
C2H5OH + HBr H2SO4 副 反 应 : 2C2 H5 OH H2SO4 C2H5OH
C2H5Br + H2O C2H5OC2H5 CH2=CH2 + H2O
蒸馏装置图
五、操作步骤
溴乙烷为无色液体,沸点38.4℃, d420=1.46
六、注意事项
同时使用78%和98%的硫酸,一定不 能加错。如果在加入乙醇时不把粘在瓶口 的溴化钠洗掉,必然使体系漏气,导致溴 乙烷产率降低 。 如果在加热之前没有把反应混合物摇均, 反应时极易出现暴沸使反应失败。 开始反应时,要低电压加热,以避免溴 化氢逸出。
四、仪器及反应装置图
100mL圆底; 750蒸馏头; 直形冷凝管; 接受弯头; 温度计; 蒸馏头; 分液漏斗; 锥形瓶; 加热套; 调压器。
温度 计
蒸馏弯头 直形冷凝管 接受弯头 烧瓶 锥形瓶
锥 形瓶 圆 底烧 瓶 蒸馏 头 直 形冷 凝管 接受 弯头
反应装置图
实验化学
溴乙烷的制备
一.实验目的
通过溴乙烷的制备学习并掌握用 醇和氢卤酸反应制取卤代烷的原理和 基本操作。知道发生的主反应和副反 应。如何控制反应使产率尽可能高,
掌握加热、产品的精制,正确使用分
液漏斗和进行蒸馏操作。
二、试剂
乙醇(95%)10mL(7.9 g,0.165mol)
溴化钠(无水)13 g(0.126mol)
