物质的分类结构图
物质的基本结构

第四章物质的基本结构本章导读世界是物质的。
物质的结构层次是怎样的?构成物质的基本单元是什么?这是自然科学研究的重大基本问题,也是从古到今,人类一直不断探索的问题。
从微观角度,物质的基本结构分为三个层次:分子和原子层次、原子核层次、基本粒子层次。
它们分别是原子物理和化学、原子核物理学和粒子物理学研究的内容。
目前,人们对微观世界的认识尺度已经达到1910 米,已发现的基本粒子有400多种,构成物质的基本单元是夸克、轻子和传播子。
基本粒子研究的内容:四种基本相互作用力,粒子的物理性质、粒子的分类、粒子的波粒二象性。
第一节 物质的基本结构人类对物质组成的最小结构的不断探索,推进了人类对微观世界的认识。
所谓的微观世界是指m 1010-(原子的直径为m 1010-)以下的物质世界。
微观世界的研究可分为三个层次:分子和原子层次微观世界 原子核层次基本粒子层次它们分别是原子物理和化学、原子核物理学和粒子物理学研究的内容。
图4-1 从分子到夸克和轻子一、对分子、原子层次的认识过程从古代开始,人类在探索自然奥秘的过程中,就不断探求物质的最小结构单元。
但运用实验和数学分析等手段和方法,真正对物质的基本结构进行科学的研究和解释,是从17世纪开始的。
1661年,英国科学家玻义耳提出了化学元素的概念,为科学地研究化学奠定了基础。
1803年,被誉为近代化学之父的英国化学家和物理学家道尔顿提出了原子论。
认为:元素的最小单元—原子是不可再分割的物质粒子。
1811年,意大利科学家阿伏加德罗提出了分子学说,弥补了道尔顿原子论中忽视了分子和原子区别的缺陷,两者结合形成了“原子—分子学说”。
使化学有了惊人的发展,许多新的化学元素不断被发现。
1871年,俄国化学家门捷列夫研究了原子量与元素性质之间的关系,提出了较完整的化学元素周期表。
周期表揭示出:元素性质的规律性变化与物质结构有关。
启示人们对物质更高层次的探索。
二、对原子核层次的认识过程19世纪,物理学家通过光谱分析技术,发现不同元素的原子都有不同的光谱结构,而同种元素的原子其光谱结构也相当复杂。
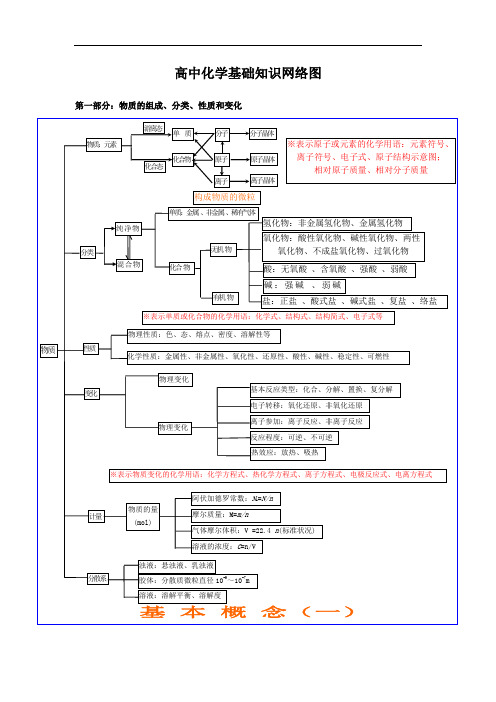
高中化学知识结构图

高中化学知识结构图一:物质分类变化模块。
1:物质的组成,性质,分类。
重难点知识:A:物质的分类原则(氧化物分类)。
B:纯净物与混合物的区分,性质的不同点总结。
C:化学性质与物理性质的区别,化学变化与物理变化的区别。
D:既能与酸反应又能与碱反应物质总结。
E:平均相对分子质量的求法(十字相乘法)。
F:化学反应基本类型。
G:同位素基本概念。
2:物质的量,常见化学计量。
重难点知识:A:基本概念:物质的量,摩尔质量,气体摩尔体积,物质的量的浓度及配置。
B:物质的量与阿伏加德罗常数间的换算关系,阿常数的推论总结。
C:物质的量使用时的注意事项。
D:气体摩尔体积条件状态的说明及常温常压下的推导公式。
E:配置物质的量浓度的仪器,步骤,以及与浓度的换算,误差分析。
F:平均相对分子质量求法总结。
G:质量,物质的量,微粒(分子,原子,离子)数目,气体体积(标况),物质的量浓度的关系。
3:分散系重难点知识:A:分散系的分类,特征,性质。
B:胶体性质,制备,提纯,凝聚方法。
C:关于溶解度的计算。
(晶体析出类,温度改变类)D:常见胶体及应用。
4:离子反应重难点知识:A:离子方程式的书写规则。
B:离子方程式中的过量,少量问题。
加入顺序问题。
C:离子共存的判断,包括隐含条件的应用规律。
D:电解质的概念。
E:归纳总结沉淀,弱电解质。
5:氧化还原反应:重难点知识:A:氧化还原反应的本质及特征。
B:表示方法:单线桥法,双线桥法。
C:氧化剂,还原剂,氧化产物,还原产物。
D:氧化还原反应的配平原则及步骤(重点四种题型:基本题型/脚标变化题型/歧化反应/归中反应1E:氧化还原反应的计算题。
二:金属元素模块1:碱金属元素:重难点知识:A:钠的性质,用途。
B:氧化钠,过氧化钠,碳酸钠,碳酸氢钠。
C:碱金属的性质(相似性,递变性)。
D:二氧化碳与氢氧化钠溶液反应产物的判断方法,技巧总结。
E:漂白原理总结,漂白剂分类及介绍。
F:焰色反应原理及运用。
物质的构成

2006年沈阳市第20题 归纳和比较是学习化学的重要方法。对待同一个问 题,从不同的角度我们可以找到不同的规律,从而得出 不同的答案。请按要求及示例完成下表:
物质
与众不同的 物质
理
由
KCl K2SO4 K2CO3 BaCO3
KCl
KCl中不含氧元素,其 他物质中均含有氧元素
END
2006年宜宾市 第16题
核对 者
L
送检 医师
检验 师
⑴ 这位少年患者由于长期偏食、挑食造成营养不良和食 欲不振,请从上述检验单中指出患者体内缺乏哪些元素? 这些元素在人体内含量均超过0.01%,应称为什么元素? ⑵这位患者体内钠元素偏高,请对他的饮食习惯提出改 进建议。
物质的分类
区分纯净物与混合物的标准:物质是否是一种 纯净物:只由一种物质组成 物 它具有固定的组成和性质 质
联 都是纯净物,都有固定的组成。 系 同一种元素的原子可能存在单质或化合物里。
单质
纯 净 物 化合物
有机化合物 无机化合物
区分无机物和有机物的标准:是否含碳元素
注:CO、CO2、含CO2-、 HCO-的物质例外 3 3
单质
金属单质 非金属单质 稀有气体
氧化物
纯净物 物 质 按 组 成 分 化 合 物 混合物
核外电子排布的初步知识 ①.在含有多个电子的原子里,电子的能量并不相同,故电子 是分层排布的. 电子层数 一二三四五六七 离核距离 近→远 电子能量 低→高 填充顺序 先→后 ②.原子结构示意图. 如图,镁原子的结构示意图含义 +12 表示原子核及核内有12个质子(即原子核带有12个单 位正电荷), 弧线表示电子层 弧线上的数字表示该电子层上的电子数
项 目 血清钾 血清钠 血清氯 钙 离子钙 磷 镁 二氧化碳结合力
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
物质的组成、分类、性质

第二章
化学物质及其变化
4.物质微观构成 微粒 原子直接 构成 常考实例 晶体硅、碳化硅、SiO2等
分子直接 非金属单质(O 、P 、稀有气体等) 2 4 构成 离子直接 离子化合物(含有金属阳离子或铵 构成 根的化合物)
性质上,同素异形体之间的转化属于 ___变化。 化学
第二章
化学物质及其变化
三、混合物和纯净物
1.纯净物:由同种单质或化合物 __________________组成的物质。 由几种不同的单质或化合物 2.混合物: _______________________组成的物质。 [温馨提示] 常见混合物:(1)分散系,如溶液、胶体、
[答案] 非金属氧化物不一定是酸性氧化物,如CO、
NO;酸性氧化物不一定是非金属氧化物,如Mn2O7。
4.酸性氧化物一定能和H2O反应生成相应的酸吗?
[答案] 不一定,如SiO2不能与H2O反应。
第二章
化学物质及其变化
题组一 物质的分类考查
(2014· 高考四川卷 ) 下列关于物质分类的说法正确 的是( A.
浊液等;(2)高分子,如蛋白质、纤维素、聚合物、淀粉
等;(3)常见特殊名称的混合物:石油、石油的各种馏
分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、
水煤气、铝热剂等。
1.硅、氯、硫、氮元素在自然界中存在状态是什
第二章
化学物质及其变化
么?
[ 答案 ]
硅、氯元素在自然界中以化合态存在;
硫、氮元素在自然界中既有游离态又有化合态。
例如:利用交叉分类法对下列物质分类,将Ⅰ中物质与Ⅱ中
高中化学知识结构图

高中化学知识结构图第一部分:物质的组成、分类、性质和变化基本概念(一)第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)电化学知识图表化学反应速率化学平衡电解质溶液第三部分:元素化合物转化关系Mg 3MgXMg(OH)2 3 MgCl 2 H O NaOHMg(HCO 3)2 煅烧 HCl H 2O CO 2 △ 或 OH -HCl Na 2CO 3 2 NaCl COONa NaHCO 3稀 2 Fe(OH)3FeSO Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3KSCN KSCN H 2SO Cl 2、HNO 浓 O 2和H 2OHClCuCuOCu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2SSH + HNO3或H 2SO 4(浓)NaOHO 2CO 、Al 、H 2△H +第四部分:有机化学烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃烷烃:C n H 2n+2(n≥1)R—CH 3 不饱和链烃 烯烃:C n H 2n (n≥2) R—CH=CH 2二烯烃:C n H 2n-2(n≥4)R—CH=CH —CH=CH 2炔烃:C n H 2n-2(n≥2) R—C≡CH 环烷烃C n H 2n (n≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n≥1)R—X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n≥1)R—OH 醚 C n H 2n+2O (n≥2)R—O —R酚(苯酚)(官能团:—OH )C n H 2n-6O (n≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n≥1)R—COOH醛 (官能团:—CHO )C n H 2n O (n≥1) R —CHO酮 (官能团:—CO —)C n H 2n O (n≥3)R—CO —R’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n≥2)R—COOR ′硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2 单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料合成橡胶 合成纤维有机化合物。
物质的分类树状图p3

1、下列物质中前者从属于后者的是( B )
A、纯净物、混合物 B、氧化物、化合物
C、盐、正盐
D、金属氧化物、碱性氧化物
2、下列说法中,正确的是 ( DE )
A、非金属氧化物都是酸性氧化物 B、酸性氧化物都是非金属氧化物 C、金属氧化物都是碱性氧化物 D、碱性氧化物都是金属氧化物
萃取剂的要求
1、与原溶剂互不相溶 2、被萃取的物质在萃取剂中的溶解度远远大于在原溶 剂中的溶解度
物质的分离和提纯的要求
1、不能引入新的杂质 2、被提纯的物质不能减少 3、除杂试剂应该过量 4、过量试剂必须除去 5、除杂中用到多种物质时,要考虑加入试剂的顺序 6、被提纯或分离的物质要复原
1.已知粗盐中含有泥砂、MgCl2、CaCl2、Na2SO4等杂质 设计实验除去以上杂质得到精盐
E.H的摩尔质量是1g.mol-1 F.氩气的摩尔质量在数值上等于它的相对原子质量 G.1mol任何物质的质量等于该物质的相对分子质量
气体摩尔体积
1、决定体积的因素
固体 液体
粒子数 气体
粒子大小
粒子数 粒子间距
2、标准状况下气体摩尔体Vm≈22.4L/mol
1、下列说法正确的是
( CD )
A、1mol氖气和1 mol氧气体积相同
工方法首次合成得到的有机物是 ( C )
A、甲烷 B、乙醇 C、尿素 D、醋酸
分解反应
化合反应
氧化还原反应
置换反应
复分解反应
物质的量
1.下面说法正确的是
( CE )
A.1mol米是6.02 ×1023粒米
B.10mol氢所含粒子数为6.02 ×1024
C.摩尔是物质的量的单位
物质的组成和结构
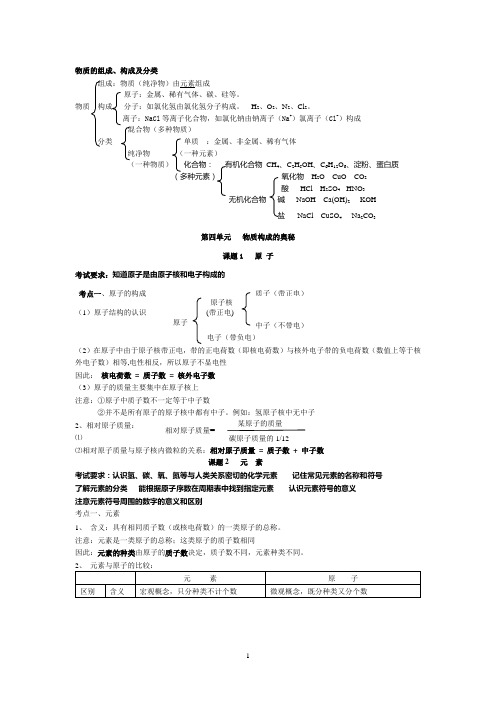
物质的组成、构成及分类组成:物质(纯净物)由元素组成原子:金属、稀有气体、碳、硅等。
物质 构成 分子:如氯化氢由氯化氢分子构成。
H 2、O 2、N2、Cl 2。
离子:NaCl 等离子化合物,如氯化钠由钠离子(Na +)氯离子(Cl -)构成混合物(多种物质)分类 单质 :金属、非金属、稀有气体纯净物 (一种元素)(一种物质) 化合物: 有机化合物 CH 4、C 2H 5OH 、C 6H 12O 6、淀粉、蛋白质(多种元素) 无机化合物第四单元 物质构成的奥秘课题1 原 子考试要求:知道原子是由原子核和电子构成的 考点一、原子的构成 (1)原子结构的认识(2外电子数)相等,电性相反,所以原子不显电性 因此: 核电荷数 = 质子数 = 核外电子数 (3)原子的质量主要集中在原子核上 注意:①原子中质子数不一定等于中子数2、相对原子质量:⑴ ⑵相对原子质量与原子核内微粒的关系:相对原子质量 = 质子数 + 中子数课题2 元 素考试要求:认识氢、碳、氧、氮等与人类关系密切的化学元素 记住常见元素的名称和符号 了解元素的分类 能根据原子序数在周期表中找到指定元素 认识元素符号的意义 注意元素符号周围的数字的意义和区别 考点一、元素1、 含义:具有相同质子数(或核电荷数)的一类原子的总称。
注意:元素是一类原子的总称;这类原子的质子数相同因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同。
相对原子质量=适用范围从宏观描述物质的组成。
常用来表示物质由哪几种元素组成。
如水由氢元素和氧元素组成从微观描述物质(或分子)的构成。
常用来表示物质由哪些原子构成或分子由哪些原子构成,如水分子由氢原子和氧原子构成;铁由铁原子构成。
联系元素是同类原子的总称,原子是元素的基本单元3、元素的分类:元素分为金属元素、非金属元素和稀有气体元素三种(考点二)4、元素的分布:①地壳中含量前四位的元素:O 、Si 、Al 、Fe ②生物细胞中含量前四位的元素:O 、C 、H 、N ③空气中前二位的元素:N 、O 注意:在化学反应前后元素种类不变 二、元素符号(考点三)1、 书写原则:第一个字母大写,第二个字母小写。
