大学化学自招,“强基计划”针对训练-2009年北京大学自主招生化学真题
高中化学竞赛,强基计划,大学化学自招,配位化学-2009-2019全国初赛真题

高中化学竞赛,强基计划,大学化学自招,配位化学-2009-2019全国初赛真题高中化学奥林匹克竞赛辅导配位化学-2009-2019年全国初赛真题2019第5题将某镧系元素的无水氯化物和异丙基醇钠在异丙醇中回流,得淡蓝色溶液。
该溶液经过蒸发浓缩、真空干燥,所得固体在甲苯中低温重结晶,析出淡蓝色针状晶体A,A为稀土离子的配合物,加热至300℃也不分解。
进一步分析表征结果如下:(1)溶液电导测定显示:A为1:1电离类型,只有一种外界离子。
称取6.354g晶体A,溶解后加入足量硝酸银溶液,得到0..4778g乳白色沉淀B。
(2)A的元素分析结果为:C,32.02%;H,6.17%;O,14.35%;均为质量分数。
(3)单晶X射线衍射分析显示,A的结构中,氯仅有一种环境;稀土离子所处环境完全相同,它与配体结合成多聚团簇,每个离子周围有5个氧原子;氧原子均参与配位且有3种类型(端基、边桥基和面桥基)。
5-1.计算A的摩尔质量。
5-2.通过计算,推出A的化学式。
5-3.写出配合物结构中端基氧、边桥基氧和面桥基氧的数目。
解:5-1、M(A)=1906 g/mol5-2、Nd6(C3H7O)17Cl5-3、6个端基、9个边桥基、2个面桥基【解析】5-1、乳白色沉淀B为AgCl,n(AgCl)=0.4778 g/143.4 g/mol=0.003332 mol因A为1︰1电离类型即含1个Cl-,则M r (A)=6.354 g/0.003332 mol=1907 g/mol5-2、A分子中含:N(C)= 1907×32.02%/12=51N(H)=1907×6.17%/1=119N(O)=1907×14.35%/16=17设A的化学式为Nd x(C3H7O)17Cl,144.2x=1907—17×59—34.45=869.6 x=65-3、根据题意,6个Nd各与1个C3H7O-中端基氧配位,共6个端基氧;虚线组成上、下2个正三角形,6个交点是6个Nd。
高校自主招生化学试题集萃参考答案

A .溴化亚铁溶液中通人少量氯气: 2Br + Cl = Br + 2Cl H 2 S高校自主招生考试(化学)真题集萃参考答案 1.(08 北理工)在体积为 VL 的干燥烧瓶中用排空气法冲入氯化氢气体后,测得烧瓶中气体对氧气的相对密度为 1.082。
若用此气体进行喷泉实验,在喷泉停止后,进入烧瓶中的 液体的体积是( )A .VLB . 3 4 VLC . 1 2 VLD . 1 4 VL 解析 烧瓶中气体的相对平均分子质量为 1.082×32 = 34.624,根据 29× x %+36.5×(1— x %)=34.624,可求出氯化氢气体占混合气体的 3 4 ,B 正确。
2.(09 北理工)能正确反应表示下列反应的离子方程式( 2 )B .实验室氯化铁溶液制取氢氧化铁胶体:Fe + 3H 2O Fe (OH )3(胶本)+3H +C .硫酸铜溶液中加入氢氧化钡溶液: Ba + SO 42 = BaSO 4D .用湿润的醋酸铅试纸检验 H 2 S : Pb+ = PbS+2H + 解析 选项 A 氯气应先和亚铁离子反应。
选项 C 中还有氢氧化铜生成。
选项中 D 中有醋 酸生成。
B 正确。
3.(08 同济大学)舞台上产生烟雾的方法很多,其中一种方法是在硝酸铵上覆盖一些锌粉,温热之,在加几滴水,即产生大量烟。
已知参加反应的NH 4 NO 3 和 Zn 物质的量之比为1:1。
(1)写出该反应方程式。
(2)烟主要是由___________组成。
(3)若不加水,是否有其他方法令反应进行?若有,写出方法。
(4)有趣的是,若硝酸铵和锌粉潮湿,或滴加的水过多,实验又会失败。
分析原因。
解析 根据氧化还原反应原理可得: (1) NH 4 NO 3 + Zn [H 2O ]ZnO + N 2 +2H 2O(2)烟为固体颗粒,故只能为 ZnO 。
(3)只要能量达到了,就有可能发生反应。
大学化学自招,“强基计划”针对训练-2008年北京大学自主招生化学真题

“强基计划”针对训练-2008年北京大学自主招生化学真题1.制备KMnO4的方法是先合成K2MnO4。
(1)MnO2和KOH在O2的作用下可生成K2MnO4,写出该反应的化学方程式。
(2)K2MnO4转化为KMnO4的两种方法是①通入Cl2;②电解。
分别写出反应式。
解:(1)(2)①②2.NH4+的化合价、半径均和K+相同(近),因此铵盐溶解度和相应钾盐相近。
请各举一例说明铵盐和钾盐两种不同的性质。
解:3.室温下饱和氯水浓度约为0.09mol/dm3,其中约1/3的Cl2发生了自氧化还原反应。
增加饱和溶液中HClO浓度的一种方法是:把Cl2通入到CaCO3悬浊液。
请写出反应式并简述理由。
解:4.称取16g CuSO4、25g CuSO4·5H2O各一份,分别溶于相同量水时,一种是溶解吸热,另一种是溶解放热。
溶解放热的溶质是________________。
若测得放热量和吸热量的差值为Q,由此可以得到的数据是_____________________________。
解:5.大气中CO2等气体含量增加会导致温室效应已引起广泛关注。
回答下列问题:(1)用酿造C2H5OH作燃料,不会增加大气中CO2含量。
为什么?(2)请解释为何天然气(燃烧热为892kJ/mol)与煤(主要成分为炭,燃烧热为394kJ/mol)相比是“清洁燃料”?解:6.有机物A分子式为C4H4O4,在浓硫酸、加热下能和C2H5OH反应生成B,分子式为C8H12O4;A和HBr反应得到分子式为C4H5O4Br的C,C和水在一定条件下反应得到分子式为C4H6O5的D。
请写出A、B、C、D的结构简式。
解:7.有机物A的分子式为C2H5NO2,能和NaOH反应生成相应的钠盐,在酸性溶液中易发生氮原子的质子化反应。
(1)写出A的结构简式。
(2)两个A分子脱水得B。
请写出B的结构简式及其所含官能团的名称。
(3)请写出含有B中官能团(A中没有)且有工业意义的一种环状化合物的结构简式。
高中化学竞赛,强基计划,大学化学自招,化学反应热力学基础、平衡常数-2009-2019全国初赛真题

高中化学奥林匹克竞赛辅导化学反应热力学基础、平衡常数-2009-2019年全国初赛真题本节重要公式总结1.△U=Q-W体。
△r U=U生-U反=Q-W体。
恒容时,W体=0,Q V=Δr U。
2.H=U+P V,Q P=△(U+P V),即Q P=Δ r H。
3.Q P和Q V的关系:Q V=Δr U,Q P=Δr U+P·△V=Δ r H=Q V+RT△n。
4.G=H-TS。
在恒温恒压下有,△G=△H-T△S,此式为吉布斯—赫姆赫兹方程式。
5.△=-RT ln=-2.303RT lg。
△=-RT ln K=-2.303RT lg K。
△=-。
6.△G=△+RT ln J=△=-RT ln+RT ln J=RT ln(),J为浓度商或压力商。
7.△=△-T△=-RT ln,lnK=−+△SR。
所以,lnK1=−△rRT1+△SR,lnK2=−△r HRT2+△SR,两式相减,得:1K=−△r HR(1T1−1T2)=△r H(T1−T2)RT1T2上述公式称为范特霍夫等温方程,式中要求△在T1~T2的变化范围内为一定值,不随温度变化而变化。
2019第3题高炉炼铁是重要的工业过程,冶炼过程中涉及如下反应:(1)FeO(s)+CO(g)→Fe(s)+CO2(g) K1=1.00 (T=1200K)(2)FeO(s)+C(s)→Fe(s)+CO(g) K2 (T=1200K)-1-1,有关的热力学数据3.1.假设上述反应体系在密闭条件下达到平衡时的总压为1200kPa,计算各气体的分压。
3.2.计算K2。
3.3.计算CO2(g)的标准熵△S。
(假设反应的焓变和熵变不随温度变化)3.4.反应体系中,若CO(g)和CO2(g)均保持标态,判断此反应的自发性:3.4.1.反应(1):A.自发 B.不自发 C.达平衡3.4.2.反应(2):A.自发 B.不自发 C.达平衡3.5.若升高温度,指出反应平衡常数如何变化?计算反应焓变,给出原因3.5-1.反应(1):A.增大 B.不变化 C.减小3.5-2.反应(2):A.增大 B.不变化 C.减小解:2018第6题将0.0167mol I2和0.0167mol H2置于预先抽真空的特制1L密闭容器中,加热到1500K,体系达到平衡,总压强为4.56 bar(1bar=100kPa)。
自主招生考试试题——北京大学(2009年)

2009年北京大学保送生考试试题(P龙独家回忆)鏖战两个月,终于等到了今天……我把我能回忆起的试题发到这里给有志于参加北大保送的学弟学妹们看看吧~就当我为贴吧做点贡献~我一个多小时的心血啊~手好痛……语文一、举出两个被人们曲解了意思的成语,并学着曲解其意思。
二、修改病句:(1)我们都有一个家,名字叫中国。
(2)素胚勾勒出青花笔锋浓转淡三、对对联:上联——博雅塔前人博雅对出下联四、翻译文言文:给出一大段不加标点的文言文,要求通篇翻译。
具体内容肯定记不清了,大概是讲做人不能太高调吧!五、现代文阅读:鲁迅的《求乞者》我顺着剥落的高墙走路,踏着松的灰土。
另外有几个人,各自走路。
微风起来,露在墙头的高树的枝条带着还未干枯的叶子在我头上摇动。
微风起来,四面都是灰土。
一个孩子向我求乞,也穿着夹衣,也不见得悲戚,而拦着磕头,追着哀呼。
我厌恶他的声调,态度。
我憎恶他并不悲哀,近于儿戏;我烦厌他这追着哀呼。
我走路。
另外有几个人各自走路。
微风起来,四面都是灰土。
一个孩子向我求乞,也穿着夹衣,也不见得悲戚,但是哑的,摊开手,装着手势。
我就憎恶他这手势。
而且,他或者并不哑,这不过是一种求乞的法子。
我不布施,我无布施心,我但居布施者之上,给与烦腻,疑心,憎恶。
我顺着倒败的泥墙走路,断砖叠在墙缺口,墙里面没有什么。
微风起来,送秋寒穿透我的夹衣;四面都是灰土。
我想着我将用什么方法求乞:发声,用怎样声调?装哑,用怎样手势?……另外有几个人各自走路。
我将得不到布施,得不到布施心;我将得到自居于布施之上者的烦腻,疑心,憎恶。
我将用无所为和沉默求乞……我至少将得到虚无。
微风起来,四面都是灰土。
另外有几个人各自走路。
灰土,灰土,……………………灰土……1、“高墙”、“灰土”、“各自走路的人”各象征什么?2、“乞求”和“布施”个象征什么?这象征着人与人之间什么样的关系?3、前面一个问记不清了。
这篇文章体现了鲁迅什么样的世界观和思想命题?4、评价本文的艺术特点六、翻译:吴人之妇有绮其衣者衣数十袭届时而易之而特居于盗乡盗涎而妇弗觉犹日炫其华绣于丛莽之下盗遂杀而取之盗不足论而吾甚怪此妇知绮其衣而不知所以置其身夫使托身于荐绅之家健者门焉严扃深居盗乌得取唯其濒盗居而复炫其装此其所以死耳天下有才之士不犹吴妇之绮其衣乎托非其人则与盗邻盗贪利而耆杀故炫能于乱邦匪有全者杜袭喻繁钦曰子若见能不已非吾徒也钦卒用其言以免于刘表之祸呜呼袭可谓善藏矣钦亦可谓善听矣不尔吾未见其不为吴妇也七、作文。
高中化学竞赛,强基计划,大学化学自招,分子结构、杂化类型,路易斯酸碱等,2009-2019全国化学竞赛初赛题

高中化学奥林匹克竞赛辅导分子结构-2009-2019年全国初赛真题2019第7题1960年代,稀有气体化合物的合成是化学的重要突破之一。
Barlett从O2+[PtF6]-的生成得到启发,推测可以形成Xe+[PtF6]-。
于是尝试通过Xe和PtF6反应合成相应的稀有气体化合物,这一工作具有深远的意义。
7-1.后续研究发现,Barlett当时得到的并非Xe+[PtF6]-,而可能是XeF+Pt2F11-。
7-1-1.写出XeF+Pt2F11-中Xe的氧化态。
7-1-2.在Pt2F11-结构中,沿轴向有四次轴,画出Pt2F11-的结构。
7-2.后来,大量含Xe-F和Xe-O键的化合物被合成出来,如XeOF2。
根据价层电子对互斥理论(VSEPR),写出XeOF2的几何构型及中心原子所用的杂化轨道类型。
7-3.1974年合成了第一例含Xe-N键的化合物:XeF2和HN(SO2F)2在0℃的二氯二氟甲烷溶剂中按1:1的计量关系反应,放出HF,得到白色固体A。
A受热到70℃分解,A中的Xe一半以Xe气放出,其他两种产物与Xe具有相同的计量系数且其中一种是常见的氙的氟化物。
写出A的化学式及其分解的反应方程式。
7-4.1989年,随着超高压下Xe单质固体由立方密堆积变为六方密堆积结构并显示出金属性,Xe 的惰性帽子被彻底摘掉。
理论预测,高压下Xe可以参与形成更复杂的化合物,如Cs℃Xe℃Au3。
若Cs℃Xe℃Au3采用钙钛矿类型的结构,分别写出Cs℃和Xe℃最近邻的金的原子数。
解:2018第2题2-1.195K,三氧化二磷在二氯甲烷中与臭氧反应生成P4O18,画出P4O18分子的结构示意图。
2-2.CH2SF4是一种极性溶剂,其分子几何构型符合价层电子对互斥理论(VSEPR)模型。
画出CH2SF4的分子结构示意图(体现合理的成键及角度关系)。
2-3.2018年足球世界比赛用球使用了生物基元三元乙丙橡胶(EPDM)产品Keltan Eco。
高中化学竞赛,强基计划,大学化学自招,有机化学-2015-2019全国初赛真题
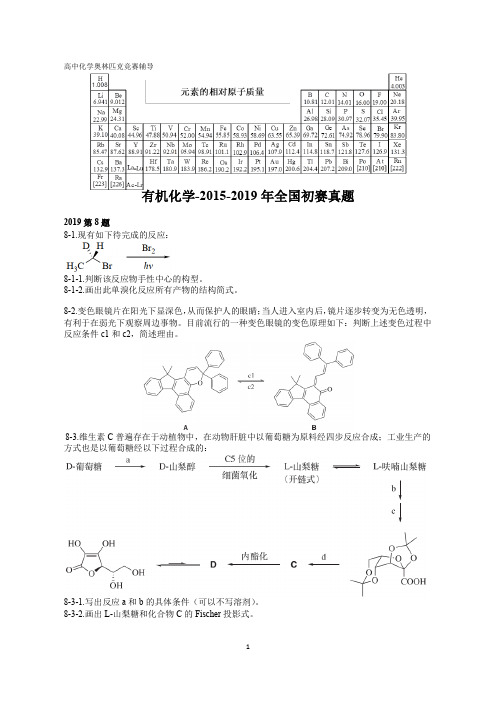
高中化学奥林匹克竞赛辅导有机化学-2015-2019年全国初赛真题2019第8题8-1.现有如下待完成的反应:8-1-1.判断该反应物手性中心的构型。
8-1-2.画出此单溴化反应所有产物的结构简式。
8-2.变色眼镜片在阳光下显深色,从而保护人的眼睛;当人进入室内后,镜片逐步转变为无色透明,有利于在弱光下观察周边事物。
目前流行的一种变色眼镜的变色原理如下:判断上述变色过程中反应条件c1和c2,简述理由。
8-3.维生素C普遍存在于动植物中,在动物肝脏中以葡萄糖为原料经四步反应合成;工业生产的方式也是以葡萄糖经以下过程合成的:8-3-1.写出反应a和b的具体条件(可以不写溶剂)。
8-3-2.画出L-山梨糖和化合物C的Fischer投影式。
8-4.以下给出四个取代反应,右侧是其中某一反应的反应势能图:(1)CH3CH2Br+NaOCH3→(2)(CH3)3CBr+HOCH3→(3)(CH3)2CHI+KBr→(4)(CH3)3CCl+(C6H5)3P→8-4-1.指出哪个反应与此反应势能图相符。
8-4-2.画出过渡态E和F的结构式。
解:2019第9题某简单芳香三酮化合物在有机合成、生物化学以及分析化学中均具有重要的应用。
它常以水合物的形式稳定存在,室温下此水合物在浓硫酸中与苯反应高产率地生成化合物G。
G的核磁共振氢谱为:δ 7.27–7.34(10H),7.91(2H),8.10(2H)ppm。
9-1.画出G的结构简式。
9-2.研究发现,当使用超酸三氟甲磺酸代替浓硫酸后,反应的产物如下图左所示。
研究还表明,化合物G在三氟甲磺酸作用下也可以转化为该化合物。
画出化合物G转化为此产物过程中所形成的中间体。
提示:同一物种只须画出其中一个主要共振式。
9-3.参照以上实验结果,如果希望制备以下内酯,画出所用原料H的结构简式(说明:LA为Lewis 酸)9-4.室温下五元环状化合物克酮酸(croconic acid,C5H2O5)在浓硫酸的作用下先与等量的苯反应形成中间体I(C11H6O4);I继续在苯中反应生成J(C23H16O3)。
高中化学竞赛,强基计划,大学化学自招,晶体结构,2009-2019全国化学竞赛初赛真题

高中化学奥林匹克竞赛辅导晶体结构-2009-2019年全国初赛真题2019第6题某晶体属六方晶系,晶胞参数a=0.4780nm,c=0.7800nm。
晶胞沿不同方向投影图如下,其中深色小球代表A原子,浅色大球代表B原子(化学环境完全等同)。
已知A2原子的坐标参数为(0.8300,0.1700,0.2500),B1原子沿c方向原子坐标参数z=0.0630。
6-1.写出该晶体的化学式。
6-2.写出位于晶胞顶点和棱上的A原子的坐标参数;计算A1-A2的距离。
6-3.写出所有B原子的坐标参数。
6-4.若将晶胞中顶角和棱上的A被另一种原子C替换,写出所得晶体的化学式。
解:6-1.A2B6-2.(0,0,0);(0,0,1/2) 0.2405 nm6-3.B1 (1/3,2/3,0.0630);(1/3,2/3,0.4370);(2/3,1/3,0.5630);(2/3,1/3,0.9370)6-4.A3B2C【解析】6-1、A:体内6+顶点1+棱上1=8,B:体内4,晶胞化学式A8B4。
6-2、根据题给的“六方晶系”和晶胞结构及投影图都确定为“六方晶胞”。
六方晶胞中的两条体对角线是不相等的,由此计算前后2处的A1-A2间的距离显然也不相等。
而根据晶胞这2处的距离是相等,难不成不是六方晶胞而是四方晶胞,若是四方晶胞,那么晶胞的俯视图就不正确了(1)按长对角线来计算A1-A2间的距离:下图中红点与A1组成的平行四边形,对角分别为120°和60°,边长均为0.17a。
长对角线的长度=0.17√3a,所以A1-A2间的距离=[(0.17√3a)2+(0.25c)2]1/2=[3(0.17×0.4780)2+(0.25×0.7800)2]1/2=0.2405 nm。
(2)按短对角线来计算A1-A2间的距离:底面短对角线的长度为0.17a(等边三角形),所以A1-A2间的距离=[(0.17a)2+(0.25c)2]1/2 =0.2113nm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“强基计划”针对训练-2009年北京大学自主招生化学真题
1.比较MgO、NaBr、NaF熔点高低。
解:
2.由氰胺(H2N-CN)写出三聚氰胺结构式。
三聚氰胺是一种微溶于水、无刺激性的低毒物质,试写出由CO(NH2)2在常压下催化合成三聚氰胺的反应方程式。
解:
3.己内酰胺是生产尼龙-6的原料。
试写出由己内酰胺制备尼龙-6方程式。
解:
4.已知Na(s)-e-=Na+(aq),=-240kJ/mol;1/2Cl2(g)+e-=Cl-(aq),=-167kJ/mol。
NaCl溶于水的溶解热为3.8kJ/mol。
由此还可以得出什么数据?
解:
5.已知NH4A(A为酸根)受热分解是质子转移,若A为氧化性酸根,分解时会发生氧化还原反应。
试回答:
(1)比较NH4H2PO4、(NH4)2HPO4、(NH4)3PO4热分解温度的大小。
(2)(NH4)2MnO4、NH4NO2、(NH4)2Cr2O7热分解方程式。
解:根据题干给出的意思,我们不难得出如下结论:对于铵盐而言,若酸根所对应的酸越弱,说明酸根越容易接受质子,NH4+中的H+就越容易转移给酸根,此时的铵盐就越容易分解,即分解温度就越低。
6.将足量的Zn分别加入等物质的量浓度(0.1mol/L)、等体积的HCl和HAc溶液中。
试解释释放氢气的速率不同,释放氢气的量也不相同的原因。
解:
7.向Na2S、Na2CO3混合溶液中通入SO2可回收Na2S2O3·5H2O。
通SO2过程的现象是:
①过一会儿生成沉淀,沉淀量逐渐增多;②沉淀量逐渐减少并形成清液;③又析出沉淀。
停止通入SO2,再加热蒸发浓缩试液,冷却得到Na2S2O3·5H2O。
(提示:S+SO32-=S2O32-)
(1)写出①、②、③中化学反应方程式。
(2)求Na2S、Na2CO3混合的最佳物质的量之比。
解:
8.分别称量5g和10g苯酚各两份,室温下:①分别放入100mL 1mol/L NaOH溶液中,均澄清;
②分别放入100mL清水中,得一浑浊液和一澄清液。
(1)试解释造成这两种现象差别的主要原因。
(2)请设计一个实验证明你举出的原因。
解:
(1)
(2)
9.异丁烯能发生哪些反应?是否有同分异构体?若有,能发生哪些反应?
解:
10. AgNO3溶液滴入Na2HPO4溶液中(pH=9.6)生成黄色沉淀。
已知Ag3PO4、Ag2HPO4均为黄色沉淀。
设计简单的实验证明沉淀是哪种物质?
解:
11.水是常见的物质。
试回答:
(1)写出H2O的结构式。
(2)水作为溶剂有何特点?
(3)写出有水参与的两个不同类型的化学反应方程式。
解:
12.粗盐中含有Ca2+、Mg2+和SO42-等杂质。
精制食盐过程中,加入NaOH、Na2CO3、BaCl2的加入顺序是什么?
解:
13.Ag的电位序排在H之后,为什么Ag能和HI、H2S反应?
解:
14.加热蒸干LiCl溶液得到的白色固体电解,为什么得不到Cl2?
解:
15.乙醇为什么能与水以任意比互溶?
解:
16.室温下用CCl4萃取水溶液中的I2,达平衡时CCl4中[I2]与H2O中[I2]的比值为85。
有人认为这是I2在CCl4、H2O中的溶解度之比。
已知:25℃时,I2在不同溶剂中的溶解度为:0.030g I2/100g H2O、2.91g I2/100g CCl4。
H2O的密度为1.00g/cm3,CCl4的密度为1.58g/cm3。
I2沸点为184.35℃,CCl4沸点为77℃。
(1)请通过计算评价以上的“认为”。
(2)如何分离CCl4中的碘?说出分离原理即可。
解:
(1)
(2)。
