工程热力学第二章整理知识点第三版
工程热力学必须掌握的内容

Liso T0 Siso
第七章 水蒸气
一、汽化和液化
汽化:由液态到气态的过程 蒸发:在液体表面进行的汽化过程 沸腾:在液体表面及内部进行的强烈汽化过程。
(气体和液体均处在饱和状态下)
液化:由气相到液相的过程
二、饱和状态
饱和压力和饱和温度是一一对应的,两者 间存在单值关系。
从未饱和液状态达到饱和状态既可以保持压力不变 而提高温度,使p=ps(t) ;保持温度不变而使压力下 降,使t=ts(p)。
则该热机是可逆热机; 则该热机是不可逆热机; 则该热机是制造不出来的。
四、克劳修斯积分不等式
T
q
0
一切可逆循环的克劳修斯积分等于零,一切 不可逆循环的克劳修斯积分小于零,任何循 环的克劳修斯积分都不会大于零。 可以利用来判断一个循环是否能进行,是可
逆循环,还是不可逆循环。
五、闭口系统熵方程
s ds
1
2
c p ln
T2 p R ln 2 T1 p1
p2 v2 cV ln c p ln p1 v1
δq ds T R
必须可逆
第四章 理想气体 的热力过程及气体压缩
一、多变过程
1. 过程方程:
pvn const
n 称为多变指数
n 、0、1、 分别为定容、定压、定温、绝热过程
2、什么样的气体可以处理为理想气体?
任何实际气体在高温低压时,均具有理想气体 性质。
3、理想气体状态方程
pv RT pV mRT pVm R 0T pV nR0T
1 kg 理想气体 m kg 理想气体 1 mol 理想气体 n mol 理想气体
R为气体常数(单位J/kg· K),与气体所处的状态无 关,随气体的种类不同而异。 R0为通用气体常数(单位J/mol· K),与气体种类无 关、 与状态无关 、 与过程无关。
热工基础(张学学--第三版)复习知识点

热工基础(第三版)张学学复习提纲第一章基本概念1.工程热力学是从工程角度研究热能与机械能相互转换的科学。
2.传热学是研究热量传递过程规律的一门科学。
3.工质:热能转换为机械能的媒介物。
4.热力系统:选取一定的工质或空间作为研究对象,称之为热力系统,简称系统。
5.外界(或环境):系统之外的一切物体。
6.边界:系统与外界的分界面。
7.系统的分类:(1)闭口系统:与外界无物质交换的系统。
(2)开口系统:与外界有物质交换的系统。
(3)绝热系统:与外界之间没有热量交换的系统。
(4)孤立系统:与外界没有任何的物质交换和能量(功、热量)交换。
8.热力状态:系统中的工质在某一瞬间呈现的各种宏观物理状况的总和称为工质(或系统)的热力状态,简称为状态。
9.平衡状态:在不受外界影响的条件下,工质(或系统)的状态参数不随时间而变化的状态。
10.基本状态参数:压力、温度、比容、热力学能(内能)、焓、熵。
11.表压力Pg、真空度Pv、绝对压力PP g = P - P b P v = P b - P12.热力学第零定律(热平衡定律) :如果两个物体中的每一个都分别与第三个物体处于热平衡,则这两个物体彼此也必处于热平衡。
13.热力过程:系统由一个状态到达另一个状态的变化过程。
14.准平衡过程(准静态过程):热力过程中,系统所经历的每一个状态都无限地接近平衡状态的过程。
15.可逆过程:一个热力过程完成后,如系统和外界能恢复到各自的初态而不留下任何变化,则这样热力过程称为可逆过程。
16.不可逆因素:摩擦、温差传热、自由膨胀、不同工质混合。
17.可逆过程是无耗散效应的准静态过程。
18.系统对外界做功的值为正,外界对系统做功的值为负。
系统吸收热量时热量值为正,系统放出热量时热量值为负。
第二章热力学第一定律1.热力学第一定律:在热能与其它形式能的互相转换过程中,能的总量始终不变。
也可表述为:不花费能量就可以产生功的第一类永动机是不可能制造成功的。
工程热力学第三版 沈维道编 课件第1和第2章

第一章 基本概念 1-1 热能在热机中转变成机械能的过程 燃料——热能——动力 热能动力装置: 1蒸汽动力装置; 2燃气动力装置 工质:实现热能——机械能转化的媒介 高温热源(热源):工质从中吸取热能的物系 低温热源(冷源):接受工质排除热能的物系 热能动力装置工作过程:工质从热源获得热能, 做功,排除余下的热能给低温热源。
二状态方程式 T=T(p,v),p=p(T,v),v=v(p,t) F=F(p,v,T) 三坐标图 p-v图,T-s图 1-5 工质的状态变化过程 一准平衡过程(准静态过程) 相对缓慢,工质再平衡破坏后自动恢复平衡所需时间又很 短。 工质与外界的压力差无限小;温差无限小。 二 可逆过程和不可逆过程
二、压气机:动能差和势能差忽略 wc=-wi=(h2-h1)+(-q)=-wt 三、换热器:无功的交换 q=h2-h1 四、管道:
• 在分析中,取其进、出口截面间的流体为热力 系,并假定流动是稳定的。喷管实际流动过程 的特征是:气流迅速流过喷管,其散热损失甚 微,可认为Q =0;气流流过喷管时无净功输入 或输出,Wnet=0;进、出口气体的重力位能差 可忽略, 。将上述条件代入得到:对1kg流体 而言,(cf22-cf12)/2=h1-h2 • 喷管中气流宏观动能的增加是由气流进、出口 焓差转换而来。
边界:实际的或假想的;不动的和变形的。 闭口系:只有能量交换而无物质交换,又叫控制质量。 开口系:即有物质交换又有能量交换。又叫控制容积。 绝热系统:与外界无热量交换。 孤立系统:即无物质交换又无能量交换。 简单可压缩系:最常见的热力系,由可压缩流体构成,与 外界功的交换只有容积变化功。 1-3 工质的热力学状态及其基本状态参数 热力学状态:某一瞬间宏观物理状况,压力 P、温度 T 、 体积V、热力学能U、焓H、熵S。 一温度 微观:物质分子运动的积累程度。Mc2/2=BT t=T-273.15k
工程热力学第二章
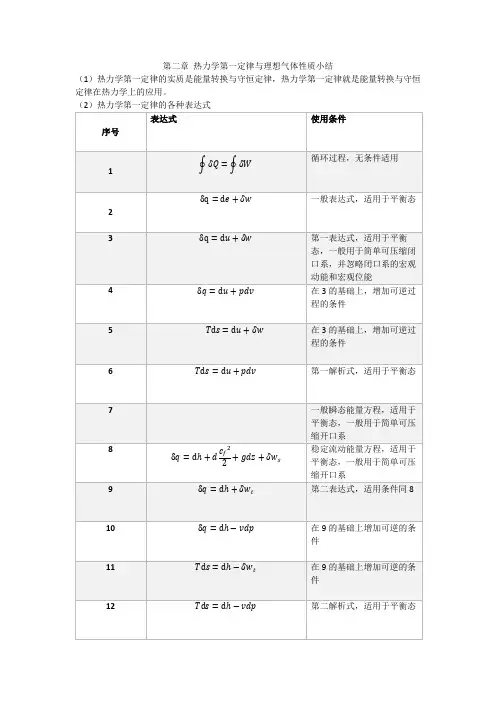
为内部储存能 U 与外部储存能之 和 它包括组成物体 的所有微观粒子 所具有的能量 随工质进出开口 系所转移的能量 闭口系与外界交 换的功
也称总储存能
热力学能 描述热 力系能 量的概 念 描述热 力系与 外界作 的概念
U 是热力系内部工质的 能量 H = U + pV
包括内热能,化学能,原子核能
焓
焓的变化等于热力系在定压过程中与外界 交换的热量 1、 它是简单可压缩热力系所有功的源泉 2、 若过程逆,则W =
2 ������������������,又称压力功。 1
流动功
1、 对可逆过程 δ������ = ������d������,该式反应了热量的本质 2、 对任意过程δ������ = cdT,其中 c 为该过程
的比热容,也是过程量。该是只是热量 的计算式子。
(4)热力学第一定律的主要应用 名称 热力发动机 能量转换方程 主要应用领域
2 ������������������ 1
体积功
热力系通过体积变化 与外界交换的功
3、 否则外界获得多少功计算,是过程量 4、 往往是比闭口系所做的功 轴功 热力系通过轴旋转与 外界交换的功 它是工质发生跨越热 力系边界的宏观移动 时与外界所交换的功 开口系与外界所 交换的净功 ������������������������ = ������������ 它是工质进出开 口系所携带的能 量 1、 它是开口系与外界交换的功 2、 它是技术功的一部分,当忽略进出口动 能、位能差时就等于技术功 1、 流动功只取决于工质进出口的状态,不 是过程量 ������������ = ������2 ������2 − ������1 ������2 2、它是与流动相关的量,若是没有流 动则没有意义 3、经常和热力学能合并在 技术功 技术上可资利用的功 由流体的宏观位 能、宏观动能、轴 功组成 来自体积功,是体积功与流动功之差。 1、 对非稳定流动,有 ������������ = ������ − [������������������������ ������������ ������������������ − ������������������ ������������ ������������ ] 2、 对于稳定流动,则有 1 ������������ = ∆������������ 2 + ������∆������ + ������������ = ������ − ∆(������������) 2 3、 对于可逆稳定流动,则有 ������������ = − 热量 一个质量不变的热力 系, 不做功而通过边界 传递的能量 热力系与外界之 间通过温差传递 的热量
工程热力学第三版课后习题答案

工程热力学第三版课后习题答案【篇一:工程热力学课后答案】章)第1章基本概念⒈闭口系与外界无物质交换,系统内质量将保持恒定,那么,系统内质量保持恒定的热力系一定是闭口系统吗? 答:否。
当一个控制质量的质量入流率与质量出流率相等时(如稳态稳流系统),系统内的质量将保持恒定不变。
⒉有人认为,开口系统中系统与外界有物质交换,而物质又与能量不可分割,所以开口系不可能是绝热系。
这种观点对不对,为什么?答:不对。
“绝热系”指的是过程中与外界无热量交换的系统。
热量是指过程中系统与外界间以热的方式交换的能量,是过程量,过程一旦结束就无所谓“热量”。
物质并不“拥有”热量。
一个系统能否绝热与其边界是否对物质流开放无关。
⒊平衡状态与稳定状态有何区别和联系,平衡状态与均匀状态有何区别和联系?答:“平衡状态”与“稳定状态”的概念均指系统的状态不随时间而变化,这是它们的共同点;但平衡状态要求的是在没有外界作用下保持不变;而平衡状态则一般指在外界作用下保持不变,这是它们的区别所在。
⒋倘使容器中气体的压力没有改变,试问安装在该容器上的压力表的读数会改变吗?在绝对压力计算公式p?pb?pe(p?pb); p?pb?pv(p?pb)中,当地大气压是否必定是环境大气压?答:可能会的。
因为压力表上的读数为表压力,是工质真实压力与环境介质压力之差。
环境介质压力,譬如大气压力,是地面以上空气柱的重量所造成的,它随着各地的纬度、高度和气候条件不同而有所变化,因此,即使工质的绝对压力不变,表压力和真空度仍有可能变化。
“当地大气压”并非就是环境大气压。
准确地说,计算式中的pb 应是“当地环境介质”的压力,而不是随便任何其它意义上的“大气压力”,或被视为不变的“环境大气压力”。
⒌温度计测温的基本原理是什么?答:温度计对温度的测量建立在热力学第零定律原理之上。
它利用了“温度是相互热平衡的系统所具有的一种同一热力性质”,这一性质就是“温度”的概念。
⒍经验温标的缺点是什么?为什么?答:由选定的任意一种测温物质的某种物理性质,采用任意一种温度标定规则所得到的温标称为经验温标。
工程热力学第三版曾丹苓第二章习题及答案

⼯程热⼒学第三版曾丹苓第⼆章习题及答案热⼒学第⼆章习题及答案⼀、是⾮题1、任意过程只要知道其始末状态即可确定过程与外界的热交换(x)、功交换(x)及系统热⼒学能的变化(√)。
2、简单可压缩系统任意过程中对外所作膨胀功均可⽤计算(√)。
pdV计算(x),⽤?dWpsurr3、流动功Δ(pdV)只有在开⼝系统中研究⽓体流动时才需要考虑(√)。
4、q和w是状态参数(x)⼆、选择题1、表达式δQ=dU+δW c 。
(a)适⽤于任意热⼒过程;(b)仅适⽤于准静态过程;(c)仅适⽤于闭⼝系统中的热⼒过程。
2、表达式δQ=dU+pdV适⽤ a1中的 a2。
(a1)闭⼝系;(b1)开⼝系;(c1)闭⼝及开⼝系;(a2)准静过程;(b2)任意热⼒过程;(c2)⾮准静过程。
3、任意准静或⾮准静过程中⽓体的膨胀功均可⽤ b 计算。
(a)pdV;(b)p surr dV;(c)d(pv)。
4、在正循环中?Qδa零,同时?Wδa零。
在逆循环中?Qδ c 零,且?Wδ c 零(a)⼤于;(b)等于;(c)⼩于。
三、习题2-1 0.5kg 的⽓体,在汽缸活塞机构中由初态p 1=0.7MPa 、V 1=0.02m 3,准静膨胀到V 2=0.04m 3。
试确定在下列各过程中⽓体完成的功量及⽐功量;(1)定压过程;(2) pV 2=常数。
解:(1)由准平衡过程体积变化功的表达式,当为定压过程时:W=p △V=0.7×106×0.02=14000 J=14 kJ ⽐功量 w= p △v=W/m=14000/0.5=28000 J=28 kJ(2)pV 2=0.7×106×0.022=280 J 〃m 3由准平衡过程体积变化功的表达式W=dV V pdv v v ??=04.002.0228021=7000 J=7 kJ⽐功量 w= p △v=W/m=7000/0.5=14000 J=14 kJ 2-2为了确定⾼压下稠密⽓体的性质,取2kg ⽓体在25MPa 下从350K 定压加热到370K ,⽓体初终状态下的容器分别为0.03 m3及0.035 m 3,加⼊⽓体的热量为700kJ ,试确定初终状态下的热⼒学能之差。
工程热力学第二章
功 热
热是无条件的; 功是有条件、限度的。
12
3、流动功:系统维持流动 所花费的代价。
p2v2 p1v1 ( [ pv])
推动功在p-v图上:
13
4、焓(enthalpy)
定义:H=U+pV 单位:J(kJ)
焓是状态参数
物理意义: 引进或排出工质而输入或排出系统的总能量。
h=u+pv J/kg(kJ/kg)
说明
• 对稳定流动的工质加入热量,可能产生的 结果是改变工质内能、动能、位能或三相 同时发生变化。 • 供给工质克服阻力而作流动净功和对外输 出功。 • 使用范围:
任何过程 任何工质
稳定能量方程式分析与讨论:
(A)
1)改写(B)为(C) 输出轴功
1 2 2 Ws q u p1v1 p2 v2 c1 c2 g z1 z2 (C) 2
W 0
?
U 0
即U1 U 2
强调:功是通过边界传递的能量。
21
如图,气缸内充以空气,活塞及负载195kg,缸 壁充分导热,取走100kg负载,待平衡后,求: (1)活塞上升的高度h (2)气体在过程中作的功,已知ukJ/kg 0.72 T K
解:取缸内气体为热力系—闭口系。 分析:突然取走100kg负载, 气体失去平衡,振荡后最终建 立新的平衡。虽不计摩擦,但 由于非准静态,故过程不可逆, 但仍可应用第一定律解析式。 首先计算状态1及2的参数:
五、稳定流动能量方程 (steady-flow energy equation)
稳定流动:是指热力系统在任意截面上工质的一切 参数都不随时间变化
注意:区分各截面间参数可不同。
31
工程热力学第二章整理知识点第三版
工程热力学第三版第二章热力学第一定律热力学第一定律 ( 能量守恒与转换定律) :自然界中的一切物质都具有能量 ,能量不可能被创造,也不可能被消灭;但能量可以从一种形态转变为另一种形态 , 且在能量的转化过程中能量的总量保持不变。
它确定了热力过程中热力系与外界进行能量交换时 , 各种形态能量数量上的守恒关系。
能量是物质运动的度量。
分子运动学说阐明了热能是组成物质的分子、原子等微粒的杂乱运动———热运动的能量。
根据气体分子运动学说, 热力学能是热力状态的单值函数。
在一定的热力状态下 , 分子有一定的均方根速度和平均距离 , 就有一定的热力学能 , 而与达到这一热力状态的路径无关 ,因而热力学能是状态参数。
由于气体的热力状态可由两个独立状态参数决定 , 所以热力学能一定是两个独立状态参数的函数, 如: u = f( T, v)或u =f( T, p) ; u = f( p, v)能量传递方式 : 作功和传热。
作功来传递能量总是和物体的宏观位移有关。
功的形式除了膨胀功或压缩功这类与系统的界面移动有关的功外 ,还有因工质在开口系统中流动而传递的功 ,这种功叫做推动功。
对开口系统进行功的计算时需要考虑这种功。
开口系统和外界之间功的交换。
取燃气轮机为一开口系统 , 当 1 kg 工质从截面 1 - 1流入该热力系时,工质带入系统的推动功为 p 1 v 1 ,工质在系统中进行膨胀,由状态1膨胀到状态2,作膨胀功 w,然后从截面 2 - 2流出,带出系统的推动功为p 2 v 2。
推动功差( pv) = p 2 v 2 -p 1 v 1是系统为维持工质流动所需的功, 称为流动功(系统为维持工质流动所需的功)。
在不考虑工质的动能及位能变化时, 开口系与外界交换的功量是膨胀功与流动功之差w -( p 2 v 2- p 1 v 1 );若计及工质的动能及位能变化, 则还应计入动能差及位能差。
热能和机械能的可逆转换总是与工质的膨胀和压缩联系在一起的。
工程热力学第二章
n
i
i
混合气体的折合气体常数
R R = eq Meq R nR ∑ni Mi R ∑mR i i i = 0= 0= = m m m m n = ∑gi R i
五、分压力的确定
piV = ni R T pi ni 0 = = xi 或 pi = xi p = ri p pV = nR T p n 0
混 合 气 体 第i种组成气体 相对成分
m mi
n ni
V Vi
相对成分= 相对成分=
分 总
量 量
质量分数:
摩尔分数:
体积分数:
m gi = i , m ni xi = , n V r= i, i V
∑g =1
i
∑x =1
i
∑r =1
i
Vi为分体积
gi、xi、ri的转算关系
V ni i = ⇒xi = r i V n
=q02-q01
= ∫ cdt − ∫ cdt
0 0 t2 t1
= c 0 ⋅ t2 − c 0 ⋅ t1
t2 t1
c 0 , c 0 表示温度自 °C到t1和0°C到t2的平均比热容. 0
t2 t1
q ct = 1 t2 −t1
t2
∫ = ∫ =
t
t2
t1
cdt
t2
t2 −t1
0 t1
cdt + ∫ cdt
通用气体常数不仅与气体状态无关,与气 体的种类也无关 R =8.314J /(mol ⋅ K)
0
气体常数与通用气体常数的关系:
m pV = nR T = R T 0 0 M pV = mR T
R0 R= 或 R0 = M R M
热工基础(张学学 第三版)复习知识点
式
数间的关系
交换的功量
w /( J / kg) wt /( J / kg)
交换的热 量
q /(J / kg)
定容 v 定数 定压 p 定数 定温 pv 定数
定熵 pvk 定数
v2
v1;
T2 T1
p2 p1
p2
p1
;
T2 T1
v2 v1
T2
T1;
p2 p1
v1 v2
p2 p1
1.理想气体:理想气体分子的体积忽略不计;理想气体分子之间
无作用力;理想气体分子之间以及分子与容器壁的碰撞都是弹性
碰撞。
2.理想气体状态方程式(克拉贝龙方程式)
PV mRgT
其中 R 8.314J /(mol K ),
或 PV nRT
RgΒιβλιοθήκη R M3.定容比热与定压比热。
定容比热 cV
wt
1 2
c f
2
gz
ws
当 p2v2 p1v1 时,技术功等于膨胀功。
当忽略工质进出口处宏观动能和宏观位能的变化,技术功就
是轴功;且技术功等于膨胀功与流动功之差。
在工质流动过程中,工质作出的膨胀功除去补偿流动功及宏
观动能和宏观位能的差额即为轴功。
7.可逆过程的技术功:
wt
2
vdp
6.边界:系统与外界的分界面。
7.系统的分类:
(1)闭口系统:与外界无物质交换的系统。
(2)开口系统:与外界有物质交换的系统。
(3)绝热系统:与外界之间没有热量交换的系统。
(4)孤立系统:与外界没有任何的物质交换和能量(功、热量)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工程热力学第三版
沈维道蒋智敏童钧耕合编
第二章热力学第一定律
热力学第一定律(能量守恒与转换定律):自然界中的一切物质都具有能量, 能量不可能被创造, 也不可能被消灭;但能量可以从一种形态转变为另一种形态,且在能量的转化过程中能量的总量保持不变。
它确定了热力
过程中热力系与外界进行能量交换时,各种形态能量数量上的守恒关系。
能量是物质运动的度量。
分子运动学说阐明了热能是组成物质的分子、原子等微粒的杂乱运动———热运动的能量。
根据气体分子运动学说,热力学能是热力状态的单值函数。
在一定的热
力状态下, 分子有一定的均方根速度和平均距离, 就有一定的热力学能, 而与达到这一热力状态的路径无关,因而热力学能是状态参数。
由于气体的热力状态可由两个独立状态参数决定, 所以热力学能一定是两个独立状态参数的函数,如: u = f( T, v) 或 u = f( T, p) ; u = f( p, v)
能量传递方式:作功和传热。
作功来传递能量总是和物体的宏观位移有关。
功的形式除了膨胀功或压缩功这类与系统的界面移动有关的功外, 还有因工质在开口系统中流动而传递的功, 这种功叫做推动功。
对开口系统进行功的计算时需要考虑这种功。
开口系统和外界之间功的交换。
取燃气轮机为一开口系统,当1 kg工质从截面 1 - 1 流入该热力系时, 工质带入系统的
推动功为 p 1 v 1 , 工质在系统中进行膨胀, 由状态 1 膨胀到状态 2, 作膨胀功 w,
然后从截面 2 - 2 流出, 带出系统的推动功为 p 2 v 2 。
推动功差
Δ( pv) = p 2 v 2 -
p 1 v 1 是系统为维持工质流动所需的功,称为流动功(系统为维持工质流动所需的功)。
在不考虑工质的动能及位能变化时,开口系与外界交换的功量是膨胀功与流动功之差w - ( p 2 v 2
- p 1 v 1 );若计及工质的动能及位能变化,则还应计入动能差及位能差。
热能和机械能的可逆转换总是与工质的膨胀和压缩联系在一起的。
焓( H)即H = U + pV ,焓的单位是 J,焓是一个状态参数。
h = u + pv = f( p, v)
焓也可以表示成另外两个独立状态参数的函数,
即h = f( p, T) , h = f( T, v)
同样还有
热力学第一定律应用于闭口系而得的能量方程式,是最基本的能量方程式, 叫做热力学第一定律的解析式。
它适用于可逆过程也适用于不可逆过程。
对工质性质也没有限制,无论是理想气体还是实际气体, 甚至是液体都适用。
为了确定工质初态和终态热力学能的值,要求工质初态和终态是平衡状态。
系统吸热Q 为正,系统对外作功 W 为正;反之则为负。
系统的热力学能增大时,ΔU 为正,反之为负。
对于可逆过程,
意即闭口系完成一个循环后,它在循环中与外界交换的净热量等于与外
界交换的净功量。
用 Q net 和 W net 分别表示循环净热量和净功量,则有
稳定流动过程:流动过程中开口系统内部及其边界上各点工质的热力参数及运动参数都
不随时间而变。
W i 表示工质在机器内部对机器所作的功, 称做内部功。
稳定流动能量方程式:
W i 表示工质在机器内部对机器所作的功, 称做内部功。
它是根据能量守恒与转换定律导出的,除流动必须稳定外无任何附加条件, 故而不论系统内部如何改变,有无扰动或摩擦, 均能应用,是工程上常用的基本公式之一。
稳定流动能量方程式的分析
和 gΔz 是工质机械能的变化;第三项Δ( pv)是维持工质流动所需的流动功; 第四项 w i 是工质对机器作的功。
它们均源自于工质在状态变化过程中通过膨胀而实施的热能转变成的机械能。
等式左边是工质在过程中的容积变化功。
若 d p 为负, 即过程中工质压力降低,则技术功为正, 此时工质对机器作功;
反之机器对工质作功。
蒸汽轮机、燃气轮机属于前一种情况, 活塞式压气机和叶轮式压气机属于
后一种情况。
引进技术功概念后, 稳定流动能量方程式
一、动力机
工质流经汽轮机、燃气轮机等动力机(图 2 - 5)时, 压力降低, 对机
器作功; 进口和出口的速度相差不多,动能差很小, 可以不计;对外界略有散热损失, q 是负的,但数量通常不大, 也可忽略;位能差极微, 可以不计。
把这些条件代入稳定流动能量方程式
(2 - 16), 可得1 kg工质对机器所作的功为w i = h 1 - h 2 = w t。
二、压气机
三、换热器
工质流经锅炉、回热器等热交换器(图 2 - 7)时和外界有热量交换而
无功的交换,动能差和位能差也可忽略不计。
若工质流动是稳定的, 从式(2 - 16)可得 1 kg工质的吸热量为
q = h 2 - h 1
四、管道
工质流经诸如喷管、扩压管等这类设备(图 2 - 8)时, 不对设备作功, 位能差很小, 可不计;因喷管长度短, 工质流速大,
来不及和外界交换热量, 故热量交换也可忽略不计。
若流动稳定,则用式(2 - 16)可得1 kg工质动能的增加为
五、节流
工质流过阀门(图 2 - 9)时流动截面突然收缩, 压力下降, 这种流动称
为节流。
由于存在摩擦和涡流, 流动是不可逆的。
在离阀门不远的两个截面处, 工质的状态趋于平衡。
设流动是绝热的, 前后两截面间的动能差和位能差忽略不计, 又不对外界作功, 则对两截面间工质应用稳
定流动能量方程式
(2 - 16) , 可得节流前后焓值相等,即h 1 = h 2
热力学能是工质的状态参数,是工质内部储存的能量,是与状态变化过程无关的物理量。
热量是工质状态发生变化时通过系统边界传递的热能,其大小与变化过程有关,热量不是状态参数。
能否由基本能量方程式得出功、热量和热力学能是相同性质的参数的结论?
q= u+w
不能。
基本能量方程式仅仅说明且充分说明功、热量和热力学能都是能量,都是能量存在的一种形式,在能量的数量上它们是有等价关系的。
而不涉及功、热量和热力学能的其他属性,也表明功、热量和热力学能
的其他属性与能量本质无关。
热力学第一定律解析式两种形式:q=∆u+w 适用于
任意系统、任意工质和任意过程。
q=∆u+pdv 适用于任意系统、任意工质和可逆过程。
推动功:工质流动时,推动它下游工质时所作的功。
开口系工质流动,
而闭口系工质不流动,所以推动功出现在开口系能量方程中,而不出现
在闭口系能量方程式中。
焓是工质流入(或流出)开口系时传递入(或传递出)系统的总能量,那么闭口系工质有没有焓值?
作为工质的状态参数,闭口系工质也有焓值,但是由于工质不流动,所
以其焓值没有什么意义。
焓=热力学能+占位能。
