分析化学 第二章 定量分析的一般步骤
分析化学的定性和定量分析方法介绍

分析化学的定性和定量分析方法介绍分析化学是研究物质组成、结构和性质的科学,它广泛应用于各个领域,如环境监测、食品安全、医学诊断等。
在分析化学中,定性和定量分析是两个重要的方法。
本文将介绍这两种方法的基本原理和常用技术。
定性分析是确定物质组成和性质的方法。
它主要依靠观察和实验现象,通过对样品的颜色、形状、气味等特征进行分析,来推断其组成和性质。
其中,常用的定性分析方法包括颜色反应、沉淀反应和气体反应等。
颜色反应是一种常见的定性分析方法。
它基于物质在不同条件下的颜色变化来判断其组成和性质。
例如,当某种物质与特定试剂反应时,会产生明显的颜色变化,从而可以确定其存在与否。
这种方法常用于食品中添加剂的检测和药物的分析。
沉淀反应是另一种常用的定性分析方法。
它基于物质在溶液中形成沉淀的特性来判断其组成和性质。
例如,当某种物质与特定试剂反应时,会产生不溶于溶液的沉淀物,从而可以确定其存在与否。
这种方法常用于金属离子的检测和无机盐的分析。
气体反应是定性分析中的重要方法之一。
它基于物质在与气体反应时产生的气味、气体的颜色等特征来判断其组成和性质。
例如,当某种物质与特定气体反应时,会产生特殊的气味或颜色变化,从而可以确定其存在与否。
这种方法常用于有机物的鉴定和气体的检测。
与定性分析相对应的是定量分析,它是确定物质含量和浓度的方法。
定量分析主要依靠测量和计算,通过对样品的质量、体积、光谱等进行分析,来推断其含量和浓度。
其中,常用的定量分析方法包括重量法、容量法和光谱法等。
重量法是一种常见的定量分析方法。
它基于物质质量与含量之间的关系来确定样品的含量。
例如,通过称量样品和标准物质的质量,再根据它们的化学计量关系,可以计算出样品中目标物质的含量。
这种方法常用于药物含量的测定和环境样品的分析。
容量法是另一种常用的定量分析方法。
它基于物质体积与含量之间的关系来确定样品的含量。
例如,通过使用滴定法,将一种已知浓度的溶液滴加到待测样品中,直到反应终点出现颜色变化,从而可以计算出样品中目标物质的含量。
定量分析实验

——1.3实验室安全常识
1.3.1 实验室用水安全
使用自来水后要及时关闭阀门,尤其遇突然停 水时,要立即关闭阀门,以防来水后跑水。离开 实验室之前应再检查自来水阀门是否完全关闭 (使用冷凝器时较容易忘记关闭冷却水)。
1.3.2 实验室用电安全
——1.3实验室安全常识
实验室用电有十分严格的要求,不能随意, 必须注意以下几点:
——1.1分析化学实验用水
化学分析法中,除络合滴定必须用去离子水 外,其它方法均可采用蒸馏水。分析实验用的纯 水必须注意保持纯净、避免污染。通常采用以聚 乙烯为材料制成的容器盛载实验用纯水。
1.2 常用试剂的规格及试剂的使用和保存
分析化学实验中所用试剂的质量,直接影响 分析结果的准确性,因此应根据所做试验的具体 情况,如分析方法的灵敏度与选择性,分析对象 的含量及对分析结果准确度的要求等,合理选择 相应级别的试剂,在既能保证实验正常进行的同 时,又可避免不必要的浪费。
(2)加热易燃试剂时,必须使用水浴、油浴或电 热套,绝对不可使用明火。 (3)若加热温度有可能达到被加热物质的沸点, 则必须加入沸石(或碎瓷片),以防暴沸伤人, 实验人员不应离开实验现场。 (4)用于加热的装置,必须是规范厂家的产品, 不可随意使用简便的器具代用。
——1.3实验室安全常识
如果在实验过程发生火灾,第一时间要做 的是:将电源和热源(或煤气等)断开。起火 范围小可以立即用合适的灭火器材进行灭火, 但若火势有蔓延趋势,必须同时立即报警。
(1)所有电器必须由专业人员安装; (2)不得任意另拉、另接电线用电; (3)在使用电器时,先详细阅读有关的说明书及
资料,并按照要求去做;
——1.3实验室安全常识
(4)所有电器的用电量应与实验室的供电及用电 端口匹配,决不可超负荷运行,以免发生事故。 谨记:任何情况下发现用电问题(事故)时,首 先先关电源! (5)发生触电事故的应急处理:如若遇触电事故, 应立即使触电者脱离电源——拉下电源或用绝缘 物将电源线拔开(注意千万不可徒手去拉触电者, 以免抢救者也被电流击倒)。同时,应立即将触 电者抬至空气新鲜处,
定量分析基本操作介绍

实验原理
• 根据定量关系,4份样品将产生3份质子和1份 质子化的盐,要消耗4份NaOH,相当于1∶1。
• 由此可得计算公式为:
N%
CNaOH
VNaOH W
MN
100
• 根据有效数字的要求,MN应取14.01。
定量分析基本操作介绍
分析化学部分的实验内容,而分析化学是确定物
质组成、结构及各组分在其中的含量的一门学科。
按其任务可分为定性分析、定量分析和
结构分析。
特点——量化,特别强调“量”的概念。
为得到一个好的结果,要做到如下几点: ※ 必须正确和熟练地掌握实验的基本操作; ※ 正确地记录实验数据,注意“有效数字”的概念; ※ 正确地按照数据处理方法对实验结果进行运算、处 理。分析误差产生的原因。
②减量法:也称差减法。此法适用于称取易吸水、易氧 化或易与CO2反应的物质。
称量方法:将上法中称量纸改为称量瓶即可进行减量法 称量,只是最后显示的数字是负值。从称量瓶中倾出样
品的方法见下图。
减量法
称量步骤:(1)取下天平罩,叠好置天平旁(2)检查 (3)开机 (4)放入称量瓶(5) 扣零 (6)差减称量 (7)结束工作*(复原、签名)
(a)
(b)
(c)
一、有关实验的基本操作
(一)玻璃器皿及其洗涤
玻璃器皿分类:
性能
可加热的,如各类烧杯、烧瓶、锥形瓶、试管等 不宜加热的,如量筒、容量瓶、试剂瓶等
用途
容器类,烧杯、试剂瓶等 量器类,如滴定管、移液管、容量瓶 特殊用途类,如干燥器、漏斗
常 用 的 玻 璃 器 皿
分析化学第四版第_02_章_分析试样的采取和预处理

四、气体试样的采取 • 气体试样的采取 对于气体试样的采取,亦需按 • 具体情况,采用相应的方法。例如大气样品的采取,通常 • 选择距地面50-180厘米的高度采样、使与人的呼吸空气 • 相同。对于烟道气、废气中某些有毒污染物的分析,可将 • 气体样品采入空瓶或大型注射器中。 • • 大气污染物的测定是使空气通过适当吸收剂,由吸收剂 • 吸收浓缩之后再进行分析。 • • 在采取液体或气体试样时,必须先把容器及通路洗涤,再 用要采取的液体或气体冲洗数次或使之干燥,然后取样以 免混入杂质。
采样深度
采样量 保存
4
of
12
• (三)金属或金属制品试样: 经高温熔炼,比较均匀, 钢片可任取。对钢锭和铸铁,钻取几个不同点和深度取样 ,将钻屑置于冲击钵中捣碎混匀作分析试样。由于金属经 过高温熔炼,组成比较均匀,因此,于片状或丝状试样, 剪取一部分即可进行分析。但对于钢锭和铸铁,由于表面 和内部的凝固时间不同,铁和杂质的凝固温度也不一样, 因此,表面和内部的组成是不很均匀的。取样时应先将表 面清理,然后用钢钻在不同部位、不同深度钻取碎屑混合 均匀,作为分析试样。 • 对于那些极硬的样品如白口铁、硅钢等,无法钻取,可 用铜锤砸碎之,再放入钢钵内捣碎,然后再取其一部分作 为分析试样。
大气试样 : 静态气体试样 直接采样,用换气或减压的方 法将气体试样直接装入玻璃瓶或塑料瓶中或者直接与气体 分析仪连接 动态气体试样 采用取样管取管道中气体,应插入管道1/3 直径处,面对气流方向 常压,打开取样管旋塞即可取样。若为负压,连接抽气泵 ,抽气取样 固体吸附法取样 用装有吸附剂如硅胶(吸附带氨基、羟 基的气体)、活性炭(吸附苯、四氯化碳) 、活性氧化 铝和分子筛等的柱子吸附气体,吸附的气体用加热法或萃 取法解脱,或与GC连接检测 对于大气粉尘采用过滤式、冲击式和静电式取样,过滤式 最普遍---采用玻璃纤维素纤维(0.3 mm)过滤
《定量分析的任务、分类和步骤》测试题及答案
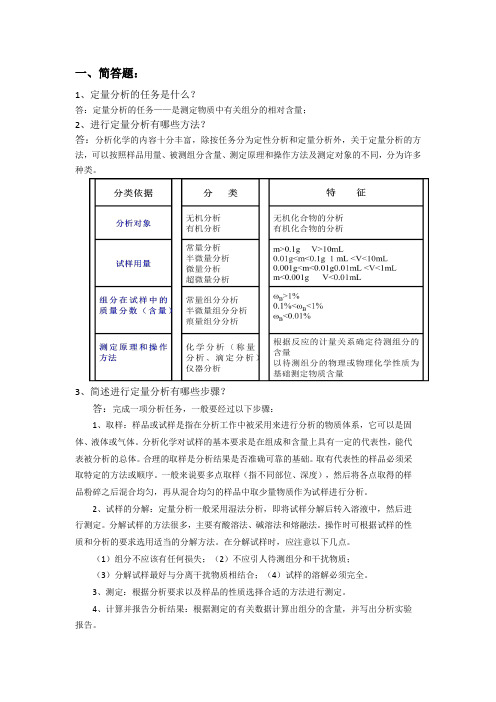
一、简答题:
1、定量分析的任务是什么?
答:定量分析的任务——是测定物质中有关组分的相对含量;
2、进行定量分析有哪些方法?
答:分析化学的内容十分丰富,除按任务分为定性分析和定量分析外,关于定量分析的方法,可以按照样品用量、被测组分含量、测定原理和操作方法及测定对象的不同,分为许多种类。
3、简述进行定量分析有哪些步骤?
答:完成一项分析任务,一般要经过以下步骤:
1、取样:样品或试样是指在分析工作中被采用来进行分析的物质体系,它可以是固体、液体或气体。
分析化学对试样的基本要求是在组成和含量上具有一定的代表性,能代表被分析的总体。
合理的取样是分析结果是否准确可靠的基础。
取有代表性的样品必须采取特定的方法或顺序。
一般来说要多点取样(指不同部位、深度),然后将各点取得的样品粉碎之后混合均匀,再从混合均匀的样品中取少量物质作为试样进行分析。
2、试样的分解:定量分析一般采用湿法分析,即将试样分解后转入溶液中,然后进行测定。
分解试样的方法很多,主要有酸溶法、碱溶法和熔融法。
操作时可根据试样的性质和分析的要求选用适当的分解方法。
在分解试样时,应注意以下几点。
(1)组分不应该有任何损失;(2)不应引人待测组分和干扰物质;
(3)分解试样最好与分离干扰物质相结合;(4)试样的溶解必须完全。
3、测定:根据分析要求以及样品的性质选择合适的方法进行测定。
4、计算并报告分析结果:根据测定的有关数据计算出组分的含量,并写出分析实验报告。
无机及分析化学第2章-分析化学概论

(四)异常值的取舍 2.异常值的取舍方法
Q值检验法的基本步骤如下:
①将测定数据从小到大排列:x1,x2 , x3 ,…, xn-1, xn。其中x1和 xn 为异常值,xn—x1称为极差。
②求出异常值与邻近值之差x2—x1或xn—xn-1。 ③将异常值与相邻的一个数值的差,除以最大值与最小值之差(常
物理化学的溶液理论发展,推动化学分析快速发展
用物理化学中的溶液平衡理论、动力学等研究分析 化学中的基本理论问题:沉淀的形成和共沉淀;指示 剂变色原理;滴定曲线和终点误差;缓冲原理及催化 和诱导反应等。建立了溶液中四大平衡理论。
第二个重要阶段: 20世纪40年代,仪器分析的发展。
分析化学与物理学及电子学结合的时代。
二、分析结果的数据处理
(一)有效数字 有效数字是指在分析工作中实际能测量到的数
字。它包括所有的准确数字和最后一位不确定的数字。 例如,读取滴定管上的刻度时,甲是24.55mL,乙是
24.54mL,丙是24.53mL,这三个数据中,有4位有 效数字,其中24.5是准确数字,而第4位数字是估计 数,是不确定的数字。
7、四大民间传说:;《梁山伯与祝英台》、《白蛇 传》、《牛郎与织女》、《孟姜女》;
8、四大佛教名山:山西五台山(文殊菩萨道场)
、四川峨嵋山(普贤菩萨道场)、浙江普陀ቤተ መጻሕፍቲ ባይዱ(观 音菩萨道场)、安徽九华山(地藏菩萨道场);
9、四大名园:;颐和园、承德避暑山庄、苏州拙政 园、苏州留园;
10、四大名楼:;岳阳楼、腾王阁、黄鹤楼、蓬莱 阁;
一、定量分析 的误差
2.误差的减小方法 (1)选择合适的分析方法
(2)减小测量误差 (3)减小偶然误差 (4)检查和消除系统误差
《分析化学(第2版)电子教案》2.3定性分析的一般程序
通过定性分析,可以检测土壤中是否 存在有害物质,如农药残留、重金属 等,以评估土壤的健康状况。
检测空气中的有害气体
定性分析可以用于检测空气中的有害 气体,如硫化物、氮氧化物等,以评 估空气质量,预防环境污染。
在食品工业中的应用
食品添加剂的检测
定性分析可以用于检测食品中是否含有规定的添加剂,如防腐剂 、色素等,以确保食品的安全性。
操作繁琐度
一些定性分析方法步骤较为繁琐,需要操作人员 耐心细致地完成。
结果解释的局限性
干扰物质的影响
样品中存在的干扰物质可能影响结果的解释,如高含量的共存离 子。
结果判断的主观性
定性分析结果的判断具有一定的主观性,不同人员可能得出不同 的结论。
结果的置信度
由于定性分析方法的局限性和操作上的误差,可能导致结果的置 信度不高。
实验操作与观察
实验操作
按照实验步骤进行操作,如溶解、加 热、冷却、过滤等。
观察与记录
在实验过程中,密切观察实验现象, 如颜色变化、沉淀生成等,并记录实 验数据。
结果判断与解释
结果判断
根据实验现象和数据,判断待测组分是否存在,并确定其大致含量范围。
结果解释
结合实验数据和理论知识,对实验结果进行解释,得出结论,并评估实验的准确 性和可靠性。
食品中农药残留的检测
通过定性分析方法,可以检测食品中是否存在农药残留,以确保食 品的绿色、无污染。
食品中重金属的检测
定性分析可以用于检测食品中是否存在重金属,如铅、汞、镉等, 以防止重金属中毒。
在医学检验中的应用
药物成分的鉴定
01
定性分析可以用于鉴定药物中的主要成分,以确保药物的有效
性和安全性。
定量分析基础
微量滴定管: 准确至±0.001mL (小数点后三位)
2.5 有效数字及运算规则
3、“0”的作用:
作为数字用,是有效数字2.500、2.050
数据中的“0”是否为有效数字 作为定位用,不是有效数字0.0030
➢ 例如滴定管读数22.00毫升,两个“0”都是有效数字。如果改 为0.02200升,前面两个“0”仅作为定位用,不是有效数字, 而后面两个“0”为有效数字,仍为四位有效数字。
➢ 如需用尾数“0”用定位时,可用指数表示,以防止有效数字 的混淆,如25.0mg改写为μg时,应该写成2.50*104 μg ,不能写 成25000μg。 单位可以改变,但有效数字的位数不能改变,也就是说不能任
意增减有效数字。
记录时小数点后多写0,或少写个0意义是不同的,使测量 的精确程度无形中被夸大或缩小了10倍。
均匀
溶解
有代表性 熔融
符合实际 灰化
妥善保存
消除干扰 测定 计算 掩蔽 常量组分 分离 (>1%,化学法)
微量组分 (仪器分析法)
2.3 定量分析方法的一般过程
➢2.分析结果的表示方法
1)固体试样以质量分数表示:
mB B ms
mB为待测组分质量,ms为试样质量
2)液体试样以物质的量浓度表示:
cB
1-10
0.01-1
试样中各组分相对含量: 常量组分分析 (>1%) 微量组分分析 (0.01-1%) 痕量组分分析 (<0.01%)
按分析原理分类:
化学分析法、仪器分析
2.2 定量分析方法的分类
1、化学分析法
➢以物质的化学性质和化学反应为依据进行物质分析的方法,包 括重量分析法和滴定分析法。
第二章 定量分析一般步骤
过氧化钠 几乎所有矿石(钼矿、铬铁矿、黑钨 锆、镍、 矿、锆英石等) 墨 铵盐 方铅矿、黄铁矿、硫化矿等 瓷、TFE、 铂 KHSO4与 铌、钽酸盐,Fe、Ti、Al氧化物矿 瓷、石英、 K2S2O7 铂 KHF2与 锆石、绿柱石、铌钽酸盐 鉑、银 NH4HF2
偏硼酸锂 岩石,硅酸盐,土壤,陶瓷,钢渣等 石墨,铂
3、半熔法
又称为烧结法,它是在低于熔点的温度下,使试样 与熔剂发生反应。通常在瓷坩埚中进行。常用MgO 或ZnO与一定比例的Na2CO3混合物作为熔剂 用来分解铁矿及煤中的硫。其中MgO、ZnO的作用在 于其熔点高,可以预防Na2CO3在灼烧时熔合,而保 持松散状态,使矿石氧化得更快、更完全,反应产 生的气体容易逸出。
• 测定常量组分时,多采用滴定分析法和重 量分析法。滴定分析法简单迅速,在重量 分析法和滴定分析法均可采用的情况下, 一般选用滴定分析法。 • 测定微量组分别多采用灵敏度比较高的仪 器分析法。。
四、共存组分的影响
• 在选择分析方法时,必须考虑其他组分对 测定的影响,尽量选择特效性较好的分析 方法。如果没有适宜的方法,则应改变测 定条件,加入掩蔽剂以消除干扰,或通过 分离除去干扰组分之后,再进行测定。
3、固体试样
试样多样化,不均匀试样应,选取不同部位进行 采样,以保证所采试样的代表性。
固体试样制备
破碎和过筛
混合与缩分
平均试样采取量与试样的均匀度、粒度、易破碎度有关,可按 切乔特采样公式: Q≥Kd2 Q为保留样品的最小质量(kg) d为样品中最大颗粒直径(mm) K为固体试样特性系数或缩分常数,它由各部门根据经验拟定, 通常在0.05~1之间,因固体物料种类和性质不同而异。
碳酸钠与氯化铵也用于半熔融分解的溶剂。熔剂与 试样混匀置于鉄(或者镍) 坩埚内,在750-800℃左 右半熔融。主要用于硅酸盐中 K+、Na+的测定等。
第二章 定量分析的一般步骤和滴定分析概论
定量分析的一般步骤和滴定分析概论
4、湿存水的处理 、
11
湿存水是指试样表面及孔隙中吸附的空气中的 水分, 也称吸湿水。 水分, 也称吸湿水。其含量多少随试样的粉碎 程度和放置时间的长短而改变。 程度和放置时间的长短而改变。 随着吸湿水含量的变化,试样中各组分的相对 随着吸湿水含量的变化 , 含量也必然会发生变化。所以在进行测定之前, 含量也必然会发生变化 。 所以在进行测定之前 , 必须先将试样放进烘箱, 温度、 必须先将试样放进烘箱,在100-105℃烘干 温度、 ℃烘干(温度 时间可根据试样的性质而定, 时间可根据试样的性质而定 , 对于受热易分解 的物质可采用风干的方法)。 的物质可采用风干的方法 。
四川理工学院分析化学精品课程
5
定量分析的一般步骤和滴定分析概论
3、取样操作方法 、 (1)气体试样的采取 ) 例如大气试样的采取, 通常选择距地面50例如大气试样的采取 , 通常选择距地面 180cm的高度用抽气泵或吸筒采样, 使所采 的高度用抽气泵或吸筒采样, 的高度用抽气泵或吸筒采样 气样与人呼吸的空气相同。对于大气污染物 气样与人呼吸的空气相同。 的测定,则使空气通过适当的吸收剂, 的测定,则使空气通过适当的吸收剂,由吸 收剂吸收浓缩之后再进行测定。 收剂吸收浓缩之后再进行测定。
平均组成,否则分析结果再准确也毫无意义, 平均组成,否则分析结果再准确也毫无意义, 甚至会造成混乱和错误。 甚至会造成混乱和错误。
四川理工学院分析化学精品课程
定量分析的一般步骤和滴定分析概论
1、取样的一般步骤 、 收集粗样——即先从大批物料中采取最初试 收集粗样 即先从大批物料中采取最初试 原始试样); 样(原始试样 ; 原始试样 将粗样混合、粉碎、缩分, 将粗样混合、粉碎、缩分,减少到适合分析 所需的数量; 所需的数量; 制备成供分析用的最终试样(分析试样 。 制备成供分析用的最终试样 分析试样)。 分析试样
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章定量分析的一般步骤
一、分析试样的采集与制备
1.试样的采集与制备:是指从大批物料中采取少量的样本作为原始试样,然后再制备成供分析用的最终式样。
采样的基本原则:均匀、合理、具有代表性
试样的形态:气体、液体、固体
2.取样方法:
气体样品:集气法(eg.工厂废气中有毒气体的分析)、富集法(eg.大气污染物的测定、室内甲醛的含量测定)
固体样品:抽样样品法(“四角+中央”)、圆锥四分法
液体样品:混合均匀后按照上中下分层取样
二、试样的分解(预处理)
1.分解试样的原则:
①式样分解必须完全,处理后的溶液中不得残留原试样的细屑或粉末
②式样分解过程中待测组分不应挥发
③不应引入待测组分和干扰物质
2.分解方法:溶解法、熔融法、消解法
(1)溶解法:
水:例(NH4)2SO4中含氮量的测定
酸:HCl、H2SO4、HNO3、HF等及混合酸分解金属、合金、矿石等碱:例:NaOH溶解铝合金分析Fe、Mn、Ni含量
有机溶剂:相似相溶原理
(2)熔融法:
酸溶:K2S2O7、KHSO4溶解氧化物矿石
碱溶:Na2CO3、NaOH、Na2O2溶解酸性矿物质
(3) 消解法——测定有机物中的无机元素
湿法消解:通常用硝酸和硫酸混合物与试样一起置于克氏烧瓶中,一定温度下分解,属于氧化分解法常用试剂:HNO3、H2SO4、HClO4、H2O2和KMnO4等。
干法灰化:待测物质加热或燃烧后灰化、分解,余留残渣用适当的溶剂溶解。
适用范围:有机物和生物试样中金属元素、硫、卤素等无机元素。
常用方法:坩埚灰化法、氧瓶燃烧法和低温灰化法。
三、常用的分离、富集方法
1. 分离:让试样中的各组分互相分开的过程(纯化)
分离的作用:提高方法的选择性、提高方法的灵敏度、准确度
分离方法:沉淀分离、萃取分离、挥发分离、色谱分离
2. 富集:待测组分含量低于测定方法的检测限时,在分离时将其浓缩使其能被测定
富集方法:萃取富集、吸附富集、共沉淀富集
四、测定方法的选择
分析对象(样品性质、组分含量、干扰情况)→分析方法(准确度、
灵敏度、选择性、适用范围)→用户(用户对分析结果的要求和对分析费用的承受度)→成本(时间、人力、设备、消耗品)
五、分析结果的计算与评价
1. 分析结果的计算及评价的目的:判断分析结果的准确度、灵敏度、选择性等是否达到要求
2. 含量计算方法:根据分析过程中有关反应的化学计量关系及分析测量所得数据进行计算
3. 测定结果及误差分布情况的分析:可采取统计学方法进行评价,如平均值、相对标准偏差、置信度、显著性检查等。
