碱性蛋白质活性电泳胶配置
SDS-PAGE电泳试剂配制

SDS-PAGE电泳试剂配制SDSPAGE 电泳试剂配制在生物化学和分子生物学的研究领域中,SDSPAGE 电泳是一种常用的技术手段,用于分离和分析蛋白质。
而要成功进行 SDSPAGE 电泳实验,准确配制各种试剂是至关重要的一步。
接下来,让我们详细了解一下 SDSPAGE 电泳试剂的配制方法。
首先,我们来谈谈分离胶缓冲液的配制。
分离胶缓冲液通常使用TrisHCl 缓冲液,其 pH 值一般在 88 左右。
配制时,我们需要称取一定量的 Tris 碱,然后加入适量的浓盐酸进行调节 pH 值。
这个过程需要用到 pH 计来精确测量,以确保 pH 值的准确性。
一般来说,每升分离胶缓冲液中,Tris 的用量约为 1815g,而浓盐酸的用量则需要根据实际测量的 pH 值进行调整。
接下来是浓缩胶缓冲液的配制。
浓缩胶缓冲液的 pH 值通常为 68,同样使用 TrisHCl 缓冲液。
配制方法与分离胶缓冲液类似,但 Tris 的用量和浓盐酸的用量有所不同。
每升浓缩胶缓冲液中,Tris 的用量约为 606g,浓盐酸的用量也需要根据实际 pH 值测量结果进行微调。
然后是 30%丙烯酰胺溶液的配制。
这是 SDSPAGE 电泳中的关键试剂之一。
丙烯酰胺是一种有毒物质,在配制过程中需要特别小心。
我们将丙烯酰胺和甲叉双丙烯酰胺按照 29:1 的比例混合。
称取 29g 丙烯酰胺和 1g 甲叉双丙烯酰胺,加入适量的去离子水,搅拌溶解后,定容至 100ml。
需要注意的是,丙烯酰胺具有神经毒性,操作时应戴手套在通风橱中进行。
SDS 溶液的配制也不能马虎。
SDS 即十二烷基硫酸钠,是一种阴离子去污剂。
称取 10g SDS,加入适量的去离子水,加热搅拌溶解后,定容至 100ml。
10%过硫酸铵溶液是引发丙烯酰胺聚合的重要试剂。
称取 1g 过硫酸铵,加入 10ml 去离子水,现配现用。
因为过硫酸铵溶液不稳定,容易分解,所以不宜长时间保存。
电泳缓冲液也是必不可少的。
蛋白电泳缓冲液配方_概述及解释说明

蛋白电泳缓冲液配方概述及解释说明1. 引言1.1 概述蛋白电泳是一种常用的生物化学实验技术,广泛应用于蛋白质分离、测定和分析。
在进行蛋白电泳实验时,缓冲液的配方对实验结果至关重要。
良好的缓冲液能够提供适宜的环境条件,确保蛋白质在电场中稳定迁移,并且能够维持准确的酸碱度。
1.2 文章结构本文将从以下几个方面对蛋白电泳缓冲液配方进行综述和解释说明。
首先,我们会介绍蛋白电泳的基本原理,为后续讨论铺垫基础。
然后,我们会详细探讨缓冲液在蛋白电泳中的作用,以及常用蛋白电泳缓冲液配方的概述。
接着,我们会解释一些关键要点,如离子组成和pH值选择的重要性以及缓冲剂种类与浓度选择的影响。
最后,在文章结尾,我们会总结全文内容并得出相应结论。
1.3 目的本文旨在向读者介绍蛋白电泳缓冲液配方的相关知识,并解释其重要性和影响因素。
通过阅读本文,读者将能够了解蛋白电泳缓冲液的基本原理、作用以及常用配方,进而提高实验设计的准确性和结果的可靠性。
此外,我们还将针对蛋白电泳缓冲液制备过程中可能遇到的问题,提供解答和操作注意事项。
希望本文能够为读者在蛋白电泳实验中提供有益的参考和指导。
2. 蛋白电泳缓冲液配方2.1 蛋白电泳的基本原理在介绍蛋白电泳缓冲液配方之前,我们需要了解蛋白电泳的基本原理。
蛋白电泳是一种将蛋白质分离和定量分析的常用方法。
它利用蛋白质在电场中的迁移速率差异来实现分离和分类。
2.2 缓冲液在蛋白电泳中的作用缓冲液在蛋白电泳中起到至关重要的作用。
首先,它提供适当的pH环境以维持蛋白质具有最佳稳定性和活性。
其次,缓冲液通过控制离子强度和组成来调节电场强度和导电性,从而影响蛋白质的迁移速率和分离效果。
此外,缓冲液还可以保持试样溶液的稳定性,并阻止试样中其他化学反应发生。
2.3 常用蛋白电泳缓冲液配方概述下面概述几种常用的蛋白电泳缓冲液配方:- Tris缓冲液:Tris(又称三氨基甲烷)是一种常用的缓冲剂,能够稳定蛋白质的pH值。
电泳相关buffer配置
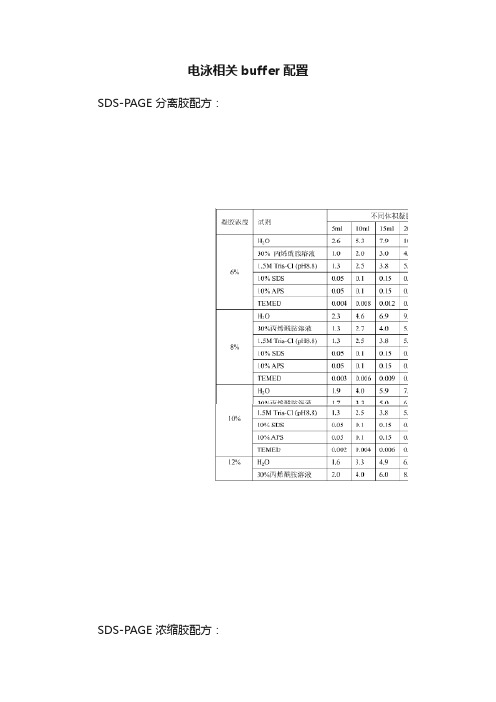
电泳相关buffer配置SDS-PAGE 分离胶配方:SDS-PAGE 浓缩胶配方:5×Running buffer(SDS-PAGE)配制方法:125mM Tris1.25M 甘氨酸0.5%(w/v)SDS十二烷基磺酸钠5×SDS-PAGE Loading Buffer配制方法:250mM Tris-HCl(pH6.8)10%(W/V) SDS0.5%(W/V)溴酚兰50%(V/V)甘油100mM DTT 二硫苏糖醇2×SDS-PAGE Loading Buffer配制方法100mM Tris-HCl(pH6.8)5% SDS20%甘油40mM DTT 二硫苏糖醇0.2% 溴酚兰SDS-PAGE染色液配制方法:25%乙醇,0.15%考马斯亮蓝R-250,10%醋酸, 剩余加水。
SDS-PAGE脱色液配制方法:25%乙醇,10%醋酸,剩余加水。
30%丙烯酰胺配置方法配方[1]丙烯酰胺(Acr)[2]290g甲叉双丙烯酰胺(Bic)[3]10g超纯水至1000ml配置步骤●取所需体积的DDW于水浴锅或沸水中预热(水温不低于37℃)●称取所需的丙烯酰胺和甲叉双丙烯酰胺,加入预热的DDW定容至所需体积,玻璃棒搅拌使其完全溶解●将上述溶液用定性滤纸过滤,滤后可分装入瓶,4℃保存注意事项丙烯酰胺为有毒化学物,配置时应小心操作,进行必要的防护。
操作时应穿专用实验服,佩戴两层口罩及手套;称量时小心操作,避免试剂粉末飞溅;操作桌面铺报纸,尽量避免丙烯酰胺接触实验室常用仪器;配置器皿为专用器皿,不得混用;接触过丙烯酰胺的手套等物品应及时清理,不得污染实验室其他设施。
过滤时应勤换滤纸,否则可导致过滤速度缓慢。
溶液配制完成后,应标记溶液名称(组成)、配制日期、配制人、贮存条件等必要信息。
配置好的丙烯酰胺可于4℃长期保存,使用时恢复至室温且无沉淀,若出现沉淀应及时更换。
注:[1]试剂位于213天平下方试剂柜中,试剂剩余不多时应及时告知唐老师购买[2]丙烯酰胺(Acrylamide)[3] 甲叉双丙烯酰胺,又称亚甲基双丙烯酰胺(Bis-acrylamide)。
蛋白胶制胶【2024版】
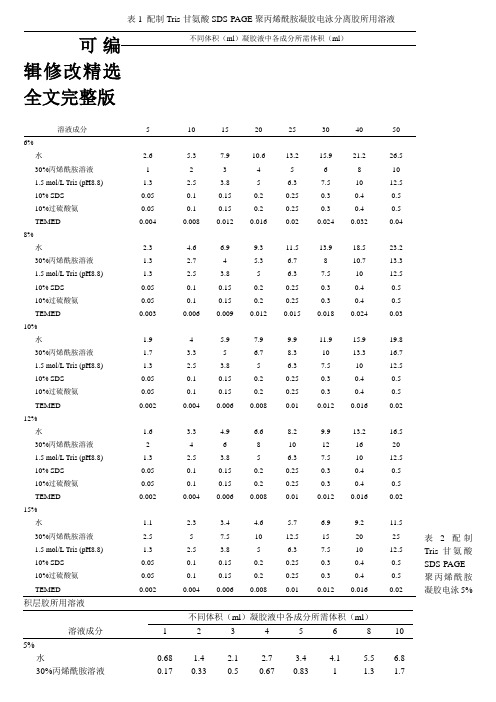
表1 配制Tris-甘氨酸SDS-PAGE 聚丙烯酰胺凝胶电泳分离胶所用溶液表 2 配制Tris-甘氨酸SDS-PAGE 聚丙烯酰胺凝胶电泳5%积层胶所用溶液溶液成分不同体积(ml )凝胶液中各成分所需体积(ml )1234568105%水0.68 1.4 2.1 2.7 3.4 4.1 5.5 6.8 30%丙烯酰胺溶液0.170.330.50.670.8311.31.7可编辑修改精选全文完整版溶液成分不同体积(ml )凝胶液中各成分所需体积(ml )5 10 15 20 25 30 40 50 6% 水2.6 5.3 7.9 10.6 13.2 15.9 21.2 26.5 30%丙烯酰胺溶液 1 2 3 4 5 6 8 10 1.5 mol/L Tris (pH8.8) 1.3 2.5 3.8 5 6.3 7.5 10 12.5 10% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.004 0.008 0.012 0.016 0.02 0.024 0.032 0.04 8% 水2.3 4.6 6.9 9.3 11.5 13.9 18.5 23.2 30%丙烯酰胺溶液 1.3 2.7 4 5.3 6.7 8 10.7 13.3 1.5 mol/L Tris (pH8.8) 1.3 2.5 3.8 5 6.3 7.5 10 12.5 10% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.003 0.006 0.009 0.012 0.015 0.018 0.024 0.03 10% 水1.9 4 5.9 7.9 9.9 11.9 15.9 19.8 30%丙烯酰胺溶液 1.7 3.3 5 6.7 8.3 10 13.3 16.7 1.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.5 10% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.002 0.004 0.006 0.008 0.01 0.012 0.016 0.02 12% 水1.6 3.3 4.9 6.6 8.2 9.9 13.2 16.5 30%丙烯酰胺溶液 2 4 6 8 10 12 16 20 1.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.5 10% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.002 0.004 0.006 0.008 0.01 0.012 0.016 0.02 15% 水1.12.33.44.65.76.9 9.2 11.5 30%丙烯酰胺溶液 2.5 57.5 10 12.5 15 20 25 1.5 mol/L Tris (pH8.8) 1.3 2.5 3.8 5 6.3 7.5 10 12.5 10% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED0.0020.0040.0060.0080.010.0120.0160.021.0mol/L Tris (pH6.8)0.130.250.380.50.630.750 1.2510% SDS0.010.020.030.040.050.060.080.110%过硫酸氨0.010.020.030.040.050.060.080.1TEMED0.0010.0020.0030.0040.0050.0060.0080.01SDS-PAGE凝胶电泳时的注意事项1.玻璃板一定要清洗干净,否则在染色时会有不必要的凝胶背景。
凝胶电泳配胶配方

8%Gel5ml10ml15ml20ml30%Acr 1.3 2.7 4.0 5.3 1.5M Tris-HCl (8.8) 1.3 2.5 3.8 5.010%SDS0.050.10.150.2 10%APS0.050.10.150.2 TEMED0.0030.0060.0090.1210%Gel5ml10ml15ml20ml30%Acr 1.7 3.3 5.0 6.7 1.5M Tris-HCl (8.8) 1.3 2.5 3.8 5.010%SDS0.050.10.150.20 10%APS0.050.10.150.20 TEMED0.0020.0040.0060.00812%Gel5ml10ml15ml20ml30%Acr 2.0 4.0 6.08.0 1.5M Tris-HCl (8.8) 1.3 2.5 3.8 5.010%SDS0.050.10.150.20 10%APS0.050.10.150.2015%Gel5ml10ml15ml20ml30%Acr 2.5 5.07.510.0 1.5M Tris-HCl (8.8) 1.3 2.5 3.8 5.010%SDS0.050.10.150.20 10%APS0.050.10.150.20 TEMED0.0020.0040.0060.00830%Acr0.670.83 1.0 1.4 1.5M Tris-HCl (6.8)0.50.630.75 1.010%SDS0.040.050.060.08 10%APS0.040.050.060.08 TEMED0.0040.0050.0060.008SDS-PAGE标准化流程实验前准备:(1)30%丙烯酰胺溶液:2.9g丙烯酰胺+0.1g甲叉双丙烯酰胺,溶于5mLddH2O,定容至10mL。
4℃避光保存。
(2)10%SDS(十二烷基磺酸钠):1gSDS,加6mLddH2O,加热至溶解,定容至10mL。
蛋白sds-page凝胶配方及制胶

蛋白sds-page凝胶配方及制胶
SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis)是一种常用的蛋白质电泳技术,用于分离和定量蛋白质。
以下是制作SDS-PAGE凝胶的基本配方和制胶步骤:
配方:
1. 1%丙烯酰胺(Acrylamide)溶液:将3.7g丙烯酰胺和60μl N,N'-亚甲基双丙烯酰胺溶解在0.5ml双蒸水中,搅拌均匀。
2. 2.5%BT(Bis-Tris)溶液:将0.1g BT和0.25ml TBE(三酸乙酸盐电泳缓冲液)混合均匀。
3. 10%过硫酸铵(AMS)溶液:将10μl AMS溶解在1ml双蒸水中。
4. 5xTBE电泳缓冲液。
制胶步骤:
1. 将电冰板预热至30℃。
2. 将1%丙烯酰胺溶液和2.5%BT溶液混合,100V恒压电泳10-15分钟,直至胶液凝固。
3. 将胶板取出,放入考马士亮蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
4. 将胶板再次放入考马士亮蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
5. 将胶板放入考马士固蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
6. 将胶板干燥后,即可用于蛋白质电泳。
碱性琼脂糖凝胶电泳缓冲液(10×)

北京雷根生物技术有限公司
碱性琼脂糖凝胶电泳缓冲液(10×)
简介:
碱性琼脂糖凝胶电泳缓冲液(10×)是一种10倍浓缩的碱性DNA 电泳缓冲液,由
NaOH 、EDTA 等组成,呈强碱性。
使用时稀释至1×使用,主要用于碱性琼脂糖凝胶电泳。
组成:
操作步骤(仅供参考):
1、 用去离子水稀释碱性琼脂糖凝胶电泳缓冲液(10×)至1×。
2、 用1×碱性琼脂糖凝胶电泳缓冲液制备用于碱性琼脂糖凝胶。
3、 加样品于琼脂糖加样孔,电泳。
注意事项:
1、 如果每次的使用量很小,可以适当分装后再使用。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12个月有效。
相关:
编号 名称 NA0070 Storage 碱性琼脂糖凝胶电泳缓冲液(10×) 500ml RT 使用说明书 1份 编号 名称
DH0006 苏木素伊红(HE)染色液
NA0030 Tris-乙酸电泳缓冲液(50×TAE)
NH0043 SSC 缓冲液(20×,pH7.0)
NR0040 RNase A(10mg/ml)
OR0001 pH 标准缓冲溶液(pH=4.00)
PW0040 Western blot 一抗稀释液
TC1243 甘油三脂(TG)检测试剂盒(GPO-PAP 单试剂比色法)。
蛋白质电泳相关试剂、缓冲液的配制方法

蛋白质电泳相关试剂、缓冲液的配制方法30%(W/V)Acrylamide 40%(W/V)Acrylamide 10%(W/V)过硫酸铵■组份浓度 30%(W/V)Acrylamide■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
Acrylamide 290 gBIS 10 g2. 向烧杯中加入约600 ml的去离子水,充分搅拌溶解。
3. 加去离子水将溶液定容至1 L,用0.45 μm滤器滤去杂质。
4. 于棕色瓶中4℃保存。
注意:丙烯酰胺具有神经毒性,可通过皮肤吸收,其作用具有积累性,配制时应戴手套。
聚丙烯酰胺无毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。
■组份浓度 40%(W/V)Acrylamide■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
Acrylamide 380 gBIS 20 g2. 向烧杯中加入约600 ml的去离子水,充分搅拌溶解。
3. 加去离子水将溶液定容至1 L,用0.45 μm滤器滤去杂质。
4. 于棕色瓶中4℃保存。
注意:丙烯酰胺具有神经毒性,可通过皮肤吸收,其作用具有积累性,配制时应戴手套。
聚丙烯酰胺无毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。
■组份浓度 10%(W/V)过硫酸铵■配制量 10 ml■配制方法 1. 称取1 g过硫酸铵。
2. 加入10 ml的去离子水后搅拌溶解。
3. 贮存于4℃。
注意:10%过硫酸铵溶液在4℃保存时可使用2周左右,超过期限会失去催化作用。
5×Tris-Glycine Buffer (SDS-PAGE电泳缓冲液)5×SDS-PAGE Loading Buffer考马斯亮蓝R-250染色液■组份浓度 0.125 M Tris,1.25 M Glycine,0.5%(W/V)SDS■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
Tris 15.1 gGlycine 94 gSDS 5.0 g2. 向烧杯中加入约800 ml的去离子水,搅拌溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱性蛋白质活性胶的配置
Shmily2012逍遥居士
各种蛋白质分子由于所含的碱性氨基酸和酸性氨基酸的数目不同,因而有各自的等电点。
凡碱性氨基酸含量较多的蛋白质,等电点就偏碱性,如组蛋白、精蛋白等。
反之,凡酸性氨基酸含量较多的蛋白质,等电点就偏酸性,人体体液中许多蛋白质的等电点在pH5.0左右,所以在体液中以负离子形式存在。
从某种意义上来讲,碱性蛋白质也就是其等电点大于7.0,在碱性范围内。
所以,碱性蛋白质活性胶电泳,我们应该用酸性缓冲液的活性胶,因为在酸性缓冲液下,碱性蛋白质带正电荷,从电泳槽的阳极向阴极移动。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的pH是8.8的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳。
碱性蛋白质活性胶即酸性缓冲液的活性胶---低pH的缓冲液系统。
配方如下:
β-Ala NH2CH2CH2COOH=89.09
甲基绿Methyl Green分子式:C27H35Cl4N3Zn分子量:608.78
酸性非变性电泳工作液配制:
40%胶贮液(Acr:Bis=29:1)
4×分离胶Buf(pH4.3,0.24M KOH-HAc):1.346g KOH,以HAc调pH至4.3,Milli-Q 定容至100ml。
4×堆积胶Buf(pH6.8,0.24M KOH-HAc):1.346g KOH,以HAc调pH至6.8,Milli-Q 定容至100ml。
5×电泳Buf(pH4.4,β-Ala-H Ac):35.64gβ-Ala,以HAc调pH至4.4,dH2O定容至1L。
即0.4M的丙氨酸缓冲液,1×buffer的为0.08M。
2×甲基绿上样Buffer:1ml1×(pH4.4,β-Ala-HAc)电泳缓冲液,3ml甘油,1ml0.4g/L 甲基绿,5ml dH2O;-20℃贮存。
即:2×甲基绿上样buffer:1ml1×(pH4.4,β-Ala-HCl)电泳缓冲液,3ml甘油,0.4mg甲基绿,6mlH2O;-20℃保存。
10%APS
0.25%考马斯亮蓝染色液:Coomassie blue R-2502.5g,甲醇450ml,HAc100ml,dH2O
450ml
考马斯亮蓝脱色液:100ml甲醇,100冰醋酸,800ml dH2O
电泳胶的配制及电泳条件(酸性电泳注意要反转电极,即上槽电极为正,下槽电极为负):
酸性非变性胶17%分离胶(10ml)4%堆积胶(5ml)
40%胶贮液(40%T,3.3%C) 4.25ml0.5ml
4×分离胶Buf(pH4.3,0.24M KOH-HAc) 2.5ml
4×堆积胶Buf(pH6.8,0.24M KOH-HAc) 1.25ml
水 3.15ml 3.15ml
10%APS75ul75ul
TEMED25ul25ul
5×电泳Buf(pH4.4,β-Ala-HAc)200ml稀释到1L
各缓冲液的终浓度:
分离胶:0.06M KOH,0.376M Ac,pH4.3(7.7%T,2.67%C);
堆积胶:0.06M KOH,0.063M Ac,pH6.8(3.125%T,2.5%C);
电泳缓冲液:0.14M2-丙氨酸,0.35M Ac,pH4.5?浓度可能影响不大。
将正负电极倒置,用甲基绿(0.002%)为示踪剂
电泳条件:反转电极,100V恒压约15min,指示剂进入浓缩胶;改换160V恒压,当指示剂移动到胶板底部时,停止电泳,整个过程约60min。
染色和脱色:取出胶板于0.25%考马斯亮蓝染色液中染色约30min,倾出染色液,加入考马斯亮蓝脱色液,缓慢摇动,注意更换脱色液,直至胶板干净清晰背景。
