第二节 铝 金属材料(第一课时)学案
【金版学案】2016-2017学年高中化学 第4章 第2节 铝与铝合金(第1课时)课件 鲁科版必修1

2.等体积、等物质的量浓度的硫酸、氢氧化钠溶液 分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气 的体积比为 5∶6(相同条件下), 则甲、 乙两烧杯中的反应 情况可能是( )
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量 C.甲中酸过量,乙中铝过量 D.甲中酸过量,乙中碱过量
解析:(1)2Al+3H2SO4===Al2(SO4)3+3H2↑
(2)用扎有针孔的铝箔包住 0.23 克钠,收集到的氢气 为 0.01 mol。( )
(3)根据反应 Na2O+H2O===2NaOH,可知 Al2O3+ 3H2O===2Al(OH)3 成立。( )
(4)所有的金属、金属氧化物及氢氧化物都不可能与 碱发生反应。( )
(5)氧化铝可以制造耐火坩埚的原因是利用 Al2O3 的 高熔点。( ) )
要点二
铝与盐酸、氢氧化钠溶液的反应
问题:一般金属不与碱反应,铝能与强碱反应吗? 铝与盐酸和氢氧化钠溶液反应的实验探究:
项目
铝与盐酸反应
铝与氢氧化钠溶液反应
实验 操作
实验 现象 化学 方程式 离子 方程式 结论
铝片逐渐溶解,有无色气泡冒出,将点燃的木 条放在试管口有爆鸣声 2Al+6H2O+ 2Al+6HCl===2AlCl3 2NaOH===2Na[Al(OH +3H2↑ )4]+3H2↑ - 2Al + 6H O + 2OH 2 2Al+6H+===2Al3++ === 3H2↑ 2[Al(OH)4]-+3H2↑ 铝既能与盐酸反应,又能与氢氧化钠溶液反应, 都产生H2且铝物质的量相同、酸碱均过量时, 放出H2的量相同
2.将上述反应得到的沉淀分别装在三支试管中:在 第一支试管中滴加 2 mol· L-1 盐酸,观察到的现象是白色 沉淀逐渐溶解; 在第二支试管中滴加 2 mol· L-1 氢氧化钠溶液,观察 到的现象是白色沉淀逐渐溶解; 在第三支试管中滴加氨水,观察到的现象是沉淀无 变化(或不溶解)。
高中化学 第4章 第2节 铝 金属材料(第1课时)学案 鲁

第4章第2节铝金属材料(第1课时)【学习目标】1. 熟练掌握铝的性质,能够根据物质性质对比分析实际问题。
2. 自主学习,小组合作,学会从物质分类的角度,实验探究铝的化学性质。
3. 激情投入,体会铝在生产、生活中的重要作用。
【使用说明与学法指导】1. 请同学们认真阅读课本115-119页,了解铝的有哪些物理性质,铝合金具有哪些特点?铝合金的用途有哪些?结合【观察。
思考】的学习在实验中注意规范操作,及时记录实验现象。
所有同学规范完成导学案预习自学部分,并记熟基础知识。
2. 结合课本独立思考,限时30分钟B、C层同学规范完成导学案合作探究两个课题除针对训练外所有内容,A层同学规范完成导学案所有内容,用红色笔做好疑难标记,准备课堂讨论。
预习案一、铝与铝合金1.回顾金属单质有哪些化学通性,分别总结学过的钠、镁、铁三种金属的化学性质,并写出相应反应的化学方程式。
2.根据上述金属通性,预测铝的化学性质有哪些?写出相关的化学方程式【预习自测】1.下列关于铝的几种性质说法正确的是()A.铝的化学性质活泼,但常温下不能被氧气氧化B.铝能跟某些金属氧化物反应,表现氧化性C.铝热剂是铝粉与氯酸钾的混合物D.铝在常温下能被浓硫酸氧化而钝化【我的疑问】课题一铝的还原性(育人立意:通过实验探究,提高动手操作能力、观察能力和主动探究能力。
)【化学与生活】铝是目前国民经济生产中除钢以外被使用最多的金属,并有逐步代替钢材的趋势,因为铝轻耗能少,【思考总结】1.铝热反应实验中镁条、氯酸钾分别起什么作用?2.总结铝的化学性质【拓展应用】你学过哪些既能与强酸又能与强碱反应的物质,并写有关化学反应方程式【针对训练】1. a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。
已知:① a、c皆能与稀硫酸反应放出气体;② b与d的硝酸盐反应,置换出单质d;③ c与强碱反应放出气体;④ c、e在冷浓硫酸中发生钝化。
由此可推断a、b、c、d、e依次是()A. Fe Cu Al Ag MgB. Al Cu Mg Ag FeC. Mg Cu Al Ag FeD. Mg Ag Al Cu Fe2.既能与盐酸,又能与氢氧化钠反应的物质是()①NaHCO3 ②Al ③ Fe ④CuO ⑤Al2O3 ⑥Mg(OH)2 ⑦Al(OH)3A. ①②⑤⑥B. ②③⑤⑦C. ①②⑤⑦D. ②④⑤⑦【身边化学】生活中的铝从1888年世界第一个铝制茶壶问世,120多年风雨沧桑,铝这种闪耀着银色光辉的金属,有过拿破仑皇冠上的荣耀,也有过堪比黄金的辉煌。
2019-2020年高三化学一轮复习 第四章 第2节 铝 金属材料1导学案

2019-2020年高三化学一轮复习第四章第2节铝金属材料1导学案【考纲要求】1.掌握铝的还原性,氧化铝和氢氧化铝的两性。
2.了解金属材料、合金的概念及其重要应用。
【重点知识】铝的还原性、氧化铝和氢氧化铝的的两性。
【课前预习案】一、铝——注意与钠、镁、铁、铜等比较1.铝元素的原子结构和位置:原子结构示意图,在周期表中的位置是。
2、铝的物理性质:为银白色金属,熔点为660.4℃,沸点为2467℃,密度为2.7g·ml-l,仅为钢的1/3左右,导电性仅次于银、铜和金。
3、铝的化学性质——铝属于极活泼金属,具有很强的还原性。
(1)铝与氧气的反应①常温下,铝被空气中的氧气氧化,在表面生成一层致密的氧化物薄膜,阻止内部的金属继续跟氧气发生反应。
因此,铝在常温下,具有抗腐蚀性。
②点燃时,铝箔在氧气中剧烈燃烧,发出耀眼的白光,生成白色固体,放出大量的热。
化学方程式。
这个反应放出大量的热和耀眼的白光,因此,铝可用于制造、、等。
【练习1】小亮家中收集了一件清代的铝制佛像,该佛像至今仍保存完好。
该佛像未被锈蚀的主要原因()A 铝不易发生化学反应B 铝的氧化物容易发生还原反应C 铝不易被氧化D 铝易被氧化,但氧化铝具有保护内部铝的作用(2)铝跟某些金属氧化物反应——铝热反应。
如与Fe2O3的化学反应方程式:实验现象:纸漏斗内混合物立即剧烈反应,发出耀眼的光,产生大量的烟,纸漏斗被烧破,有红热的液珠落入蒸发皿内的细砂上,待熔融物冷却后变为黑色的固体。
铝热反应的用途有:【练习2】下列混合物不能组成铝热剂的是()A. Al和V2O5B. Al和MnO2C. Al和MgOD. Al和Fe3O4写方程式:Al + MnO2 -Al + Fe3O4 -注意两点:第一点:不仅铝粉和氧化铁粉末的混合物称为铝热剂,这个反应称为铝热反应,而且和其它某些金属氧化物的混合物也叫铝热剂,反应也是铝热反应。
铝与Fe3O4 、FeO、V2O5、Cr2O3、MnO2等发生铝热反应。
高中化学4.2.2《第2节 铝 金属材料 》教案(鲁科版必修1)
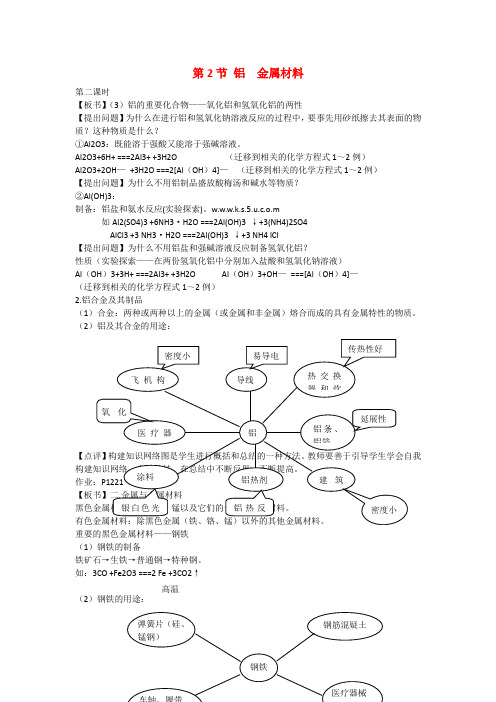
第2节铝金属材料第二课时【板书】(3)铝的重要化合物——氧化铝和氢氧化铝的两性【提出问题】为什么在进行铝和氢氧化钠溶液反应的过程中,要事先用砂纸擦去其表面的物质?这种物质是什么?①Al2O3:既能溶于强酸又能溶于强碱溶液。
Al2O3+6H+ ===2Al3+ +3H2O (迁移到相关的化学方程式1~2例)Al2O3+2OH—+3H2O ===2[Al(OH)4]—(迁移到相关的化学方程式1~2例)【提出问题】为什么不用铝制品盛放酸梅汤和碱水等物质?②Al(OH)3:制备:铝盐和氨水反应(实验探索)。
w.w.w.k.s.5.u.c.o.m如Al2(SO4)3 +6NH3·H2O ===2Al(OH)3 ↓+3(NH4)2SO4AlCl3 +3 NH3·H2O ===2Al(OH)3 ↓+3 NH4 lCl【提出问题】为什么不用铝盐和强碱溶液反应制备氢氧化铝?性质(实验探索——在两份氢氧化铝中分别加入盐酸和氢氧化钠溶液)Al(OH)3+3H+ ===2Al3+ +3H2O Al(OH)3+OH—===[Al(OH)4]—(迁移到相关的化学方程式1~2例)2.铝合金及其制品(1)合金:两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。
(2)铝及其合金的用途:【点评】构建知识网络图是学生进行概括和总结的一种方法。
教师要善于引导学生学会自我构建知识网络,自我总结,在总结中不断反思,不断提高。
作业:P1221~5题。
【板书】二.金属与金属材料黑色金属材料:铁、铬、锰以及它们的合金构成的材料。
有色金属材料:除黑色金属(铁、铬、锰)以外的其他金属材料。
重要的黑色金属材料——钢铁(1)钢铁的制备铁矿石→生铁→普通钢→特种钢。
如:3CO +Fe2O3 ===2 Fe +3CO2↑(2)钢铁的用途:几种有色金属材料——金、银、铜(1)金、银、铜的性质①金属光泽:Au——黄色;Ag——银白色;Cu——紫红色。
第2节 铝 金属材料(第1课时)一轮教学案

第2节铝金属材料(第1课时)姓名学号【学习目标】1、掌握铝的还原性,氧化铝、氢氧化铝的两性。
2、能列举铝合金材料在生产、生活中的重要应用。
【预习导学】一.单质铝1、铝的物理性质铝为色金属,熔点为,沸点为,密度为,仅为钢的1/3左右,导电性仅次于、和。
2、铝的化学性质⑴铝与非金属反应铝是一种活泼金属,它很容易跟氧气发生反应。
常温下,铝被空气中的氧气氧化,在表面生成一层薄膜,阻止内部的金属继续跟氧气发生反应。
因此,铝在常温下,具有性。
根据P112【实验1】观察到的现象:请写出化学方程式这个反应放出和,因此,铝可用于制造、、火箭推进剂等。
⑵铝跟酸反应铝跟稀盐酸、稀硫酸等非氧化性酸反应,放出;常温下铝遇稀硝酸反应生成;常温下铝遇浓硫酸、浓硝酸发生现象。
写出铝和稀盐酸反应的离子方程式:铝与稀硝酸反应的离子反应方程式:练习:等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是()A.甲、乙中都是铝过量B.甲中铝过量、乙中碱过量C.甲中酸过量、乙中铝过量D.甲中酸过量、乙中碱过量⑶铝与盐溶液的反应写出铝和硫酸铜溶液反应的离子方程式:⑷铝跟某些金属氧化物反应根据P116【实验2】I.观察到的现象:II.写出化学方程式:在这个反应中,还原剂是、氧化剂是。
这个反应称为反应。
铝粉和氧化铁粉末的混合物称为。
III.铝热反应在生产上的应用在生产上,如焊接钢轨(课本P113图4-2-4利用铝热反应焊接钢轨)等这种焊接不用电源,而且焊接速度快、设备简易,适合于。
用这种焊接方法可以把比较短的钢轨焊接成较长的钢轨。
此外在工业上,也利用铝热反应焊接大截面的钢材部件。
⑸铝与氢氧化钠溶液反应写出铝与氢氧化钠溶液反应的化学方程式及离子方程式:化学方程式:离子方程式:3、铝的用途⑴合金的优点:将金属制成合金,可以保持甚至强化单一金属的长处,克服其不足,所以合金的性能一般优于纯金属。
《铝 金属材料》 教学设计

《铝金属材料》教学设计一、教学目标1、知识与技能目标(1)了解铝的物理性质和化学性质。
(2)掌握铝与氧气、酸、碱等物质的反应。
(3)理解铝在生活和工业中的应用。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、动手操作能力和分析问题的能力。
(2)通过对铝的性质的学习,培养学生的归纳总结能力和逻辑思维能力。
3、情感态度与价值观目标(1)让学生感受到化学与生活的密切联系,激发学生学习化学的兴趣。
(2)培养学生的创新精神和合作意识。
二、教学重难点1、教学重点(1)铝的化学性质,如与氧气、酸、碱的反应。
(2)铝在生活和工业中的应用。
2、教学难点(1)铝与氢氧化钠溶液反应的原理。
(2)铝的钝化现象。
三、教学方法讲授法、实验探究法、讨论法四、教学过程1、导入新课展示生活中常见的铝制品,如易拉罐、铝锅、铝合金门窗等,提问学生这些铝制品的特点和用途,从而引出本节课的主题——铝。
2、讲授新课(1)铝的物理性质通过展示铝片,让学生观察铝的颜色、状态、光泽,并结合生活经验,总结铝的物理性质,如银白色金属、有金属光泽、密度小、导电性好、导热性好等。
(2)铝的化学性质①与氧气的反应演示铝在空气中加热的实验,观察铝表面的变化,写出化学方程式:4Al +3O₂=2Al₂O₃。
强调铝表面生成的氧化铝薄膜具有保护作用,使铝在空气中不易被进一步氧化。
②与酸的反应分别进行铝与稀盐酸和稀硫酸反应的实验,观察实验现象,写出化学方程式:2Al + 6HCl = 2AlCl₃+ 3H₂↑,2Al + 3H₂SO₄=Al₂(SO₄)₃+ 3H₂↑。
③与碱的反应演示铝与氢氧化钠溶液反应的实验,观察有无气体产生,写出化学方程式:2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑。
引导学生分析反应的本质,理解铝既能与酸反应又能与碱反应的特性。
④铝的钝化介绍铝在浓硝酸、浓硫酸中发生钝化的现象,解释钝化的原因是在铝表面形成了一层致密的氧化膜,阻止了反应的进一步进行。
化学鲁科版必修1 第4章第2节铝金属材料第1课时 学案

第2节 铝 金属材料第1课时 铝与铝合金1铝在地壳中的含量仅次于______和______,自然界中的铝全部以________态形式存在。
2.铝的物理性质铝是一种________色金属,熔点______(660.4 ℃),沸点________(2 467 ℃),密度较______(2.7 g·cm -3),有很好的延展性和导电性(导电性仅次于________、________和________)。
3.化学性质4.铝合金及其制品(1)合金①概念:合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
②性能:一般来说,合金的性能优于纯金属,合金的熔点比它的各成分金属熔点都低,硬度比它的各成分金属大。
但合金的性质并不是各成分金属性质的总和。
(2)铝合金①形成:铝中加入其他元素(如铜、镁、硅、锌、锂等)熔合而形成铝合金。
②性能:密度小、强度高、塑性好、易于成型、抗腐蚀等。
并且表面易形成致密的氧化物保护膜而具有一定的抗腐蚀能力。
③用途:建筑、包装、交通运输及电子行业。
另外,还广泛用于制造飞机构件。
预习交流铝是较活泼的金属,易被氧化,为什么铝在空气中又具有抗腐蚀的性能? 答案:1.氧 硅 化合2.银白 低 高 小 银 铜 金3.4Al +3O 2=====点燃2Al 2O 3 2Al +Fe 2O 3=====高温2Fe +Al 2O 3 2Al +2NaOH +6H 2O===2Na[Al (OH )4]+3H 2↑ Fe +2HCl===FeCl 2+H 2↑ Fe +H 2SO 4===FeSO 4+H2↑预习交流:答案:常温下,铝能被空气中的O 2氧化,表面生成一层致密的氧化物薄膜,脱脂棉蘸上一些铝粉点燃后放入氧气中:1.表面未打磨的铝箔在空气中加热时的现象说明了什么?2.表面打磨的铝箔在空气中加热时的现象与未打磨的铝箔直接加热时的现象相同吗?为什么?3.你能想出一个让铝在空气中燃烧的方法吗?铝在常温下就能与空气中的氧气发生反应,生成一层致密的氧化膜。
鲁科版化学必修一第四章第2节-铝-金属材料学案1

第2节铝金属材料(第1课时铝及其化合物)班级:姓名:编审:【学习目标】知识目标:了解铝及其化合物的物理性质;掌握铝及其化合物的化学性质。
技能目标:增强实验探究能力,加深对元素化合物知识学习方法的认识。
情感目标:了解金属及其合金在工农业生产和生活等方面的重要应用,认识金属及其化合物的物理、化学性质与应用之间的密切联系,激发学生学习化学的兴趣。
【自主学习】一、铝的物理性质铝是一种色金属,熔点为660.4℃,沸点为2467℃,密度(填大或小)仅为钢的1/3左右;导电性仅次于、和。
铝在地壳中的含量丰富,仅次于和;在金属元素中铝的含量为第一,它的性质活泼;在自然界中以态存在。
二、铝的化学性质1、预习课本p116的“观察·思考”中的两个实验。
写出Al分别与O2、Fe2O3反应的化学方程式、铝热反应有何特征,可用于等。
2、根据金属的化学通性预测铝可能具有的化学性质①写出Al与Cl2反应的方程式②写出Al与盐酸反应的方程式离子方程式写出Al与硫酸反应的方程式离子方程式③写出Al与CuSO4溶液反应的方程式离子方程式3、预习铝的特性(既能与酸反应又能与碱反应)写出Al与NaOH溶液反应的化学方程式离子方程式回顾:我们还学过一种非金属单质可以与NaOH溶液反应的化学方程式离子方程式三、氧化铝的性质氧化铝为白色固体,难溶于水,熔点高,可作耐火材料。
自然界中较纯净的氧化铝为无色晶体,俗称刚玉,硬度仅次于金刚石;含杂质离子的氧化铝叫红宝石、蓝宝石。
氧化铝是一种两性氧化物,它既能与强酸反应又能与强碱反应。
通过阅读课本记忆氧化铝与盐酸、硫酸和氢氧化钠溶液反应的化学方程式、离子方程式四、氢氧化铝的性质氢氧化铝是色固体物质,溶于水,具有性,可用作净水剂。
难溶氢氧化物受热易分解,写出Al(OH)3受热分解的方程式回顾:写出Fe(OH)3受热分解的方程式五、铝合金及其制品1.合金是指两种或两种以上金属(或金属与非金属)熔合而成的具有金属特性的物质(有些合金中也有化合物)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
班级姓名
第二节铝金属材料(第一课时)学案
编制:刘长允审核:李留兵、郭芳2011.12.21
学习目标: 1、了解铝的物理性质
2、掌握铝的化学性质
3、认识铝化学性质上与其他常见金属的不同
重点难点:铝的化学性质
[自学探究]
阅读教材P116一段,并结合日常生活中一些铝制品的使用,总结铝的物理性质。
一、物理性质
铝的颜色、密度熔点具有良好的、性和性。
二、化学性质
[交流研讨]
根据铝锅在日常生活中使用的注意事项:
食物及时取出以免残留的食物尤其是酸碱性物质腐蚀锅体。
分组讨论预测铝具有哪些性质?
1、与酸反应(铝与盐酸反应)
化学反应方程式:
离子反应方程式:
2、与碱反应(铝与氢氧化钠溶液反应)
化学反应方程式:
离子反应方程式:
[即时练习]
1、下列用途主要是体现铝的物理性质的是()
①家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔
⑥炼钢的脱氧剂⑦做防锈油漆⑧做合金用作飞机制造业材料⑨工
业做热交换器
A.①②③④
B.③④⑥⑦⑧⑨
C.①③⑤⑦⑧⑨
D.①③②④⑥⑧
2、两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为()
A、1:1
B、1:2
C、1:3
D、1:4
[交流研讨]
运用分类比较的方法预测铝应该还具有哪些化学性质?
3、Al与O2反应(铝粉在空气中燃烧)
实验现象:
化学反应方程式:
应用:制造燃烧弹、信号弹、火箭推进剂等。
4、Al与金属氧化物反应(铝热反应)
铝热剂:
实验现象:
化学反应方程式:
思考:从四大基本反应类型来看,上述反应属于哪一类?哪些金属氧化物可以与铝粉
发生类似的反应?
铝热反应的用途:、
A L+MnO2= A L+Cr2O3=
5、AL与盐溶液的反应
AL+CuSO4:离子方程式:
[交流研讨]
利用所学氧化还原反应的知识分析上述五个反应,分组讨论得出结论。
综上所述:铝的化学性质主要表现为。
[概括总结]
本节课我们主要探究、学习了铝的性质,知道了铝是一
种,能与盐酸、稀硫酸等反应产生,体现金属的活泼性,但铝遇到浓的硫酸和硝酸要发生。
铝也能与反应,生成,这体现铝的特性。
铝的活泼性还体现在它能在常温下与氧气生成,这种性质使铝成了用途极其广泛的材料。
由于铝的金属性强,熔点高,铝可以进行,可用于。
[随堂练习]
1.铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。
下列与这些用途无关的性质是
()
A.不易生锈B.导电性好C.密度小D.强度高
2.铝热剂中铝的作用是()
A.催化剂B.氧化剂C.还原剂D.填充剂
3.能用铝为原料来冶炼难熔的金属是因为()
A.铝的密度小, 熔点较低B.铝具有还原性、发生氧化还原反应时放出大量的热
C.铝在金属活动性顺序表排在较前面D.铝在空气中燃烧, 放出大量的热
4.用铝热法还原下列化合物,制得金属各1mol,需消耗铝最少的是:()
A、MnO2
B、WO3
C、Co3O4
D、Cr2O3
5.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
()
A.3:1 B.2:1 C.1:1 D.1:3
6.写出下列离子反应的离子方程式:
①铝片与稀硫酸反应。
②铝片与氢氧化钾溶液反应。
③铝热剂是和的混合物。
写出铝粉和氧化铁的混
合物在高温下反应的化学方程式:。
铝热反应可用于。
反应中铝表现出。
[课后作业]
1、课下搜集关于以铝为主要成分的物质的资料,同学之间交流讨论分
析该物质是利用了铝的哪些用途?
2、认真思考铝热反应的实验过程,查找资料,同学之间交流讨论在实
验中以下物质的作用分别是什么?
(1)铝粉:
(2)三氧化二铁:
(3)镁条:
(4)氯酸钾:。
