有机化学:第一章 有机化合物分子结构基础
有机化学课后题答案chapter01

第一章 有机化合物分子结构基础习题1-1H:Cl(2)H:O:N::O(3)H:N:N:H H H (1)O::C::O Cl:C:ClO(4)(5)Na(6)+(7)(8)(9)H:C:C:O:H H H H H H:C:C::O:HH H H:C: :OO:H(10)(11)H:C:C H H(12)NH:N:C::O:H H习题1-3C C H H HO Cl :::::(1)(2)C C HH H C O ::::H H (3)H C N N H三价三价正确N 原子应带电荷更改为:C H H H O ::::(1)(2)C C HH H C O ::::H HH (3)H N N HCl ::::(4)(5)(6)C O HH H H H O ::C OH H::::O 原子应带电荷C 原子应带电荷O 原子应带电荷更改为::::(4)(5)(6)C O HH HH C HN O ::C N OH H::::习题1-3(1)CH 3CHCH 2CH 2CH 2Cl(2)CH 3CHCH 2CH 2CHCH 3OH OCH 3ClBrOHOCH 3(3)C CH 3H 3C CH 3CH 2CH 2Cl(4)(CH 3)2NCH 2CH 2CH 3N(5)CH 3CH 2COCH 3(6)(CH 3)2CHCH 2CHOH OO习题1-4(1)可以,因为轨道可以有效重叠成键,如下图(a );(2)不可以,因为轨道间不是同位相相加,故不能有效重叠成键,如下图(b )和(c )。
(a)(b)(c)习题1-5*(1)因为反键分子轨道上有一个电子,只具有相对稳定性;(2)因为成键与反键分子轨道都全部充满电子,体系能量没有有效降低,所以不能稳定存在; (3)两个氮原子的2p 轨道各有3个单电子,它们相互结合形成三个成键轨道和三个反键轨道,而6个电子将在成对地填充在三个成键轨道上,所以N 2分子可以稳定存在;(4)O 2-可以看成是1个O (4个2p 电子)与1个O -(5个2p 电子)结合而成,各自的3个2p 轨道组成3个成键和3个反键轨道,9个电子在成对填充满3个成键轨道后,还有3个电子在反键轨道,因此,该负离子具有相对稳定性。
有机化学课后答案古练权

第一章 有机化合物分子结构基础习题1-1H:Cl(2)H:O:N::O(3)H:N:N:H HH (1)O::C::O O(4)(5)Na(6)+(7)(8)(9)H:C:C:O:H H H H H H:C:C::O:HH H H:C: :O O:H(10)(11)H:C:C H H(12)NH:N:C::O:H H习题1-3C C H H O Cl :::::(1)(2)C C HH C O ::::(3)H N N H三价三价正确N 原子应带电荷更改为:C H H O ::::(1)(2)C C HH C O ::::H (3)H N N HCl ::::(4)(5)(6)O HH H H H O ::OH H::::O 原子应带电荷C 原子应带电荷O 原子应带电荷更改为::::(4)(5)(6)O HH HH C H N O ::C N OH H::::第二章 饱和碳氢化合物习题2-1 (1) C 6H 14:CH 3CH 2CH 2CH 2CH 2CH 3CH 3CH 2CH 2CHCH 33CH 3CH 2CHCH 2CH 3CH 3CHCHCH 3CH 32CH 33H 33CH 33(2) C 7H 16: CH 3CH 2CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 2CH 3CH 3CH 2CHCH 2CH 2CH 333CH 3CHCHCH 2CH 3CH 3CHCH 2CHCH 3CH 32CH 2CH 3H 33H 33CH 33 CH 3CH 22CH 3CH 3CH 2CHCH 2CH 3CH 332CH 3H 3C C CHCH 3CH 3H 33习题2-2CH 3CHCHCHCH 2CH 2CH 33CH 32CH 3(1)(2)CH 2CH 3H 3CCH 31o1o 1o 1o1o2o 2o 2o2o2o 2o 2o1o1o1o3o 3o 3o 3o3o3o习题2-3(1) 2,3,4-三甲基已烷 2,3,4-trimethylhexane (2) 4-甲基-3-乙基庚烷 3-ethyl-4-methylheptane习题2-4(1)(2)<>CH 2CH 2CHCH 33CH 2CHCH 2CH 33CHCH 33CH 2C=CH 23CH 2CH 2CHO C CH 33OCH 3CH 2CHCH 3CH 2CCH 33<>(3)(4) CH 3CH 3H 3COCH 3(5)(6)><OCH 3习题2-5(1) 2,3,5-三甲基-4-丙基庚烷 2,3,5-trimethyl-4-propylheptane (2) 3-甲基-4,5-二乙基庚烷 3,4-diethyl-5-methylheptane习题2-6(1) 2,2-二甲基-5-(1,2-二甲基丙基)壬烷2,2-dimethyl-5-(1,2-dimethylpropyl)nonane(2) 4,4-二甲基-5-乙基辛烷 5-ethyl-4,4-dimethyloctane习题2-7(1) 2,3-dimethylhexane CH 3CHCHCH 2CH 2CH 3H 33(2) 2,2-二甲基-4-丙基辛烷CH 32CHCH 2CH 2CH 2CH 33CH 32CH 2CH 3(3) 4-isopropyl-2,4,5-trimethylheptaneCH 3CHCH 2H 3CHCH 3H 3CHCH 2CH 33H 3C (4) 2,5-二甲基-4-异丁基辛烷CH 3CHCH 22CH 2CH 332CH(CH 3)2CH 3(5) 4,4-dimethyldecaneCH 3CH 2CH 22CH 2CH 2CH 2CH 2CH 3CH 2CH 32CH 3(6) 4-(1,1-dimethylethyl)octane CH 3CH 2CH 2CHCH 2CH 2CH 2CH 3C 3H 3C CH 3习题2-8H-H 重叠张力4.0 kJ·mol -1 H-CH 3重叠张力6.0 kJ·mol -1 CH 3- CH 3重叠张力11.0 kJ·mol -1 CH 3- CH 32邻位张力3.8 kJ·mol -1习题2-9ABCDEF能量A = C = E < B = D < F习题2-10ABCDEF能量A<C=E<B=F<D习题2-112,2,3,3-四甲基丁烷的构造式为(CH 3)3C-C(CH 3)3绕C2-C3σ键旋转只有两种极限构象(类似乙烷)。
《有机化学》第一章 绪论

Sp3杂化
2P
2S 6C
2P 跃迁 2S
杂化
Sp3杂化轨道
Sp2杂化
2P 2S 6C
2P 跃迁 2S
杂化
Sp2杂化轨道
Sp2和sp3杂化轨道的形状大体相似,只是由于s成分的 逐渐增多,形状较胖,电负性较大。
Sp杂化
2P 2S 6C
2P 跃迁 2S
杂化
Sp杂化轨道
判断杂化类型的方法(第2和3章重点讲)
第一节 有机化学(Organic chemistry)发展概况
Organic一词的意思是有机的、有生命的 , 因此,有机化合物的最初定义是指来源于 动、植物体的物质 。
甘蔗------制取蔗糖; 大米或果汁----酿制酒精 植物油和草木灰共融--------制成肥皂 米醋------乙酸等称为有机物,形成“生命力论”
共价键 C--C C=C C—O C—N C--Br
键能 347.3 611 359.8 305. 4 284.5
3、键角(bond angle) 有机分子中二个共价键之间的夹角,称为键角。
4、键的极性和分子的极性
当两个相同的原子或原子团形成共价键时,由 于其电负性相同,因此成键电子云对称地分布 在两个原子周围,分子的正、负电荷中心重合, 这种键称为非极性共价键。
=dq 偶极矩的单位为德拜(Debye, Debye.Peter 荷兰物理学家), 简写为D。1D=10-8cm 10-10静电单位。
双原子分子的极性就是其键的极性,多原子分子 的极性是各个价键极性的矢量和。偶极矩是矢量,方向 从正电荷中心指向负电荷中心,可书写如下:
δ+
H
-
Cl
偶极矩 u=q•d
由于青霉素的发现和大量生产,拯救了千百万 肺炎、脑膜炎、脓肿、败血症患者的生命,及时 抢救了许多的伤病员。青霉素的出现,当时曾轰 动世界。为了表彰这一造福人类的贡献,弗莱明、 钱恩、弗罗里于1945年共同获得诺贝尔医学和生 理学奖。
有机化学知识的基本概念第一节有机化合物的组成和结构
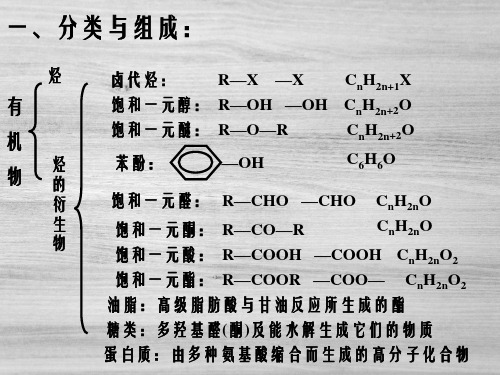
强极性键:如C—O、O—H、C—X等键,一般性质活泼, 较易断裂而发生化学反应。
三、结构与性质的关系:
1、结构与物理性质: (1)熔、沸点:分子量越大;分子中支链越少;分子极
性越大的熔沸点越高。 (2)、溶—解C性H:O只等有官分能子团中的含低有级—化O合H物、可—溶N于H2水、。—其CO余O的H
反应基团:C=C、C=O、C≡C、苯环上的键等
C=O + H—H → H—C—O—H (加氢)
C=C + H—CN → H—C—C—CN (加氢氰酸)
C=C + H—X → H—C—C—X (加卤化氢) C=C + H—OH → H—C—C—OH (加水)
加成反应的规律
. 1mol双键需1molH2 ; 1mol叁键需2molH2 .加成反应发生后,碳链结构不变,一般碳原子数目不 变,但加氢氰酸(HCN)后,碳原子数增加一个。
单体分子中一般应含有至少两个可以发
缩
生缩合反应的官能团
聚 特 反应通常发生在官能团上
反 点 高分子链中一般要通过氧、氮等原子相
·能发生银镜反应的物质有:醛、甲酸、甲酸酯、甲酸盐
有机物燃烧的规律: ⑴ N→有N机2、物X燃→烧H时X,各元素的最终产物:C→CO2、H→H2O、 ⑵烃和烃的含氧衍生物完全燃烧后,产物均为CO2和H2O ⑶烃的含氧衍生物燃烧的耗氧量可转化为烃燃烧的耗氧量
⑷1molC消耗1molO2,4molH消耗1molO2 ⑸ Cn符H2合nO通z的式有C机nH物2nO完z全的燃有烧机,物其完产全物燃C烧O规2和律H:2O(符g)合的通体式积相等。 ⑹100℃以上,有机物完全燃烧前后气体体积不变化的规律。
有机化学01有机化合物的结构

正四面体的体心到顶点的距离与边长的比
甲烷的四个C-H 键
2.碳原子的SP2杂化和烯烃的结构
激发 杂化
SP2
sp2 杂化轨道
碳碳双键相当于由一个C-Cσ键和一个C-Cπ键组成,平均键能为610.9 kJ.mol-1,其中C-Cσ键的平均键能为343.3 kJ.mol-1,π键的键能为263.6 kJ.mol-1,π键的键能较σ键的小。
3、碳原子的SP杂化和炔烃结构
(1) SP杂化
激发
杂化
2P SP
(2) 乙炔分子中的 键
•由炔烃叁键一个碳原子上的两个sp杂化轨道所组成 的键则是在同一直线上方向相反的两个键. •在乙炔中,每个碳原子各形成了两个具有圆柱形轴 对称的 键.它们是Csp-Csp和Csp-Hs.
H
CH
H
H
109.5o
如:CH2Cl2、CH2ClBr
说明甲烷是正四面体结构
H
H
C
H
H
矩形
C
H
H
H
H
锥体
H
H
C
H
H
四面体
近代物理方法测定结果
键角:109°28′ 键长:0.109nm 有力地证明甲烷是正四面体结构
1、碳原子的SP3杂化
sp3杂化轨道 一个s轨道与三个p轨道形成四个sp3杂化轨道
为什么要杂化?
①只有杂化,才能形成四个等同的化学键。 ②杂化后,成键能力提高了。 ③杂化后,四个轨道尽可能距离最远,键角
H C
H
H
C H
sp2杂化
1. π键没有轴对称 2. π键易断裂,较活泼 3. π键有较大流动性
有机化学.doc

有机化学精品课程第一章绪论第一节有机化学的研究对象一、有机化合物和有机化学1、有机化学、有机化合物的定义有机化学(organic chemistry)是研究有机化合物的来源、制备、结构、性能、应用以及有关理论和方法学的科学,是化学学科的一个分支,它的研究对象是有机化合物。
什么是有机化合物呢?早期化学家将所有物质按其来源分为两类,人们把从生物体(植物或动物)中获得的物质定义为有机化合物,无机化合物则被认为是从非生物或矿物中得到的。
现在绝大多数有机物已不是从天然的有机体内取得,但是由于历史和习惯的关系,仍保留着“有机”这个名词。
象人类认识其它事物一样,人们对有机化合物和有机化学的认识也是逐步深化的。
自从拉瓦锡(Lavoisier.A.L)和李比希(Von Liebig.J.F)创造有机化合物的分析方法之后,发现有机化合物均含有碳元素,绝大多数的含氢元素,此外,很多的有机化合物还含氧、硫、氮等元素。
于是,葛美林(Gmelin.L)凯库勒(KeKule .A)认为碳是有机化合物的基本元素,把“碳化合物称为有机化合物”,“有机化学定义为碳化合物的化学”。
后来,肖莱马(Schorlemmer,c.)在此基础上发展了这个观点,认为碳的四个价键除自己相连之外,其余与氢结合,于是就形成了各种各样的碳氢化合物——烃,其他有机化合物都是由别的元素取代烃中的氢衍生出来的,因此,把有机化学定义为研究烃及其衍生物的化学。
2、有机化合物的特性(1)对热不稳定,容易燃烧等),和无机化合物比较起来,除了极少数例外(如可作灭火剂的CCl4有机化合物不很稳定,受热容易分解,也很容易燃烧。
而且大多数有机化合物燃烧后变成气体,不留残渣,这和无机化合物不易着火,不能燃尽有所不同,所以,我们常用燃烧试验来区别化合物是有机物还是无机物。
(2)熔点较低有机化合物的熔点较低,一般在250。
C以下,只有极少数超过300。
C(3)难溶于水,易溶于有机溶剂除少数例外,大多数有机化合物难溶或不溶于水,易溶于酒精、乙醚、丙酮、汽油或苯等有机溶剂。
有机化学教案

有机化学教案第一章第一章有机化合物的结构与性质一. 学习目的和要求1. 掌握有机化学的定义。
2. 掌握有机化合物区别于无机化合物的特点。
3. 掌握共价键理论的要点、共价键的均裂、异裂、共价键的属性及重要参数。
理解有机化合物的特点,从中弄清与无机化合物的主要区别,掌握主要官能团的表达式。
4.理解有机化合物的分类原则样和有机化学中的酸碱理论。
5.掌握有机化合物的分类方法。
6.了解有机化学的发展简史,了解有机化学在生活和生产中的作用,了解有机化学的学习方法。
二. 本章节重点、难点共价键理论、分子轨道理论以及共价键的键参数的概念及应用。
三.教学内容:1.1 有机化学、有机化合物的定义有机化学(Organic Chemistry)是化学学科的一个分支,研究有机化合物的来源、制备、结构、性能以及应用,它的研究对象是有机化合物。
按物质的来源分类,早期化学家把从生物体(植物或动物)中获得的物质定义为有机化合物,无机化合物则被认为是从非生物或矿物中得到的。
当然,我们知道现在绝大多数有机物已不是从天然的有机体内取得,但是由于历史和习惯的关系,仍保留着“有机”这个名词。
现在将有机化合物定义为含碳化合物,所以有机化学就是研究碳化合物的化学。
有机化合物的另一个定义是碳氢化合物及其衍生物体现有有机化合物在结构上的相互联系,所以有机化学也可以称作研究碳氢化合物及其衍生物的化学1.2 有机化合物的特点1 •(1)有机化合物种类繁多、数目庞大(已知有七百多万种、且还在不断增加),组成有(C,H,O, N ,P,S,X等)。
因为1)C原子自身相互结合能力强;2) 结合的方式多种多样(单键、双键、三键、链状、环状)3) 存在同分异构现象(构造异构、构型异构、构象异构)。
(2)物理性质方面特点是1) 挥发性大,熔点、沸点低;2) 水溶性差(大多不容或难溶于水,易溶于有机溶剂)。
(3)化学性质方面的特点是1) 易燃烧;2) 热稳定性差,易受热分解(许多化合物在200~300度就分解);3) 反应速度慢;4) 反应复杂,副反应多1.3共价键有机化合物中的原子都是以共价键结合起来的,从本质上讲,有机化学是研究共价键化合物的化学,因此,要研究有机化学应先了解有机化学中普遍存在的共价键。
化学分子结构

第一章有机化合物分子结构基础(Structural Foundations for Organic Molecules)121.1 原子结构与价键理论1.2 有机化合物结构的表示方法1.3 分子轨道理论1.4 杂化轨道理论(sp 3、sp 2、sp )1.5 电负性与键的极性1.6 有机分子的基本骨架和官能团1.7 键的断裂方式与反应活性中间体的基本结构第一章重点讲解内容1.1 原子结构与价键理论原子结构Atom——nucleus和electrons electrons——moving around the nucleus原子轨道(atomic orbitals)根据量子力学原理,原子核外的电子只能在特定的原子轨道上运动,这些原子轨道有特定的能量和形状。
34碳的原子结构碳的原子轨道C 1s 2s 2p x 2p y 2p z碳的原子轨道的能级与电子排布E1s2s2p x 2p y 2p zElectronic configuration for carbon碳原子6个电子可占据5个原子轨道总的原子轨道能级:1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f核外电子排布三原则:¾能量最低原则(aufbau principle):电子优先进入能量较低的原子轨道。
¾泡利不相容原理(Pauli exclusion principle):每个轨道最多可以填充两个电子。
¾洪特规则(Hund’s rule):当电子数目少于能量相同的轨道(即简并轨道)数时,则以电子占据越多的轨道越稳定,以避免电子间的相互排斥。
5表1-1 有机化合物主要组成元素及相关周期或主族元素原子的核外电子排布IA IIA IIIA IVA VA VIA VIIA0H 1s1He 1s2Li 1s2 2s1Be1s22s2B1s22s22p1C1s22s22p2N1s22s22p3O1s22s22p4F1s22s22p5Ne1s22s22p6Na1s22s22p6 3s1Mg1s22s22p63s2Al1s22s22p63s23p1Si1s22s22p63s23p2P1s22s22p63s23p3S1s22s22p63s23p4Cl1s22s22p63s23p5Ar1s22s22p63s23p6八隅体(octet):最外层电子为全充满状态,能量最低,化学性质上表现为惰性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
合时或形成离子,倾向于形成每个原子的价层有8个电子的 化合物。
He 1s2 Ne 1s22s22p6
3
1、价键理论
原子最外层轨道的未充满状态是原子结合成分子的最 大动力。原子间通过电子的失去、获得或共享方式 结合在一起形成稳定的分子。
11
Introduction of Molecular Theory
• There are two electrons in the bonding molecular orbital, but the antibonding molecular orbital contains no electron
2s2
2s22p1
2s22p2
2s22p3
2s22p4
2s22p5
2s22p6
Na 1s2 2s22p6 3s1
Mg 1s2 2s22p6 3s2
Al 1s2 2s22p6 3s23p1
Si 1s2 2s22p6 3s23p2
P 1s2 2s22p6 3s23p3
S 1s2 2s22p6 3s23p4
性、选择性等分析比较)
2
1、价键理论
Atom ---- nucleus + electrons Electrons ---- moving around the nucleus
energy level of atomic orbitals: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s <
• The 1s atomic orbitals combine in a way that enhance each other, similar to two light waves or two sound waves that reinforce each other. It is a sigma bonding molecular orbital (σ 成键轨道)
HCN 氢氰酸
O NH
O
亚硝酸
OH CC H O HH 甲酸甲酯
OO CC HOH
甲酸酐
(3)Lewis结构简略式(机理分析时常用)
: : : : : : : :
: :
: : : : : : : :
O CH HO
H C N:
:
O NH
O
OH CC H O HH
OO CC HOH
7
2、分子轨道理论(Molecular Theory)
Cl 1s2 2s22p6 3s23p5
Ar 1s2 2s22p6 3s23p6
根据元素原子核外电子排布可以确定: 碳4价,氮3价,氧2价,氢1价
5
:: :
: :
::
::
::
有机化合物分子结构的表示方式
H H :C :H
H 甲烷
H:N :H H
氨
H:O:H 水
HH H :C ::C :H
乙烯
H:C ::O H
分子轨道理论是在价键轨道基础上发展起来的 分子轨道理论认为:
1、原子在相互结合形成共价键时,由原子轨道组成分子 轨道,分子轨道属于整个分子。 2、与原子轨道类似,分子轨道描述了分子中的电子云分 布情况,分子轨道也有特定的尺寸、形状和能量。 3、电子进入分子轨道同样符合能量最低原则、Pauli不相 容原理和Hund规则。
这种结合力称为化学键。 有机化合物中原子间主要以共享电子的方式,即共价
键的结合。
4
1、 价键理论
表1 有机化合物主要组成元素及相关周期或主族元素原子的核外电子排布
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
H
He
1s1
1s2
Li
Be
B
C
N
O
F
Ne
1s2
1s2
1s2
1s2
1s2
1s2
1s2
1s2
2s1
8
2 、分子轨道理论
随着两个氢原子相互靠近, 两个核和两个电子开始相 互作用,即原子轨道开始 发生重叠,到一定距离, 达到能量最低。
H.
.H
1s atomic 1s atomic orbital orbital
H: H =
bonding molecular orbital
9
2 、分子轨道理论
• 以氢分子为例:
antibonding molecular orbital
H.
.H
1s atomic orbital
H: H bonding molecular orbital
1s atomic orbital
12
Introduction of Molecular Theory • Similarly, the p-orbital combines head-to
• The 1s atomic orbitals can also combine in a way that cancel each other, producing a node between the nuclei. It is a sigma antibonding molecular orbital (σ* 反键轨道)
第一章
有机化合物分子结构基础
Structural Foundations for Organic Molecules
1
第一章围绕有机化合物结构理论展开
1、价键理论 2、分子轨道理论 3、杂化轨道理论 4、有机化合物结构表示方法(Lewis结构式、Kekulé结构
式和立体结构表示) 5、电负性与键的极性(反应的基本特征) 6、有机分子的基本骨架和官能团 7、共价键的断裂方式与活性中间体的基本结构(反应活
• The 1s atomic orbitals can combine in one
of two ways
a sigma bonding MO
该图中的“+”、“-”符号表示位相,而非电荷 σ键(成键轨道)
a sigma antibonding MO σ* 键 (反键轨道) 10
Introduction of Molecular Theory
甲醛
(1)Lewis结构式
:
: :
:: :: ::
:: ::
:::
::: :
:: ::
:::
H :C C:H
H H :C:N:H
HH
乙炔
甲胺
H H :C N:H
甲基亚胺
H :C N 氢氰酸
H H :C:O:H
H
甲醇
HO H H :C:C :C:H
HH
丙酮
6
(2)K甲酸
