dna的凝胶电泳
DNA的琼脂糖凝胶电泳实验原理和操作步骤

DNA的琼脂糖凝胶电泳实验原理和操作步骤DNA的琼脂糖凝胶电泳是一种常用的分子生物学技术,用于分析DNA 的大小和纯度,以及进行DNA分子的分离和纯化。
凝胶电泳实验可以帮助我们确定DNA样本的大小和获得纯化的DNA片段供进一步研究使用。
下面是DNA琼脂糖凝胶电泳实验的原理和操作步骤。
【原理】DNA琼脂糖凝胶电泳是根据DNA分子在电场中的不同迁移速率来分离大小不同的DNA片段。
琼脂糖凝胶是一种凝胶状物质,其孔隙大小能够将DNA分子限制在一定范围内,较大的DNA分子迁移速率较慢,而较小的DNA分子迁移速率较快。
琼脂糖凝胶通常是在平均浓度为1%至2%之间的范围内制备,以便在不同大小的DNA分子之间提供适当的分辨率。
实验中,DNA样品通过切割酶或PCR等方法获得,样品经过核酸电泳缓冲液稀释,并在琼脂糖凝胶板上进行电泳。
凝胶板两侧连接电源,DNA 的带电粒子将在电场的作用下从负极迁移到正极,迁移过程中形成DNA的“条带”,条带的位置和长度反映了DNA的大小。
通常,DNA条带由荧光染料或核酸染料标记,以便在电泳结束后进行可视化。
【操作步骤】以下是DNA琼脂糖凝胶电泳实验的一般操作步骤:1.制备琼脂糖凝胶板:a.准备琼脂糖粉末和核酸电泳缓冲液(通常为TAE或TBE缓冲液)。
b.按照说明书将琼脂糖粉末溶解于核酸电泳缓冲液中。
c.将溶液加热至沸腾并搅拌,使琼脂糖完全溶解。
d.将溶液倒入预先准备好的电泳仓中,插入梳子或制备好的孔板,使其凝固。
2.样品制备:a.提取DNA样品并测定其浓度。
b. 将DNA样品稀释到适当浓度,通常为10-50 ng/μL。
c. 添加适当的加载缓冲液,通常是一些染料和甘胺酸(glycine)或其他添加剂。
3.DNA加载和电泳:a.打开琼脂糖凝胶仓盖,将DNA样品负载于凝胶孔内。
b.将DNA负载区域和样品标注在电泳仓中,以便在电泳结束后可以准确识别DNA带。
c.关闭盖子,将电泳仓放入电泳设备中。
(完整word版)DNA凝胶电泳
DNA凝胶电泳实验原理DNA电泳主要分两类:(1)聚丙烯酰胺凝胶电泳适合分离1kb以下的片段,最高分辨率可达1bp,也用于分离寡核苷酸,在引物的纯化中也常用此中凝胶进行纯化,也称PAGE纯化。
(2)琼脂糖凝胶电泳可分离的DNA片段大小因胶浓度的不同而异,胶浓度为0.5~0.6%的凝胶可以分离的DNA片段范围为20bp~50kb。
电泳结果用溴化乙锭(EB)染色后可直接在紫外下观察,并且可观察的DNA条带浓度为纳克级,而且整个过程一般1小时即可完成。
由于该方法操作的简便和快速,在基因工程中较常用。
琼脂糖凝胶琼脂糖是从琼脂中分离得到,由1,3连接的吡喃型b-D-半乳糖和1,4连接的3,6脱水吡喃型阿a-L-半乳糖组成,形成相对分子量为104~105的长链。
琼脂糖加热溶解后分子呈随机线团状分布,当温度降低时链间糖分子上的羟基通过氢键作用相连接,形成孔径结构,而随着琼脂糖浓度不同形成不同大小的孔径。
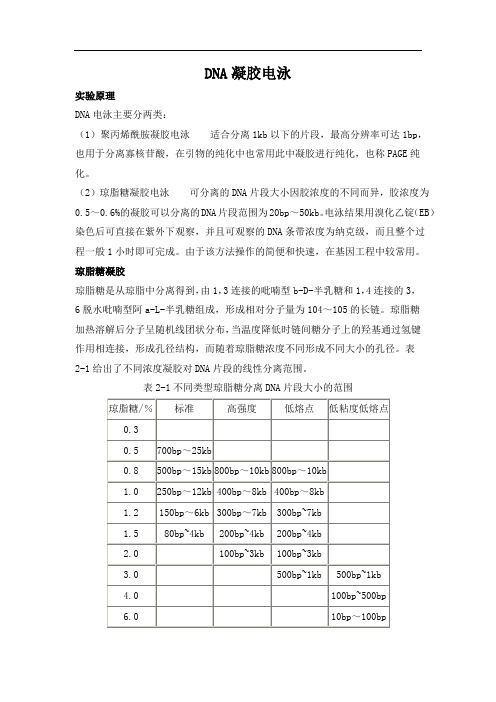
表2-1给出了不同浓度凝胶对DNA片段的线性分离范围。
表2-1不同类型琼脂糖分离DNA片段大小的范围由于琼脂糖凝胶是通过氢键的作用,因此过酸或过碱等破坏氢键形成的方法常用于凝胶的再溶化,象NaClO4能用于凝胶的裂解,一般的凝胶回收试剂盒利用的也是这一原理。
随着实验技术的发展,也针对不同用途开发了各种类型的琼脂糖凝胶:(1)低熔点琼脂糖凝胶,用于DNA片段的回收,且由于该种凝胶中无抑制酶,可在胶中进行酶切、连接等;(2)高熔点凝胶,可分离小于1kb的DNA片段,专用于PCR 产物的分析;(3)快速凝胶,电泳速度比普通凝胶中快一倍,可节省实验时间;(4)适用于DNA大片段的分离。
(5)其它类型。
各生产商还开发很多类型的凝胶,可根据实验要求选择不同类型的,选择原则是考虑合适的机械强度和熔点。
DNA电泳影响因素DNA为碱性物质,在电泳(缓冲液pH=8)时带负电荷,在一定的电场力作用下向正极泳动。
而DNA链上的负电荷伴随着DNA分子量的增加而增加,荷质比是一常数,故电泳中DNA的分离类似分子筛效应。
dna琼脂糖凝胶电泳条件

dna琼脂糖凝胶电泳条件DNA琼脂糖凝胶电泳是一种常用的DNA分析技术,广泛应用于分子生物学和遗传学研究中。
凝胶电泳通过将DNA片段在电场作用下沿凝胶运动,根据片段大小的不同被分离出来,从而实现对DNA样品的检测和分析。
本文将详细介绍DNA琼脂糖凝胶电泳的条件和步骤,并解释其原理和应用。
DNA琼脂糖凝胶电泳条件的设定是成功进行分析的关键。
下面将一步一步回答关于电泳条件的问题。
1. 凝胶选择:DNA琼脂糖凝胶电泳通常使用琼脂糖(agarose)凝胶,因其透明度高、质地均匀且易于制备和使用。
琼脂糖的浓度通常在0.5%至2%之间,视待测DNA片段的大小而定。
较长的DNA片段,一般需要较低浓度的琼脂糖。
2. 缓冲液选择:DNA琼脂糖凝胶电泳常用的缓冲液是TAE(三乙酸铝溶液)或TBE(三硼酸盐溶液)。
这两种缓冲液都能提供适当的离子强度和pH值,维持DNA 片段的稳定移动。
常见的TAE缓冲液配方是:40 mM三乙酸(Tris-Acetate)、1 mM EDTA(乙二胺四乙酸)。
TBE缓冲液配方为:90 mM三硼酸(Tris-Borate)、1 mM EDTA。
在使用缓冲液前,必须经过滤以去除杂质。
3. 电场强度设定:电泳过程中的电场强度直接影响DNA片段的迁移速度,因此需要根据待测DNA片段的大小和琼脂糖浓度来设定适当的电压。
通常,电场强度设置在5至10 V/cm之间,以避免DNA的热失活和琼脂糖的熔化。
4. 标准品选择:为了对待测DNA片段的大小进行估测,我们需要在电泳实验中加入标准品。
标准品是一系列已知大小的DNA片段,通常以Kb(千碱基对)为单位。
标准品可以购买或通过PCR扩增获得。
根据标准品的迁移位置和待测样品的迁移位置,可以估测待测DNA片段的大小。
5. 采样和加载样品:将待测DNA样品与DNA标记染料混合(如溴化乙锭)后,小心加载到琼脂糖凝胶的预制孔中。
为了减少加载误差,可以在样品中加入DNA大小标记品和负载控制品(如碱基作为分子量标准品)。
DNA的琼脂糖凝胶电泳

加样
用移液器将DNA 样品液5μL与 用移液器将 DNA样品液 5μL 与 6× 上样缓冲液 1μL混匀后加入加样孔,记录点样顺序。其中一 μL混匀后加入加样孔,记录点样顺序。 个加样孔中加入DNA分子量标准品6 个加样孔中加入DNA分子量标准品6
电泳
加样完毕,将靠近样品槽一端连接负极, 加样完毕,将靠近样品槽一端连接负极,另 一端连接正极(千万不要搞错) 接通电源, 一端连接正极(千万不要搞错),接通电源,开 始电泳。在样品进胶前可用略高电压, 始电泳。在样品进胶前可用略高电压,防上样品 扩散。 样品进胶后, 应控制电压降不高于5 扩散 。 样品进胶后 , 应控制电压降不高于 5 V/ cm(电压值 V 电泳板两极之间距离比 ) cm( 电压值V/ 电泳板两极之间距离比) 。 当染料 条带移动到距离凝胶前沿约lcm时 停止电泳。 条带移动到距离凝胶前沿约lcm时,停止电泳。
五、思考题
(1)琼脂糖与琼脂有什么不同?本次实验 为何选琼脂糖作为电泳介质? (2)上样缓冲液由哪些成分组成?各有何 作用? (3)常用的DNA琼脂糖凝胶电泳缓冲液有 )常用的DNA琼脂糖凝胶电泳缓冲液有 哪些?为何在这些电泳缓冲液中要加入 EDTA? EDTA?
琼脂和琼脂糖
琼脂是由琼脂糖和琼脂果胶组成的。琼脂糖是线性的多 聚物,基本结构是1,3连结的β 半乳呋喃糖和1,4连结的 聚物,基本结构是1,3连结的β-D-半乳呋喃糖和1,4连结的 3,6-脱水α-L-半乳呋喃糖。琼脂果胶是由许多更小的分子 3,6-脱水α 组成的异质混合物。它们的结构相似,但带硫酸根和羧 基组分,凝胶能力差。 琼脂糖具有亲水性,并几乎完全不存在带电基团,对敏 感的生物大分子极少引起变性和吸附,是理想的惰性载 体。在琼脂糖制备过程中需要把琼脂果胶尽量去除,否 则琼脂糖有可能存在极微量硫酸根和丙酮酸取代电离基 团,就会造成电内渗(EEO),电内渗对质点的移动产 团,就会造成电内渗(EEO),电内渗对质点的移动产 生影响。质量较好的琼脂糖硫酸根含量比较低,通常在 0.2%以下,电内渗比较小,通常在0.13以下。这也就是琼 0.2%以下,电内渗比较小,通常在0.13以下。这也就是琼 脂糖比琼脂贵那么多的原因了。
DNA的琼脂糖凝胶电泳

例如:普通琼脂凝胶电泳,很难分离大于50kb的DNA 分子。 如何研究超大片段DNA?
4 、 0.5 μg/mL 溴化乙啶染色液:称取 5mg 溴化乙啶,用去 离子水溶解,定容至100mL。从中取1mL,用无离子水稀 释至100mL。(有毒,戴手套,通风柜内进行。)
5、DNA Marker
DL2,000TM DNA Marker (TaKaRa公司)
本 Marker为已含有1×Loading Buffer的DNA溶液 可取5μL直接电泳
DNA分子在 pH值高于其等电点的溶液中带负 电荷,在电场中通过琼脂糖凝胶向阳极移动。
TBE缓冲液,pH8.3
不同大小、不同形状和不同构象的DNA 分子 在相同的电泳条件下(如凝胶浓度、电流、 电压、缓冲液等),有不同的迁移率,所以 可通过电泳使其分离。
D子大小、形状、构象。
注 意 要完全融化混匀
2、凝胶板的制备
置水平板于工作台面上,将样品槽模板(梳子)插进水
平板上凹槽内,距一端约 0.5cm。梳子底边与水平板表 面保持0.5-1mm的间隙。待琼脂糖冷至 65℃左右,小心
地倒入托盘内,使凝胶缓慢地展开在水平板表面形成一
层约3mm厚均匀胶层。静置0.5小时。 注 意 液内不存有气泡
二、试剂与器材
电泳仪
缓冲液 琼脂糖
凝胶槽
梳子 电泳槽
取液器
溴酚蓝
试 剂
1、Tris-硼酸-EDTA缓冲液(TBE缓冲液),pH8.3:称取 10.78gTris,5.50g硼酸,0.93g EDTA-Na2溶于去离子水, 定容至1000mL。
2、琼脂糖: 1g 溶于TBE缓冲液中加热配成100mL。 3、0.05%溴酚蓝-50%甘油溶液(5×Loading Buffer ) : 取一定量的0.1%溴酚蓝水溶液,与等体积甘油混合而成。
dna琼脂糖凝胶电泳原理

dna琼脂糖凝胶电泳原理DNA琼脂糖凝胶电泳是一种常用的分离、纯化和分析DNA分子的方法。
它基于DNA分子在电场下的迁移速度与其分子大小和形态之间的关系,利用琼脂糖凝胶的孔隙结构来分离DNA分子。
在这篇文章中,我将深入探讨DNA琼脂糖凝胶电泳的原理、方法和应用,并分享我的个人观点和理解。
一、DNA琼脂糖凝胶电泳的原理DNA分子是生物体内存储遗传信息的重要分子,其大小可在数百至数千碱基对之间。
DNA琼脂糖凝胶电泳是基于电荷分离的原理进行的。
DNA分子在电场中会带有负电荷,因此会受到电场力的作用而迁移。
琼脂糖凝胶是一种多孔性凝胶,可以形成一些微小的孔隙,这些孔隙能够根据DNA分子的大小和形态来筛选DNA分子。
当DNA样品通过琼脂糖凝胶电泳时,较小的DNA分子会迁移更快,而较大的DNA 分子会迁移更慢。
通过对琼脂糖凝胶上DNA分子的分离和检测,我们可以得到DNA分子的大小分布信息,进而进行DNA的纯化、分析和定性等研究。
二、DNA琼脂糖凝胶电泳的方法1. 准备琼脂糖凝胶:我们需要制备一定浓度的琼脂糖溶液,并加热融化。
我们将琼脂糖溶液倒入电泳槽中,在上下两端放置电极,形成一个电场。
2. 准备DNA样品:将需要进行分析的DNA样品与染料混合,使之具有一定的负电荷,并进行预处理,如加热变性。
3. 进行电泳分离:将DNA样品施加在琼脂糖凝胶孔隙上方,开启电源,使电场通过琼脂糖凝胶。
DNA分子会在电场力的作用下从样品孔隙处迁移到相反电极的方向。
迁移的速度与DNA分子的大小和形态有关,较小的DNA分子迁移较快,而较大的DNA分子迁移较慢。
4. 可视化和分析:凝胶电泳结束后,我们可以使用染料或放射性示踪剂来可视化DNA分子的分离结果,如荧光染料或放射性探针。
通过观察凝胶上的DNA条带,我们可以推测DNA分子的大小分布,进而对样品进行纯化、分析和定性等进一步研究。
三、DNA琼脂糖凝胶电泳的应用DNA琼脂糖凝胶电泳技术在分子生物学、遗传学和犯罪学等领域都有广泛的应用。
DNA的琼脂糖凝胶电泳DNA实验技术方法

DNA的琼脂糖凝胶电泳DNA实验技术方法琼脂糖凝胶电泳(Agarose gel electrophoresis)是一种常用的分离和分析DNA分子的技术方法。
本文将对DNA的琼脂糖凝胶电泳实验技术方法进行详细介绍。
1.原理琼脂糖凝胶电泳是一种基于DNA分子大小的分离方法。
DNA分子在电场的作用下,由于带负电荷,会向阳极移动。
由于琼脂糖凝胶的孔径不同,不同大小的DNA分子会被琼脂糖凝胶所阻碍,大分子相对较慢,小分子相对较快地通过凝胶孔隙。
通过电泳,可以将不同大小的DNA分子分离开来,形成一条条带状。
2.实验步骤(1)制备琼脂糖凝胶:将适量的琼脂糖加入1×TAE缓冲液中,加热溶解,冷却至约60℃时加入适量的乙溴酸溶液,振荡均匀后倒入电泳槽中,插入梳子形成孔洞。
(2)样品制备:将待测DNA溶解在缓冲液中(常用缓冲液为1×TBE或1×TAE),加入适量的显色剂(如溴化乙锭),混合均匀。
(3)装料和电泳:将样品倒入琼脂糖凝胶的样品槽中,注意避免气泡的产生。
将电泳槽连接电源,接通电源,设定适当的电压(通常为100-150V)进行电泳。
(4)分析结果:电泳结束后,关闭电源,取出凝胶,放入紫外光透射仪中观察凝胶上的DNA带状条带,并进行照相或记录。
3.实验注意事项(1)凝胶制备:凝胶溶液要充分均匀,避免不均匀分布造成的电泳结果不准确。
(2)样品制备:样品在加入缓冲液中时要充分混匀,避免DNA在样品中的不均匀性造成的电泳结果不准确。
(3)电泳条件:电泳条件包括电压、时间、缓冲液等。
较高的电压可以加快电泳速度,但会产生较多的带展平现象。
合适的电压应根据实验需要调整。
(4)结果分析:在紫外光透射仪下观察DNA带状条带时,要小心操作,避免DNA样品受到过长时间的紫外线照射。
4.应用领域琼脂糖凝胶电泳广泛应用于分离和分析DNA分子。
常见的应用领域包括:DNA片段的分子量测定、PCR产物分析、DNA测序结果的验证、突变检测等。
dna凝胶电泳原理

dna凝胶电泳原理
DNA凝胶电泳是一种常用的分离和鉴定DNA片段的方法,基于DNA分子电荷的大小和形状差异。
其原理是通过将DNA
样品运用电场作用力迁移到凝胶中进行分离。
下面将详细介绍其原理和步骤:
1. 准备凝胶:通常使用琼脂糖凝胶作为分离基质。
将琼脂糖加入缓冲溶液中,加热溶解后制备成凝胶。
凝胶浓度可根据需求选择,较低浓度适用于分离大分子量的DNA片段,较高浓度
适用于分离小分子量的DNA片段。
2. 配制电泳缓冲液:电泳缓冲液采用一种称为TAE(三羟乙
丙烷三乙酸)或TBE(三硼酸三甲酯)的缓冲盐溶液。
此缓
冲液有助于维持电流稳定性,平衡样品的电荷。
3. 加载DNA样品:将待检测的DNA样品与DNA标记物混合。
DNA标记物是在DNA片段末端加入荧光染料或放射性标记物,用于可视化DNA分子的迁移。
混合物应加入特定体积的加载
缓冲液中。
4. 分离电泳:将混合物缓慢、均匀地加入至凝胶的一个孔上,然后连接电源线,通以恒定电压,使DNA在凝胶中迁移。
DNA带根据片段的大小不同而以不同速度迁移,较长的片段
迁移较慢,较短的片段迁移较快。
5. 可视化分析:电泳结束后,凝胶在紫外线灯下进行照射,DNA片段会与标记物一起发光或显示出带状图案。
根据标记
物的位置和迁移距离,可以确定DNA片段的大小和数量。
DNA凝胶电泳可用于分析DNA片段长度、DNA浓度以及分离杂合子等。
它在分子生物学、遗传学和法医学等领域具有广泛应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四.实验步骤
6、电泳 安装好电极导线,点样孔一端接负极,另一端接 正极,打开电源,调电压至120V,电泳30min。 7、观察 取出凝胶,放在紫外灯下照相记录 电泳图谱。 五.实验结果与分析 对图谱拍照并分析。
实验16 DNA的电泳分析
一、实验目的 二、实验原理
学习和掌握琼脂糖电泳法鉴定DNA的原理和方法。 琼脂糖凝胶电泳是用于分离、鉴定和提纯DNA片段的标准 方法。琼脂糖是从琼脂中提取的一种多糖,具亲水性,但 不带电荷,是一种很好的电泳支持物。DNA在碱性条件下 带负电荷,在外加电场作用下向正极泳动。分子量越小跑 得越快,从而可以分离出分子量大小不同的DNA和RNA (RNA分子量较小,比DNA跑得快且呈弥散形)。本实验用 琼脂糖凝胶电泳分离DNA,其主要内容包括制胶,加样, 电泳,染色及拍照。
3、灌胶 待琼脂糖凝胶溶液冷却到60℃(手可接触),加入染料 (30mlTAE 加入1μ l染液),混匀。轻轻倒入电泳槽水平板 上。 4、插入梳子 5、加样 待琼脂糖凝胶干后 加入对照样品5μ l maker 将DNA样品与loading buffer按4:1混匀后(DNA 8μ l+loading buffer 2μ l),用微量移液器将混合液全部 加到点样孔中,记录样品的点样次序。 注意:点样时不要将样品点到点样孔之外(飘样),不 要将胶戳漏(漏样)。
1、安装电泳槽 将有机玻璃的电泳凝胶床洗净,晾干, 插入玻璃板将开口封好,放在水平的工 作台上。 2、琼脂糖凝胶的制备(一块凝胶) 将0.3g琼脂糖溶解于30ml缓冲液(TAE)中。 置微波炉(1min)或沸水浴中加热至完全溶化(不要加热至沸 腾),取出摇匀。 用移液枪取1ml热的琼脂糖凝胶将玻璃板的下缝堵住。
