初中化学实验现象汇总
初中化学实验现象总结大全

初中化学实验现象总结大全北斗升学助手 2017-07-1110:421、镁条在空气中燃烧:发出耀眼强光,放出大量热,生成白烟同时生成一种白色物质2、木条在氧气中燃烧:放出白光,放出热量3、硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体4、铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质5、加热试管中碳酸氢铵:有刺激性气味气体生成,试管口有液滴生成6、氢气在氯气中燃烧:发出苍白色火焰,产生大量的热,有雾生成7、在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成8、用木炭粉还原氧化铜粉末:黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊9、一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量10、向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成11、加热试管中硫酸铜晶体:蓝色晶体逐渐变为白色粉末,试管口有液滴生成12、钠在氯气中燃烧:剧烈燃烧,生成白色固体13、点燃纯净的氢气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成14、向含有Cl-的溶液中滴加硝酸酸化的硝银溶液:有白色沉淀生成15、向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液:有白色沉淀生成16、一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成17、在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成18、在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成19、在生石灰上加少量水:反应剧烈,发出大量热20、将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅21、将铜片插入硝酸汞溶液中:铜片表面有银白色物质附22、向盛有石灰的的试管里,注入浓的碳酸钠溶液:有白色沉淀生成23、细铜丝在氯气中燃烧后入水:有棕色的烟生成,加水后生成绿色的溶液24、强光照射氢气、氯气的混和氯和气体:迅速反就肆生爆炸,有雾生成25、红磷在氯气中燃烧:有白色烟雾生成26、氯气遇到湿的有色条:有色布条的颜色褪去27、加热浓盐酸与二氧化锰的混和物:有黄绿色刺激性气味气体生成28、给氯化钠定(固)与硫酸(浓)的和混合物加强热:有雾生成有刺少许性的气味29、在溴化钠溶液中滴加硝酸银溶液后再加硝酸:有浅黄色沉淀生成30、在碘化钾溶液中滴加硝酸银溶液后再加稀硝酸:有黄色沉淀生成31、.细铜丝在硫蒸气中燃烧:细铜丝发红后生成黑色物质32、铁粉与硫粉混和后加热到红热:反应继续进行,放出大量的热,生成黑色物质33、硫化氢气体不完全燃烧(在火焰上罩上蒸发皿):火焰呈淡蓝色(蒸发四底部有黄色的粉末)34、硫化氢气体完全燃烧(在火焰上罩上干冷烧杯):火焰呈淡蓝色,生成有刺激性气味的气体(烧杯内壁有液滴生成)35、在集气瓶中混和硫化氢和二氧化硫:瓶内壁有黄色粉末生成36、二氧化硫气体通入品红溶液后再加热:红色褪去,加热后又恢复原来颜色37、过量的铜投入盛有浓硫酸的试管,并加热,反应毕,待浓液冷却后加水:有刺激性气味的气体生成,加水后溶液呈蓝色38、加热盛有浓硫酸和木炭的试管:有气体生成,且气体有刺激性的气味39、钠在空气中燃烧:火焰呈黄色40、钠投入水中:反应激烈,钠浮于水面,放出大量的热使钠溶成小球在水面上游动,有嗤嗤声41、把水滴入盛有过氧化钠固体的试管,将带火星木条伸入试管口:木条复燃42、加热碳酸氢钠固体,使生成气体通入澄清石灰水:澄清的石灰水变浑浊43、氨气与氯化氢相遇:有大量的白烟产生44、加热氯化铵与氢氧化钙的混和物:有刺激性气味的气体产生45、铜与浓硝酸反应:反应激烈,有红棕色气体产生48、铜与稀硝酸反应(反应在试管中进行):试管下端产生无生气体,气体上升,逐渐变为红棕色49、在硅酸钠溶液中加入稀盐酸:有白色胶状沉淀产生50、在氢氧化铁胶体中加硫酸镁溶液:胶体变浑浊51、加热氢氧化铁胶体:胶体变浑浊52、将点燃的镁条伸入盛有二氧化碳的集气瓶中:剧烈燃烧,有黑色物质附着于集气瓶内壁53、向硫酸铝溶液中滴加氨水:生成蓬松的白色絮物质54、向硫酸亚铁溶液中滴加氢氧化钠溶液:有白色絮状沉淀产生,立即转变为灰绿色,一会儿又转为红褐色沉淀55、向含Fe3+的溶液中滴入KSCN溶液:溶液呈血红色56、向硫化钠水溶液中滴加氯水:溶液变浑浊S2-+Cl2=S+2Cl-57、向天然水中加入少量皂液:泡沫逐渐减少,且有沉淀产生58、在空气中点燃甲烷,并在火焰上罩上干冷烧杯:火焰呈淡蓝色,烧杯内壁有液滴产生59、光照甲烷与氯气的混和气体:黄绿色逐渐变浅(时间较长,容器内壁有液滴生成)60、加热(170℃)乙醇与浓硫酸的混和物,并使产生的气全通入溴水,通入酸性高锰酸钾溶液:有气体产生,溴水褪色,紫色逐渐变浅61、在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量62、在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量63、笨在空气中燃烧:火焰明亮,并带有黑烟64、将乙炔通入溴水:溴水颜色褪去65、将乙炔通入酸性高锰酸钾溶液:紫色逐渐变浅,直至褪去:66、苯与液溴、铁粉反应:有白雾产生,生成物油状且带有褐色67、将少量甲苯倒入少量酸性高锰酸钾溶液中,并振荡:紫色褪去68、将金属钠投入盛有乙醇的试管中:有气体放出69、在盛有少量苯酚的试管中滴入过量的浓溴水:有白色沉淀生成70、在盛有苯酚的试管中滴入几滴FeCl3溶液,并振荡:溶液显紫色71、乙醛与银氨溶液在试管中反应:洁净的试管内壁附着一层光亮如银的物质72、在加热至沸的情况下乙醛与新制氢氧化铜反应:有红色沉淀产生73、在适宜条件下乙醇和乙酸反应:有透明的带香味的油状液体生成科学收藏举报世上没有一件工作不辛苦,没有一处人事不复杂。
初中化学实验现象总结大全

初中化学实验现象总结大全
一、溶解现象
1、溶剂液体蒸发:溶质溶于溶剂,溶剂液体集中在溶剂中,当其扩散到空气中时,溶剂液体随气流而散发,蒸发挥发,从而溶质析出。
2、挥发性溶剂溶质会慢慢挥发:溶质溶于挥发性溶剂,当热量使溶质气化后,慢慢挥发,吸收热量,溶质析出。
3、融化:某些固体溶质在适当的温度下,溶质完全溶解,而溶质析出。
二、结晶现象
1、滴液析出:某种溶质或溶剂沉积到固态表面,使溶质析出,形成滴液状的晶体。
2、霍夫曼析出:在溶液中,溶质有一定比例有规律地移动,形成晶体,叫做霍夫曼析出。
3、沸腾析出:把溶液沸腾一段时间,溶质就会蒸发析出,析出晶体形成沸腾析出。
三、沉淀现象
1、热沉淀:当溶液热度提高时,由于温度升高,溶质的活力增强,溶质析出,形成沉淀物。
2、冷沉淀:把溶液冷却,溶质的活力减弱,溶质沉淀,形成沉淀物。
3、加入试剂沉淀:加入一定的试剂,使溶质的活力减弱,溶质
析出,析出沉淀物。
初中化学实验现象大全

初中化学实验现象大全学习化学的过程中,会有很多实验的过程,每个化学实验都有其独特的现象,下面是整理的初中化学实验现象大全,希望大家喜欢。
初中化学实验现象大全1、镁条在空气中燃烧:发出耀眼强光,放出大量热,生成白烟同时生成一种白色物质2、木条在氧气中燃烧:放出白光,放出热量3、硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体4、铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质5、加热试管中碳酸氢铵:有刺激性气味气体生成,试管口有液滴生成6、氢气在氯气中燃烧:发出苍白色火焰,产生大量的热,有雾生成7、在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成8、用木炭粉还原氧化铜粉末:黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊9、一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量10、向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成11、加热试管中硫酸铜晶体:蓝色晶体逐渐变为白色粉末,试管口有液滴生成12、钠在氯气中燃烧:剧烈燃烧,生成白色固体13、点燃纯净的氢气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成14、向含有Cl-的溶液中滴加硝酸酸化的硝银溶液:有白色沉淀生成15、向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液:有白色沉淀生成16、一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成17、在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成18、在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成19、在生石灰上加少量水:反应剧烈,发出大量热20、将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅21、在加热至沸的情况下乙醛与新制氢氧化铜反应:有红色沉淀产生22、向盛有石灰的的试管里,注入浓的碳酸钠溶液:有白色沉淀生成23、细铜丝在氯气中燃烧后入水:有棕色的烟生成,加水后生成绿色的溶液24、强光照射氢气、氯气的混和氯和气体:迅速反就肆生爆炸,有雾生成25、红磷在氯气中燃烧:有白色烟雾生成26、氯气遇到湿的有色条:有色布条的颜色褪去27、加热浓盐酸与二氧化锰的混和物:有黄绿色刺激性气味气体生成28、给氯化钠定(固)与硫酸(浓)的和混合物加强热:有雾生成有刺少许性的气味29、在溴化钠溶液中滴加硝酸银溶液后再加硝酸:有浅黄色沉淀生成30、在碘化钾溶液中滴加硝酸银溶液后再加稀硝酸:有黄色沉淀生成31、.细铜丝在硫蒸气中燃烧:细铜丝发红后生成黑色物质32、铁粉与硫粉混和后加热到红热:反应继续进行,放出大量的热,生成黑色物质33、硫化氢气体不完全燃烧(在火焰上罩上蒸发皿):火焰呈淡蓝色(蒸发四底部有黄色的粉末)34、硫化氢气体完全燃烧(在火焰上罩上干冷烧杯):火焰呈淡蓝色,生成有刺激性气味的气体(烧杯内壁有液滴生成)35、在集气瓶中混和硫化氢和二氧化硫:瓶内壁有黄色粉末生成36、二氧化硫气体通入品红溶液后再加热:红色褪去,加热后又恢复原来颜色37、过量的铜投入盛有浓硫酸的试管,并加热,反应毕,待浓液冷却后加水:有刺激性气味的气体生成,加水后溶液呈蓝色38、加热盛有浓硫酸和木炭的试管:有气体生成,且气体有刺激性的气味39、钠在空气中燃烧:火焰呈黄色40、钠投入水中:反应激烈,钠浮于水面,放出大量的热使钠溶成小球在水面上游动,有嗤嗤声41、把水滴入盛有过氧化钠固体的试管,将带火星木条伸入试管口:木条复燃42、加热碳酸氢钠固体,使生成气体通入澄清石灰水:澄清的石灰水变浑浊43、在适宜条件下乙醇和乙酸反应:有透明的带香味的油状液体生成44、加热氯化铵与氢氧化钙的混和物:有刺激性气味的气体产生45、铜与浓硝酸反应:反应激烈,有红棕色气体产生48、铜与稀硝酸反应(反应在试管中进行):试管下端产生无生气体,气体上升,逐渐变为红棕色49、在硅酸钠溶液中加入稀盐酸:有白色胶状沉淀产生50、在氢氧化铁胶体中加硫酸镁溶液:胶体变浑浊51、加热氢氧化铁胶体:胶体变浑浊52、将点燃的镁条伸入盛有二氧化碳的集气瓶中:剧烈燃烧,有黑色物质附着于集气瓶内壁53、向硫酸铝溶液中滴加氨水:生成蓬松的白色絮物质54、向硫酸亚铁溶液中滴加氢氧化钠溶液:有白色絮状沉淀产生,立即转变为灰绿色,一会儿又转为红褐色沉淀55、向含Fe3+的溶液中滴入KSCN溶液:溶液呈血红色56、向硫化钠水溶液中滴加氯水:溶液变浑浊S2-+Cl2=S+2Cl-57、向天然水中加入少量皂液:泡沫逐渐减少,且有沉淀产生58、在空气中点燃甲烷,并在火焰上罩上干冷烧杯:火焰呈淡蓝色,烧杯内壁有液滴产生59、光照甲烷与氯气的混和气体:黄绿色逐渐变浅(时间较长,容器内壁有液滴生成)60、加热(170℃)乙醇与浓硫酸的混和物,并使产生的气全通入溴水,通入酸性高锰酸钾溶液:有气体产生,溴水褪色,紫色逐渐变浅61、在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量62、在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量63、笨在空气中燃烧:火焰明亮,并带有黑烟64、将乙炔通入溴水:溴水颜色褪去65、将乙炔通入酸性高锰酸钾溶液:紫色逐渐变浅,直至褪去:66、苯与液溴、铁粉反应:有白雾产生,生成物油状且带有褐色67、将少量甲苯倒入少量酸性高锰酸钾溶液中,并振荡:紫色褪去68、将金属钠投入盛有乙醇的试管中:有气体放出69、在盛有少量苯酚的试管中滴入过量的浓溴水:有白色沉淀生成70、在盛有苯酚的试管中滴入几滴FeCl3溶液,并振荡:溶液显紫色71、乙醛与银氨溶液在试管中反应:洁净的试管内壁附着一层光亮如银的物质初中化学实验现象大全。
初中化学实验现象总结大全
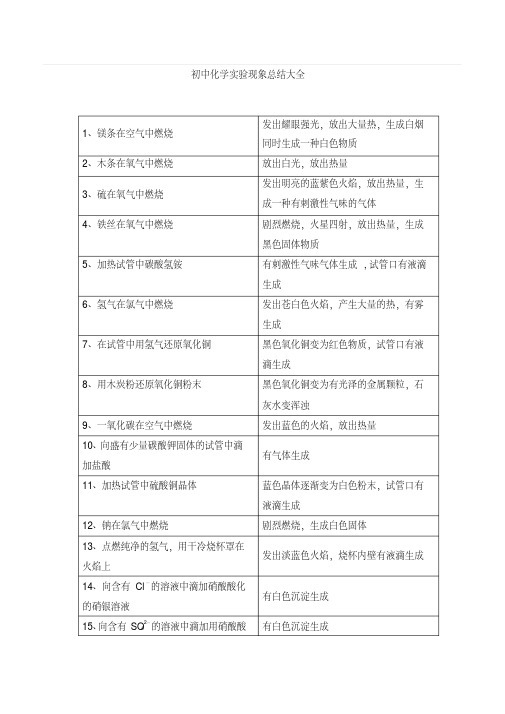
初中化学实验现象总结大全1、镁条在空气中燃烧发出耀眼强光,放出大量热,生成白烟同时生成一种白色物质2、木条在氧气中燃烧放出白光,放出热量3、硫在氧气中燃烧发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体4、铁丝在氧气中燃烧剧烈燃烧,火星四射,放出热量,生成黑色固体物质5、加热试管中碳酸氢铵有刺激性气味气体生成,试管口有液滴生成6、氢气在氯气中燃烧发出苍白色火焰,产生大量的热,有雾生成7、在试管中用氢气还原氧化铜黑色氧化铜变为红色物质,试管口有液滴生成8、用木炭粉还原氧化铜粉末黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊9、一氧化碳在空气中燃烧发出蓝色的火焰,放出热量10、向盛有少量碳酸钾固体的试管中滴加盐酸有气体生成11、加热试管中硫酸铜晶体蓝色晶体逐渐变为白色粉末,试管口有液滴生成12、钠在氯气中燃烧剧烈燃烧,生成白色固体13、点燃纯净的氢气,用干冷烧杯罩在火焰上发出淡蓝色火焰,烧杯内壁有液滴生成14、向含有Cl-的溶液中滴加硝酸酸化的硝银溶液有白色沉淀生成15、向含有SO42-的溶液中滴加用硝酸酸有白色沉淀生成化的氯化钡溶液16、一带锈铁钉投入盛稀硫酸的试管中并加热铁锈逐渐溶解,溶液呈浅黄色,并有气体生成17、在硫酸铜溶液中滴加氢氧化钠溶液有蓝色絮状沉淀生成18、在三氯化铁溶液中滴加氢氧化钠溶液有红褐色沉淀生成19、在生石灰上加少量水反应剧烈,发出大量热20、将一洁净铁钉浸入硫酸铜溶液中铁钉表面有红色物质附着,溶液颜色逐渐变浅21、将铜片插入硝酸汞溶液中铜片表面有银白色物质附22、向盛有石灰的的试管里,注入浓的碳酸钠溶液有白色沉淀生成23、细铜丝在氯气中燃烧后入水有棕色的烟生成,加水后生成绿色的溶液24、强光照射氢气、氯气的混和氯和气体迅速反就肆生爆炸,有雾生成25、红磷在氯气中燃烧有白色烟雾生成26、氯气遇到湿的有色条有色布条的颜色褪去27、加热浓盐酸与二氧化锰的混和物有黄绿色刺激性气味气体生成28、给氯化钠定(固)与硫酸(浓)的和混合物加强热有雾生成有刺少许性的气味29、在溴化钠溶液中滴加硝酸银溶液后再加硝酸有浅黄色沉淀生成30、在碘化钾溶液中滴加硝酸银溶液后再加稀硝酸有黄色沉淀生成31、.细铜丝在硫蒸气中燃烧细铜丝发红后生成黑色物质32、铁粉与硫粉混和后加热到红热反应继续进行,放出大量的热,生成黑色物质33、硫化氢气体不完全燃烧(在火焰上火焰呈淡蓝色(蒸发四底部有黄色的粉罩上蒸发皿)末)34、硫化氢气体完全燃烧(在火焰上罩上干冷烧杯)火焰呈淡蓝色,生成有刺激性气味的气体(烧杯内壁有液滴生成)35、在集气瓶中混和硫化氢和二氧化硫瓶内壁有黄色粉末生成36、二氧化硫气体通入品红溶液后再加热红色褪去,加热后又恢复原来颜色37、过量的铜投入盛有浓硫酸的试管,并加热,反应毕,待浓液冷却后加水有刺激性气味的气体生成,加水后溶液呈蓝色38、加热盛有浓硫酸和木炭的试管有气体生成,且气体有刺激性的气味39、钠在空气中燃烧火焰呈黄色40、钠投入水中反应激烈,钠浮于水面,放出大量的热使钠溶成小球在水面上游动,有嗤嗤声41、把水滴入盛有过氧化钠固体的试管,将带火星木条伸入试管口木条复燃42、加热碳酸氢钠固体,使生成气体通入澄清石灰水澄清的石灰水变浑浊43、氨气与氯化氢相遇有大量的白烟产生44、加热氯化铵与氢氧化钙的混和物有刺激性气味的气体产生45、铜与浓硝酸反应反应激烈,有红棕色气体产生48、铜与稀硝酸反应(反应在试管中进行)试管下端产生无生气体,气体上升,逐渐变为红棕色49、在硅酸钠溶液中加入稀盐酸有白色胶状沉淀产生50、在氢氧化铁胶体中加硫酸镁溶液胶体变浑浊51、加热氢氧化铁胶体胶体变浑浊52、将点燃的镁条伸入盛有二氧化碳的气瓶中剧烈燃烧,有黑色物质附着于集气瓶内壁53、向硫酸铝溶液中滴加氨水生成蓬松的白色絮物质54、向硫酸亚铁溶液中滴加氢氧化钠溶液有白色絮状沉淀产生,立即转变为灰绿色,一会儿又转为红褐色沉淀55、向含Fe3+的溶液中滴入KSCN溶液溶液呈血红色56、向硫化钠水溶液中滴加氯水溶液变浑浊 S2-+Cl2=S+2Cl-57、向天然水中加入少量皂液泡沫逐渐减少,且有沉淀产生58、在空气中点燃甲烷,并在火焰上罩上干冷烧杯火焰呈淡蓝色,烧杯内壁有液滴产生59、光照甲烷与氯气的混和气体黄绿色逐渐变浅(时间较长,容器内壁有液滴生成)60、加热(170。
初中化学必考80个实验现象详细总结

初中化学必考80个实验现象详细总结1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管壁上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,并使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11.向盛有少量碳酸钾固体的试管中滴加盐酸:有气泡产生。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有氯离子的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。
初中化学常见实验现象知识点整理

初中化学常见实验现象知识点整理化学是一门实验性较强的科学学科,通过实验我们可以观察和探索各种不同的化学现象。
在初中阶段,学生常常接触到一些常见的化学实验现象,掌握这些实验现象对理解化学概念和原理非常重要。
本文将对初中化学常见实验现象进行整理。
1. 金属与非金属的反应金属与非金属物质之间的反应是化学实验中经常遇到的现象之一。
例如,将铁钉放入酸中,会发生气泡并产生气体。
这是由于铁与酸反应产生了氢气的缘故。
类似地,将钠放入水中也会发生剧烈的反应,产生氢气和氢氧化钠。
2. 酸碱中的指示剂变色现象指示剂是用于酸碱中进行酸碱度测试的一种物质。
常见的指示剂有酚酞、酚酞红、溴酚蓝等。
当酸、碱的浓度发生变化时,指示剂会发生颜色变化。
例如,加入酚酞指示剂到酸性溶液中会呈现红色,而加入到碱性溶液中则会呈现黄色。
3. 金属的氧化反应与还原反应金属的氧化反应是指金属与氧气反应。
例如,在空气中金属铜表面会逐渐生成铜(II)氧化物,呈现绿色。
这个变化可以通过放置铜片一段时间再取出观察得知。
与氧化反应相对应的是金属的还原反应。
例如,当铜(II)氧化物与氢气反应时,氧化物被还原为金属铜。
4. 电解质的电导性电解质是一种能在水中离解成离子的化合物。
通过测量电解质溶液的电导性可以判断其酸碱性。
电解质溶液的电导性与其浓度和离子浓度有关。
当浓度越高,离子浓度越高时,电导性越强。
而纯水和非电解质溶液则没有电导性。
5. 燃烧与火焰颜色燃烧是一种常见的化学反应,也是初中化学实验中经常遇到的现象。
不同物质燃烧时产生的火焰颜色也不同。
例如,钠燃烧时火焰呈现明亮的橙黄色,铜燃烧时火焰呈现绿色。
6. 沉淀反应沉淀反应是指两种溶液混合后产生的沉淀现象。
例如,加入氯化银溶液和氯化钠溶液可以观察到白色沉淀的生成。
这是因为氯化银与氯化钠反应生成了不溶于水的氯化银沉淀。
7. 萃取法分离混合物萃取法是一种常用的化学实验手段,用于分离混合物中的有机物和无机物。
例如,水和油的混合物可以通过加入醋酸和振荡后,分层逐渐分离开来。
初中化学实验现象汇总

HCl+NH3==NH4Cl
32、氧化汞分解
红色粉末变成银白色液体,生成的气体能使到火星的木条重新燃烧
2HgO 2Hg+O2↑
33、一氧化碳与新鲜鸡血
血液由深红色变成鲜红色
酸、碱、盐的性质
34、稀硫酸与氧化铜
黑色粉末逐渐溶解,形成蓝色溶液
CuO+H2SO4==CuSO4+H2O
35、稀盐酸与铁锈
铁锈逐渐消失,溶液变黄色
Fe2O3+6HCl==2FeCl3+3H2O
36、稀盐酸与氢氧化钠溶液(滴有酚酞试液)
溶液由红色变成无色
HCl+NaOH==NaCl+H2O
37、稀硫酸与氢氧化钠溶液(滴有酚酞试液)
H2SO4+2NaOH==Na2SO4+2H2O
38、稀盐酸与硝酸银溶液
有不溶于稀硝酸的白色沉淀生成
2H2O 2H2↑+O2↑
氧气的制取
15、实验室制氧气
2KMnO4K2MnO4+MnO2+ O2↑
加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO32KCl+3O2↑
KClO32KCl+3O2↑
有气泡产生
2H2O22H2O+O2↑
二氧化碳的制取
16、实验室制二氧化碳
有大量气泡产生
CaCO3+2HCl==CaCl2+ H2O+CO2↑
23、二氧化碳与碳
二氧化碳通过灼热的碳层
CO2+C 2CO
金属与稀酸或盐溶液的置换反应
24、镁与稀盐酸或稀硫酸
有大量气泡产生,镁条逐渐消失,同时放出热。
初中化学实验现象总结大全

初中化学实验现象总结大全初中化学实验是帮助学生巩固化学知识、学习科学研究方法、培养科学实验技能的重要环节。
下面将就一些常见的化学实验现象进行总结,以帮助学生更好地理解实验现象和初中化学知识。
一、酸碱反应酸碱反应是指酸与碱在一定条件下发生化学反应的过程。
该实验通常会出现以下现象:1. 酸碱指示剂变色:将酸碱指示剂加入酸碱溶液中,溶液颜色会发生变化,如苏丹红、酚酞等。
2. 产生气体:在酸和碱溶液混合的过程中,会产生气体,例如醋酸与碱反应会释放出二氧化碳气体。
3. 放热或吸热:酸碱溶液混合过程中会伴随着放热或吸热现象,根据溶液的温度变化可以判断是否发生了酸碱反应。
二、金属与非金属反应金属与非金属的反应是用来检验金属活性的实验,常见的反应有如下现象:1. 产生气体:金属与非金属反应时会产生气体,例如锌与稀盐酸反应会产生氢气。
2. 生成新的物质:金属与非金属反应会生成新的物质,通常可以通过判断产物的颜色、溶解性、形态等性质来判断反应是否发生。
三、燃烧反应燃烧反应是指物质与氧气在适当条件下发生反应,通常会出现以下现象:1. 燃烧:物质在燃烧过程中会发出明亮的火焰。
2. 产生光和热:燃烧会伴随着光和热的释放,放热现象可以用温度计来测量。
四、氧化还原反应氧化还原反应是指物质通过氧化或还原的过程,通常会出现以下现象:1. 颜色变化:氧化还原反应中,物质的颜色会发生变化,可以用现象来判断是否发生了氧化还原反应。
2. 电流流动:氧化还原反应中,电子会从被氧化物流到了还原物上,因此在电解质溶液中则会伴随着电流流动的现象。
以上是初中化学实验中常见的实验现象的总结,通过实验可帮助学生更好地理解化学知识,掌握科学实验技能。
请注意,以上内容仅供参考,具体内容可以根据实验情况进行调整和补充。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学实验现象汇总初中化学实验现象汇总实验项目主要现象化学方程式氧气的化学性质1、木炭在氧气(空气)中燃烧(不完全燃烧)发出白光(红光),生成能使澄清石灰水变浑浊的无色气体C+O2CO2(2C+O22CO)2、硫在氧气中燃烧发出明亮的蓝紫色火焰,放热,生成有刺激性气味的无色气体S+O2SO23、硫在空气中燃烧发出微弱的淡蓝色火焰,放热,生成有刺激性气味的无色气体4、红磷在空气中燃烧发光,放热,生成大量白烟和白色固体4P+5O22P2O55、铜在空气中加热铜片表面有黑色物质生成2Cu+O22CuO6、铁丝在氧气中燃烧剧烈燃烧,火星四射,放出热量,生成黑色固体3Fe+2O2Fe3O47、铝箔在氧气中燃烧发出耀眼白光,生成白色固体4Al+3O22Al2O38、镁在空气中燃烧发出耀眼白光,放出大量热,生成一缕白烟同时生成一种白色物质2Mg+O22MgO9、纯净的氢气在空气中燃烧发出淡蓝色火焰,放出大量热,干冷烧杯内壁有水珠生成2H2+O22H2O10、点燃氢气和空气的混合气发生爆炸11、一氧化碳在空气中燃烧发出蓝色的火焰,放出大量热,生成一种能使澄清石灰水变浑浊的气体2CO+O22CO212、甲烷在空气中燃烧发出明亮的蓝色火焰,放出热量,生成一种能使澄清石灰水变混浊的气体和小水珠CH4+2O22H2O+CO213、酒精燃烧发出蓝色火焰C2H5OH+3O22CO2+3H2O水的化学性质14、电解水有大量气泡产生,插入正极的试管内汇集的气体体积与插入负极的试管内汇集的气体体积之比约为1∶22H2O 2H2↑+O2↑氧气的制取15、实验室制氧气2KMnO4K2MnO4+MnO2+O2↑加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO32KCl+3O2↑KClO32KCl+3O2↑有气泡产生2H2O22H2O+O2↑二氧化碳的制取16、实验室制二氧化碳有大量气泡产生CaCO3+2HCl==CaCl2+ H-2O+CO2↑17、煅烧石灰石(工业制二氧化碳)CaCO3CaO+CO2↑碳、一氧化碳、氢气的还原性18、用木炭粉还原氧化铜粉末黑色粉末变成光亮红色,生成的无色气体能使石灰水变浑浊C+2CuO 2Cu+CO2↑19、一氧化碳与氧化铜黑色粉末变成红色,生成的无色气体能使石灰水变浑浊CO+CuO Cu+CO220、一氧化碳还原氧化铁红色粉末逐渐变黑,生成一种能使澄清石灰水变浑浊的气体3CO+Fe2O32Fe+3CO220、氢气与氧化铜黑色的粉末变成红色,试管口有水珠生成H2+CuO Cu+H2O 二氧化碳的化学性质21、二氧化碳通入石蕊液石蕊液由紫色变成红色CO2+H2O==H2CO322、二氧化碳与石灰水石灰水变浑浊CO2+Ca(OH)2= CaCO3↓+H2O23、二氧化碳与碳二氧化碳通过灼热的碳层CO2+C 2CO金属与稀酸或盐溶液的置换反应24、镁与稀盐酸或稀硫酸有大量气泡产生,镁条逐渐消失,同时放出热。
Mg+2HCl==MgCl2+H2↑Mg+H2SO4=MgSO4+ H2↑25、锌与稀盐酸或稀硫酸有大量气泡产生,锌粒逐渐消失,同时放出热。
Zn+2HCl==ZnCl2+H2↑Zn+H2SO4=ZnSO4+ H2↑26、铁与稀盐酸或稀硫酸有气泡产生,溶液逐渐变为浅绿色。
Fe+2HCl==FeCl2+H2↑Fe+H2SO4=FeSO4+ H2↑金属与盐溶液的置换反应27、铁与硫酸铜溶液铁钉表面有紫红色物质附着,溶液由蓝色逐渐变浅Fe+CuSO4=FeSO4+ Cu28、铝与硫酸铜溶液铝丝表面覆盖一层红色物质2Al+3CuSO4=Al2(SO4)3+ 3Cu29、铜与硝酸银溶液铜片表面有银白色物质附着,溶液由无色变为蓝色Cu+2AgNO3=Cu(NO3)2+2Ag30、铜与硝酸汞溶液铜丝表面覆盖一层银白色的物质Cu+Hg(NO3)2=Cu(NO3)2+Hg 其它31、浓氨水遇浓盐酸有白烟产生HCl+NH3==NH4Cl32、氧化汞分解红色粉末变成银白色液体,生成的气体能使到火星的木条重新燃烧2HgO 2Hg+O2↑33、一氧化碳与新鲜鸡血血液由深红色变成鲜红色酸、碱、盐的性质34、稀硫酸与氧化铜黑色粉末逐渐溶解,形成蓝色溶液CuO+H2SO4==CuSO4+H2O35、稀盐酸与铁锈铁锈逐渐消失,溶液变黄色Fe2O3+6HCl==2FeCl3+3H2O36、稀盐酸与氢氧化钠溶液(滴有酚酞试液)溶液由红色变成无色HCl+NaOH==NaCl+H2O37、稀硫酸与氢氧化钠溶液(滴有酚酞试液)H2SO4+2NaOH==Na2SO4+2H2O38、稀盐酸与硝酸银溶液有不溶于稀硝酸的白色沉淀生成HCl+AgNO3==AgCl↓+HNO339、氯化钠与硝酸银溶液NaCl+AgNO3==AgCl↓+NaNO340、稀硫酸与氯化钡溶液H2SO4+BaCl2==BaSO4↓+2HCl42、碳酸钠与氯化钡溶液生成可溶于稀硝酸的白色沉淀 Na2CO3+BaCl2==BaCO3↓+2NaCl43、氢氧化钠溶液与二氧化碳无现象2NaOH+CO2==Na2CO3+H2O碱+ 盐-------- 另一种碱+ 另一种盐44、氢氧化钠与硫酸铜溶液有蓝色沉淀生成2NaOH+CuSO4==Na2SO4+ Cu(OH)2↓45、石灰水与硫酸铜溶液Ca(OH)2+CuSO4=CaSO4+C u(OH)2↓46、氢氧化钠与氯化铁溶液有红褐色沉淀生成3NaOH+FeCl3==3NaCl+Fe(OH)3↓47、石灰水与氯化铁溶液3Ca(OH)2+2FeCl3=3CaCl2+2Fe(OH)3↓48、生石灰与水白色块状固体变成粉末,产生CaO+H2O==Ca(OH)2白色烟雾,放出大量热49、用纯碱和熟石灰制烧碱有白色沉淀生成Ca(OH)2+Na2CO3=CaCO3↓+2Na OH50、用玻璃棒蘸浓硫酸在纸上写字蘸有浓硫酸的纸变黑并破损51、稀盐酸和氢氧化钠溶液反应放热52、硝酸铵投入水中溶解,吸热53、氢氧化钠投入水中溶解,放出大量热54、铜片与黄铜片互相划刻铜片表面有划痕,黄铜没有酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水1. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O2. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O3. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O4. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)1.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O2. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O3. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O4. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐1.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑2.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑3碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑4. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水5.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 6.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 7.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 8.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 9. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O (2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐10. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO3.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl。
