石蜡切片免疫荧光染色方法
石蜡切片免疫组化染色步骤

石蜡切片免疫组化染色步骤石蜡切片免疫组化染色是一种常用的实验技术,用于研究组织、细胞和分子的结构与功能。
它通过使用抗体与特定抗原相互结合,然后使用酶、免疫荧光等标记物来检测这种结合,从而实现可视化染色和定位目标分子的目的。
下面,我们将详细介绍石蜡切片免疫组化染色的步骤。
步骤一:蜡块去蜡石蜡切片通常是由固定的组织样本制备而成,这些样本在处理过程中会被包埋在石蜡中。
因此,第一步是将蜡块去蜡。
首先,将蜡块放在温水中加热,使蜡块软化。
然后,将蜡块用刮刀从玻片上刮下。
这样可以得到蜡块去蜡后的组织样本。
步骤二:样本再固定在蜡块去蜡后,为了更好地保持组织的完整性和稳定性,通常需要对样本进行再固定。
常用的再固定方法是将样本放入4%的中性缓冲福尔马林溶液中,在室温下固定4-24小时。
固定后,将样本从福尔马林中取出,用PBS(磷酸缓冲盐溶液)洗涤数次,以去除残余的福尔马林。
步骤三:切片制备在样本再固定后,需要将样本制备成切片。
首先,将组织样本放入甲醇中脱水,然后转移到乙醚中脱脂。
脱脂后,将样本放入苯骚酸乙酯中浸泡,使样本渗透均匀。
在苯骚酸乙酯中浸泡一段时间后,将样本转移到石蜡中浸泡。
石蜡具有很好的切片性能,可以更好地保持组织的结构。
最后,将样本放入石蜡包埋机中,进行加热和固化,制备成为石蜡块。
之后,使用旋转切片机将石蜡块切成4-6微米厚的切片。
切片后,将切片浸泡在热水中,使其展开并粘附在玻片上。
步骤四:抗原修复切片制备完毕后,需要对切片进行抗原修复。
抗原修复是为了使样本中的抗原能够更好地暴露出来,增加抗体的结合效率。
常用的抗原修复方法有热处理和化学处理两种。
热处理通常是将切片浸泡在含有缓冲盐的蒸馏水中,然后加热至高温(如95摄氏度)保持一定时间。
化学处理通常是将切片浸泡在含有抗原修复试剂的溶液中,如EDTA(乙二胺四乙酸二钠)溶液。
抗原修复的时间和条件需根据具体实验的要求来确定。
步骤五:非特异性结合阻断为了减少非特异性结合,需要对切片进行非特异性结合阻断。
免疫组织荧光染色法实验操作流程
4℃过夜
加Ⅰ抗
0.3%PBST浸洗
2*5min
在加Ⅰ抗的时候,要用吸水纸吸干周围的水,用pad笔画圈,防止Ⅰ抗流失,影响效果。
驴抗兔488
1h
加Ⅱ抗
1×PBS浸洗
3*5min
室温下1h,注意要避光。如果需要进行双标,在从封闭开始进行,
含DAPI的封片液封片
封片
因封片液中含有DAPI染细胞核(蓝色),所以不用做核的染色。
自然冷却
封闭
蒸馏水洗
2*3min
Ⅰ抗为兔抗鼠,Ⅱ抗就应该为**抗兔,所以我们封闭时选用被抗最少的物种,一般选用牛血清或者驴血清。再封闭时,为了防止封闭液流失,可以用pad笔在标本周围画圈,提高液体的利用度。
0.3%PBST浸洗
2*5min
5%驴血清封闭
室温1h
(PBS配)
加Ⅰ抗
0.3%PBST浸洗
2*5min
100%乙醇Ⅰ
5min
100%乙醇Ⅱ
5min
95%乙醇
2min
90%乙醇
2min
80%乙醇
2min
70%乙醇
2min
蒸馏水(浸洗)
3*2min
抗原
修复
高压锅柠檬酸盐缓冲液
3min
先将柠檬酸盐缓冲液加到洗盒里,加热高压锅,待柠檬酸盐缓冲液升温至60℃左右时放入水化后的标本,盖好高压锅,不加压力阀。加热高压锅,待压力阀处冒水蒸汽时,盖上压力阀,加热三分钟。压力降到正常大气压后打开锅盖,待玻片自然冷却。
含DAPI的封片液封片
冰冻切片(贴片)
操作步骤(贴片)
时间
备注
操作步骤(漂片)
时间
备注
石蜡切片免疫组化及免疫荧光染色方法

石蜡切片免疫组化及免疫荧光染色方法
一、石蜡切片免疫组化技术
石蜡切片免疫组化方法是一种流行的染色技术,它利用抗原特异性抗
体结合抗原将一种特定蛋白质标记出来,然后对组织交叉剥离切片进行染色,得到对特定抗原的特异性染色,进而可以测定组织中其中一蛋白质的
分布情况及其表达水平。
石蜡切片免疫组化方法主要分为热稳定抗原抗体
保护法、热稳定化学法和抗原保护法三种。
1.热稳定抗原抗体保护法
热稳定抗原抗体保护法又称抗原连接法,它是最常用的一种免疫组化
技术,依赖高温对抗原的特殊保护作用。
其原理是经过化学固定的组织切片,在石蜡上产生隆起;然后用高温阳性抗体(双抗体)将抗原完全覆盖,并产生痕迹,这样便可清楚地观察抗原的分布情况;此外,在有抗原保护
的条件下,抗原保护的组织切片可以用客体抗体染色。
2.热稳定化学法
热稳定化学法是一种特殊的抗原保护法,也是最常用的石蜡免疫染色
技术。
组织多色免疫荧光方法

组织多色免疫荧光方法
组织多色免疫荧光方法是一种利用免疫荧光技术,在同一张切片上同时或依次对多个蛋白分子进行染色,展示组织原位多个蛋白标志物的空间分布的技术。
具体步骤如下:
1. 切片脱蜡:将石蜡切片依次放入二甲苯Ⅰ(20min)-二甲苯Ⅱ(20min)-二甲苯Ⅲ(20min)-无水乙醇Ⅰ(5min)-无水乙醇Ⅱ(5min)-95%酒
精(5min)-90%酒精(5min)-80%酒精(5min)-70%酒精(5min),然后蒸馏水浸洗5min。
2. 抗原修复:采用电陶炉加热对切片进行抗原修复,将配置好的修复液(Tris-EDTA缓冲液,)放置于烧杯中高火煮沸,再将脱蜡水化后的组织切片置于烧杯中的耐高温塑料切片架上,液面要浸过切片组织一定高度,此时开始计时,修复时间为15min,此过程中勿使组织干片(修复液要足量)。
到时间后将烧杯从电陶炉面板移出,室温放置40min左右冷却降温,当修
复液降至室温后取出玻片,用PBS()冲洗3遍,每次3min(冲洗过程中切勿对着组织冲洗,以免弄破组织)。
3. 多标方案建立:根据实验设计,建立多标方案。
4. 制片:按照多标方案进行制片。
5. 多靶标蛋白染色:在同一张切片上同时或依次对多个蛋白分子进行染色。
6. 拍照与扫描:对染色后的切片进行拍照和扫描。
7. HALO病理图像定量分析:利用HALO病理图像分析平台对光谱图像进行定量研究和空间位置关系分析。
以上步骤仅供参考,建议咨询专业人士获取准确信息。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤1、脱蜡至水:将组织切片室温放置10min后,依次将石蜡切片放入二甲苯3min→无水乙醇5min—85%酒精5min—75%酒精5min—ddH2O洗5min。
2、抗原修复:组织切片置于盛满柠檬酸抗原修复液(50X稀释至1X使用)的修复盒中于微波炉内进行抗原修复(中火8min—停火8min—中低火7min)。
此过程中应防止缓冲液过度蒸发,切勿干片。
自然冷却后将玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min(具体修复液和修复条件根据组织来确定)。
3、画阻水圈:切片稍甩干后用组化笔在组织周围画圈,防止液体流失。
4、BSA封闭:在圈内滴加3%-5%浓度BSA孵育30min(或二抗同源血清封闭)。
5、一抗孵育:轻轻甩干封闭液,在切片上滴加按一定比例配好的一抗(溶于血清:PBS=1:19的抗体稀释液体系中),切片平放于湿盒(内加少量水防止抗体蒸发),4°C过夜。
6、二抗孵育:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加相应的荧光二抗,覆盖组织,避光RT孵育50min。
7、DAPI染核:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加DAPI染液,避光RT孵育3-5min。
8、树脂封片:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后用树脂封片剂封片(其间可滴加少量抗荧光淬灭剂)。
9、镜检拍照:切片于荧光显微镜/confocal/活细胞工作站中观察并采集图像(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555 nm,发绿光;CY3激发波长510-560,发射波长590nm,发橙光;CY5发红光)。
10、结果判读:DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光或者绿光,图片处理需使用Image J 软件。
石蜡组织免疫双色荧光操作步骤

石蜡组织免疫双色荧光操作步骤以下是石蜡组织免疫双色荧光的一般操作步骤:1. 组织固定:将待检测的组织标本固定在石蜡切片上,常见的固定剂包括福尔马林和乙醛。
2. 切片制备:使用组织切片机将固定的组织切割成薄片,通常厚度为4-6微米。
切片后将其放置在载玻片上。
3. 反蜡处理:将玻片连同组织切片一起放入石蜡热解蜡剂中,以去除石蜡并使组织暴露。
4. 抗原修复:根据需要,对组织切片进行抗原修复,以增强抗原的可见性。
抗原修复方法包括热处理或酶解。
5. 阻断非特异性结合:使用非特异性结合的抗体或血清对组织切片进行处理,以阻断非特异性结合位点,减少背景信号。
6. 第一次抗体孵育:将特异性的第一次抗体加入到切片上,与目标抗原结合,形成抗原-抗体复合物。
7. 洗涤:用洗涤缓冲液洗涤切片,以去除未结合的第一次抗体。
8. 第一次荧光标记:加入与第一次抗体结合的荧光标记物,以使目标抗原可视化。
9. 第二次抗体孵育:加入与第一次抗体特异性结合的第二次抗体,形成第一次抗体-第二次抗体复合物。
10. 洗涤:用洗涤缓冲液洗涤切片,以去除未结合的第二次抗体。
11. 第二次荧光标记:加入与第二次抗体结合的另一种荧光标记物,使第二次抗体可视化。
12. 核染色:如果需要,可以对细胞核进行染色,常见的核染色剂包括DAPI或荧光素。
13. 盖玻片:将一滴适当的封片剂加在载玻片上,然后用盖玻片覆盖标本。
14. 显微镜观察:使用荧光显微镜观察标本,并拍摄图像。
以上步骤是一般的操作流程,具体的步骤和试剂使用可能会根据实验的具体要求和试剂的特性而有所不同。
在进行实验之前,请确保严格按照实验室的安全操作规程和相关实验方案进行操作。
免疫荧光染色步骤

免疫组织化学染色步骤1.将石蜡切片二甲苯脱蜡(二甲苯Ⅰ20→二甲苯Ⅱ10)、入水(100%酒精Ⅰ5→100%酒精Ⅱ3→95%酒精2→80%酒精1→70%酒精1),蒸馏水冲洗后,0.01M 冲洗,5×3次;2.枸橼酸盐缓冲液微波抗原修复,加热使水温达92-96℃,维持10-15,自然冷却至室温,0.01M 冲洗,5×3次;3.32O 2溶液,37℃,20 ,以消除内源性过氧化物酶的活性,0.01M 冲洗,5×3次;4.正常羊血清封闭,37℃,30 ;5.倾去多余血清,滴加一抗,37℃2小时或者4℃过夜,0.01M 冲洗,5×3次;6.滴加二抗工作液,37℃,30 ,0.01M 冲洗,5×3次;7.滴加三抗工作液,37℃,30 ,0.01M 冲洗,5×3次;8.避光显色,显微镜下控制显色时间;9.0.01M 终止显色;10.梯度酒精脱水(70%酒精1→80%酒精1→95%酒精Ⅰ1→ 95%酒精Ⅱ1→无水酒精Ⅰ10→无水酒精Ⅱ10),二甲苯透明(二甲苯Ⅰ15→二甲苯Ⅱ10;11.中性树胶封片。
免疫荧光染色步骤(1)将组织切片脱蜡入水;(2)抗原微波修复,温度92℃-96℃,10-15,自然冷却至室温;(3)正常羊血清封闭,37℃,60 ;(4)倾去多余血清,滴加一抗,37℃2小时或者4℃过夜,冲洗,5×3次;(5)滴加荧光素标记的二抗,避光,37℃,60 ,0.01M 冲洗,5×3次;(6)防淬灭封片剂封片,4℃,避光保存。
(7)荧光显微镜观察拍照。
细胞免疫组化染色(培养板中染色)1.培养的细胞,弃去培养基,冷的洗两次,首先用4%多聚甲醛(4孔板200μl)固定10,洗2次,每次5-10分钟。
2.在含0.1% 100(4孔板200μl)的中进行10的透膜处理,洗2次,每次5-10分钟。
手动轻轻晃动数次,吸尽液体。
3.羊血清用配制成4%羊血清封闭液,室温封闭(4孔板200μl)30分钟。
石蜡切片免疫组化染色步骤 -回复

石蜡切片免疫组化染色步骤-回复石蜡切片免疫组化染色是一种常用的实验技术,用于检测组织中特定蛋白质的表达和定位。
通过特定抗体的结合,可以在组织切片上形成可见的染色反应,从而了解细胞分布、形态和功能。
本文将一步一步介绍石蜡切片免疫组化染色的详细步骤。
第一步:取材固定首先,需要取得要进行免疫组化染色的组织样本。
可以是新鲜组织,也可以是经过福尔马林或其他适当的固定剂固定后的组织。
固定的目的是固定细胞内蛋白质的结构,以保持其形态和抗原性。
固定过程中要避免产生过度固定,否则可能会破坏细胞结构和抗原的特异性。
第二步:组织脱水和浸渍将固定好的组织样本进行脱水和浸渍。
脱水的目的是去除组织中的水分,使其能够与石蜡充分相溶。
浸渍的目的是使组织均匀地吸收石蜡,以便切片时组织能够坚固并保持形态。
一般的脱水和浸渍步骤包括用不同浓度的酒精进行脱水,然后使用清洁剂和石蜡浸渍组织。
第三步:包埋和切片经过浸渍的组织样本需要进行包埋,以保持其形态和结构。
将组织样本放置在浸渍好的石蜡中,使其充分浸透,然后将其放置在冰上使石蜡固化。
固化后的组织样本可以用切片机切成非常薄的切片,通常是4-6μm。
切片质量对于后续的免疫组化染色非常重要,所以要确保切片的平整和完整。
第四步:切片除蜡和重现组织抗原切片除蜡是为了去除包埋后留在组织切片上的石蜡,以便进行后续的染色。
一般使用酮或甲醇进行除蜡,然后通过多次水洗将组织切片充分清洗。
重现组织抗原则是为了使切片上的抗原能够被抗体检测到。
根据抗原的性质和检测的目的,可以选择适当的方法进行重现组织抗原,如酶解、蛋白酶解或热诱导抗原修复等。
第五步:抗体孵育将免疫组化染色所需的一抗加在切片上,与切片中的特定抗原发生特异性结合。
孵育时间和温度根据抗体的性质和抗原的稳定性来确定,一般在室温下孵育数小时或过夜。
抗体孵育结束后,使用缓冲液或PBS洗涤切片,以去除未结合的抗体。
第六步:二抗孵育和信号检测在一抗的基础上,可以使用与一抗来源不同物种的二抗来进行信号放大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
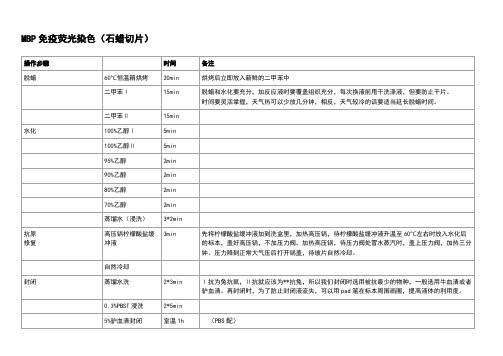
对于石蜡切片:
1、烤片:60℃ 60分钟
2、脱蜡:二甲苯中Ⅰ脱蜡15分钟→二甲苯Ⅱ脱蜡15分钟→无水乙醇Ⅰ5分钟→无水乙醇Ⅱ5分钟→90%乙醇Ⅰ5分钟→90%乙醇Ⅱ5分钟→70%乙醇5分钟
→蒸馏水5分钟→蒸馏水5分钟。
3、抗原修复:高压修复,事先烧开锅中的水,修复盒中加入0.01mol/l柠檬酸钠,pH6.0(柠檬酸三钠 3g,柠檬酸 0.4g加入1000ml蒸馏水中),上汽后加热10分钟,关火。
修复盒取出,放入装有自来水的瓷缸中缓慢冷却至室温。
2. 去除内源性酶:玻片取出放入湿盒,加3%H
2O2
2
(2ml H
2
O2
2
加入18ml蒸馏水
中,现配现用,避光),室温孵育10分钟,PBS洗3次,每次5分钟。
(也可不用去除内源性酶)。
3. 封闭(Blocking)
加10%正常驴血清(原液100ul+900ulPBS,1ml够用30张片子),室温孵育封闭30分钟。
如果背景较高,可以4℃封闭过夜。
不用洗,用滤纸吸干周边水分。
从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。
4. 一抗孵育(Primary antibody incubation)
参考一抗的说明书,按照适当比例用免疫染色一抗稀释液(10%山羊血清PBS或1%BSA-PBS)稀释一抗。
立即加入稀释好的一抗, 4℃过夜,第二天取出复温45分钟。
PBS洗3次,每次5分钟。
5. 二抗孵育(Secondary antibody inucubation)
按照适当比例用免疫荧光染色二抗稀释液稀释荧光标记的二抗,立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
PBS洗涤3次。
每次5分钟。
如果结果背景较高,可以适当延长洗涤时间并增加洗涤次数。
6. 蛋白检测(Detection of proteins)
对于免疫荧光染色,此时已经可以直接到荧光显微镜下观察。
7. 复染
用DAPI对细胞核进行染色,室温10分钟,PBS冲洗5分钟×3次,封片(封片剂或分析纯的甘油与0.5molpH9.5碳酸缓冲液1:1混合)显微镜观察,染色后为蓝色荧光。
多重荧光染色:可使用红色荧光、绿色荧光和蓝色荧光进行三重荧光染色。
例如用免疫荧光染色试剂盒-抗小鼠Cy3(P0193)进行红色荧光染色,随后可以用免疫荧光染色试剂盒-抗兔FITC(P0186)进行绿色荧光染色,在完成上述两种染色后可以使用Hoechst染色试剂盒(C0003)对细胞核进行染色,染色后为蓝色荧光。
0.5molpH9.5碳酸缓冲液配方:
NaHCO3 3.7g
Na2CO3 0.6g
双蒸水溶解至100ml,调节pH至9.5。
