化学元素周期表性质
化学元素周期表元素基本性质
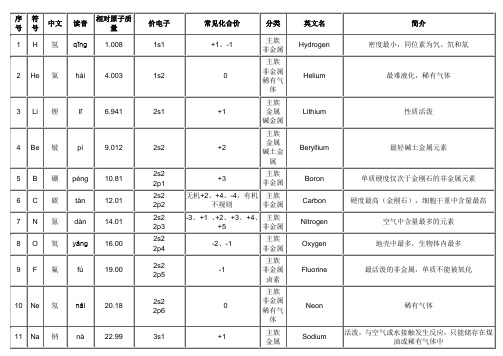
人造放射
98
Cf
锎
kāi
251
5f10 7s2
+3、+5
副/金/锕
Californium
人造放射,最贵金属
99
Es
锿
āi
252
5f11 7s2
+3
副/金/锕
Einsteinium
人造放射
100
Fm
镄
fèi
257
5s12 7s2
+3
副/金/锕
Fermium
人造放射
101
Md
钔
mén
258
48
Cd
镉
gé
112.4
4d10
5s2
+2
副族
金属
Cadmium
重金属,过量摄入会导致痛痛病
49
In
铟
yīn
114.8
5s2
5p1
+3
主族
金属
Indium
可塑性强,有延展性,115In是主要核素,有放射性
50
Sn
锡
xī
118.7
5s2
5p2
+2、+4
主族
金属
Tin
人类最早发现应用的元素之一,被用于制造容器
能在氮气中燃烧,熔点高
23
V
钒
fán
50.94
3d3
4s2
+3、+5
副族
金属
Vanadium
高熔点稀有金属
24
Cr
铬
gè
52.00
3d5
4s1
化学元素周期表的物理性质

化学元素周期表的物理性质化学元素周期表是描述和分类化学元素的一种工具,通过整齐排列的方式展示了元素的各种特性和性质。
除了化学性质外,元素的物理性质也是元素周期表中的重要组成部分。
本文将探讨化学元素周期表中的一些重要物理性质。
1. 原子序数原子序数是元素周期表中的一个重要概念,它代表了元素中原子的核中的质子数量,同时也代表了元素在周期表中的排序。
原子序数越小,其物理性质一般越轻。
例如,周期表中较早的元素,如氢(H)和锂(Li),具有较低的原子序数,其物理性质相对较轻。
2. 原子质量原子质量是指元素一个原子的质量,通常用相对原子质量来表示。
元素周期表中,原子质量逐渐增大,表示元素的原子越来越重。
原子质量的增加与元素的原子核中的中子数量有关,而质子数量则由原子序数决定。
原子质量的差异导致了元素在物理性质上的差异。
例如,原子质量较大的金属元素如铁(Fe)和铜(Cu)具有较高的密度和较高的熔点。
3. 物态元素周期表中的元素可以通过物态分类,分为固体、液体和气体。
该分类是根据相对温度和压力的条件下,元素在自然环境中的存在形式。
例如,氢(H)和氧(O)是在室温下是气体,铁(Fe)是固体,汞(Hg)是液体。
元素的物态是其物理性质的一个重要方面,它直接影响了元素在实际应用中的使用。
4. 密度元素的密度是指单位体积内的质量。
密度是元素的物理性质之一,它可以帮助我们了解元素的紧凑程度。
元素周期表中,随着原子序数的增加,元素的密度也有所变化。
例如,金属铁的密度较大,而非金属的氧气的密度则较小。
通过研究和比较元素的密度,我们可以深入了解元素之间的物理差异。
5. 熔点和沸点熔点是指物质从固态转变为液态的温度,沸点是指物质从液态转变为气态的温度。
元素的熔点和沸点是其物理性质中的重要属性,也是对元素进行分类和比较的依据。
元素周期表中,熔点和沸点随着原子序数的增加而变化。
例如,氢(H)和氧(O)在较低温度下就能熔化或气化,而金属元素如铁(Fe)则需要较高的温度才能熔化。
化学元素的周期表和性质

化学元素的周期表和性质一、周期表的构成1.周期表是化学元素按照原子序数递增排列的表格,目前包含118种元素。
2.周期表分为七个周期,横排,周期数等于元素原子的最外层电子层数。
3.周期表有十六个族,竖排,族数代表元素原子的最外层电子数。
二、周期表的规律1.周期规律:电子层数相同的元素,从左至右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
2.族规律:同一族元素,原子半径随着周期数增加而增大,金属性随着周期数增加而增强,非金属性随着周期数增加而减弱。
三、元素的性质1.原子半径:原子核外电子层数越多,原子半径越大;同一周期中,从左至右原子半径逐渐减小。
2.金属性:元素的金属性随着原子序数的增大而减弱;同一族中,金属性随着周期数的增加而增强。
3.非金属性:元素的非金属性随着原子序数的增大而增强;同一族中,非金属性随着周期数的增加而减弱。
4.最高正化合价:主族元素的最高正化合价等于其最外层电子数(O、F元素除外)。
5.最低负化合价:主族元素的最低负化合价等于其最外层电子数减8(O、F元素除外)。
6.周期表在化学反应中的应用:根据元素的位置,判断其在化学反应中的角色,如氧化剂、还原剂等。
7.周期表在材料科学中的应用:根据元素的性质,选择合适的元素制备具有特定性能的材料。
8.周期表在生物体内的应用:了解元素在生物体内的分布和作用,研究生物体生理功能与元素的关系。
五、学习周期表的建议1.熟悉周期表的基本构成,了解各个周期、族的元素分布。
2.掌握周期表的规律,能根据元素的位置判断其性质。
3.了解元素的主要性质和应用,提高对化学知识的运用能力。
4.平时多观察、多思考,将周期表与实际应用相结合,提高学习效果。
习题及方法:1.习题:元素X位于第四周期第Ⅷ族,原子序数为26,请写出元素X的名称。
方法:根据题目信息,我们可以知道元素X位于第四周期第Ⅷ族,原子序数为26。
查看周期表,第四周期第Ⅷ族的元素是铁(Fe)。
所以元素X的名称是铁。
化学归纳初中化学中的元素周期表及元素性质总结

化学归纳初中化学中的元素周期表及元素性质总结元素周期表是化学中一个非常重要的工具,它对于学习和理解元素性质、元素间的关系以及化学反应机理都有着重要的意义。
本文将就初中化学中的元素周期表和元素性质进行总结和归纳。
第一部分:元素周期表的基本结构和排列元素周期表是按照元素的原子序数(即元素的原子核中所含的质子数)升序排列的,原子序数的增加也代表了元素中原子核的质子数量的增加。
元素周期表可分为7个水平的横排,称之为周期。
同时,由于元素周期表的元素具有一定的相似性质,因此也可分为18个垂直的竖排,称之为族。
第二部分:元素周期表中的元素分类元素周期表中的元素可分为金属、非金属和类金属三大类。
金属元素通常具有一些共同的性质,如良好的导电性、导热性以及延展性等。
常见的金属元素有铁、铜、锌等。
非金属元素则具有相对较低的导电性和导热性,常见的非金属元素有氮、氧、硫等。
类金属有时也被称为半金属元素,其性质介于金属和非金属之间,常见的类金属元素有硅、锑等。
第三部分:主要元素的特性和应用1. 金属元素:- 铁是一种常见的金属元素,具有较高的熔点和延展性。
它广泛应用于建筑、机械制造和电子工业等领域。
- 铜是一种导电性能较好的金属元素,被广泛用于电线、电缆和设备制造。
- 锌是一种常见的防腐金属,广泛用于镀锌铁皮、锌碱电池等。
2. 非金属元素:- 氧是一种非金属元素,广泛存在于自然界中,并与其他元素形成氧化物。
它是维持生命活动所必需的。
- 硫是一种具有刺激性气味的非金属元素,可用于制取硫酸等化学品。
3. 类金属元素:- 硅是一种类金属元素,具有较高的导电性和导热性。
它广泛应用于半导体工业和电子工业中。
- 锑是一种类金属元素,常用于合金制备和阻燃剂。
第四部分:元素周期表中的周期性规律元素周期表中的元素按照周期和族的排列,使得元素的性质具有一定的规律性。
其中,原子半径、电子亲和能、电离能和电负性是元素周期表中的重要性质。
随着周期数增加,原子半径减小,电子亲和能和电离能增加,电负性也呈现出一定的规律。
化学元素周期表与元素性质

化学元素周期表与元素性质化学元素周期表是描述不同化学元素结构和性质的一种工具。
它按照元素的原子序数排列,并将具有相似性质的元素放在同一列中。
在这篇文章中,我们将探讨化学元素周期表的组成及其与元素性质之间的关系。
一、周期表的组成化学元素周期表由一系列水平行(周期)和垂直列(族)组成。
水平行表示元素的周期数,垂直列则代表元素所属的化学族。
周期表中的每个方格都包含一个元素,该方格中通常包括元素的原子序数、元素符号和相对原子质量。
二、元素周期表的分类元素周期表的主要分类方法有以下几种:1. 主族元素:位于周期表最左侧和最右侧的元素属于主族元素。
它们的化学性质相似,最外层电子数相同。
2. 过渡元素:位于主族元素之间的元素属于过渡元素。
过渡元素的化学性质较为复杂,它们具有多种氧化态和电子构型。
3. 稀土元素:稀土元素是周期表中第57至71族的元素,它们具有相似的化学性质,且在自然界中非常稀少。
4. 放射性元素:放射性元素具有不稳定的原子核,会自发地放出粒子或电磁辐射。
它们的放射性对于核能和医学应用至关重要。
三、元素周期表与元素性质的关系元素周期表的布局使得相似性质的元素处于同一垂直列中。
这种排列方式帮助我们预测元素的一些性质和趋势。
1. 元素的原子半径原子半径指的是元素中心原子核与最外层电子之间的距离。
从左到右,周期表中的原子半径逐渐减小,这是因为核电荷增加,吸引最外层电子使其更加紧凑。
从上到下,周期表中原子半径逐渐增加,这是因为元素周期表下方的能级填充。
2. 元素的电离能和电子亲和能电离能是指从一个原子中移除一个电子所需的能量,电子亲和能是指一个原子吸收一个电子所释放的能量。
周期表中,从左到右,原子的电离能逐渐增加,因为更靠近核的电子更难移除。
从上到下,原子的电离能和电子亲和能逐渐减小,因为电子与核的距离增加,核吸引电子的能力减弱。
3. 元素的化合反应周期表中具有相似化学性质的元素往往会表现出相似的化合反应。
化学元素周期表与元素性质

化学元素周期表与元素性质化学元素周期表是一种按照元素的原子序数和化学性质进行排列的表格。
它是化学研究中的重要工具,能够帮助我们了解元素之间的关系和规律。
本文将探讨元素周期表的结构、元素性质以及它们之间的关联。
一、元素周期表的结构元素周期表通常由一系列的水平行和垂直列组成。
水平行被称为周期,垂直列被称为族。
水平行表示元素的原子序数递增,因此,越往下,原子序数越大。
而族则表示元素的化学性质相似,这是由于它们具有相同的电子结构。
元素周期表中的每个单元格包含了一个元素的符号、原子序数和相对原子质量。
符号是元素的简写,原子序数代表元素中的质子数,而相对原子质量则是该元素的原子质量相对于碳-12的比值。
二、元素性质的周期性元素周期表的结构揭示了元素性质的周期性。
元素在周期表上的位置决定了它们的一些重要性质,如原子半径、电离能、电负性和化合价等。
1. 原子半径原子半径是指原子的大小。
根据元素周期表的结构,我们可以发现,在同一周期内,原子半径逐渐减小;而在同一族内,原子半径逐渐增大。
这是由于,随着电子层的增加,电子云的半径也会增加,从而导致原子半径的增加。
2. 电离能电离能是指从一个原子中去除一个电子所需要的能量。
从周期表中我们可以发现,电离能随着原子序数的增加而增加。
这是因为,随着电子层数的增加,电子与原子核之间的吸引力减弱,从而提高了去除电子的能量。
3. 电负性电负性是一个描述原子吸引电子能力的指标。
在元素周期表中,我们可以发现,电负性随着从左到右的周期性增加,而在同一族内基本保持不变。
这是由于,原子核电荷的增加和电子层数的不变导致了电负性的增加。
4. 化合价化合价是指一个元素在化合物中与其他原子结合的价态。
根据元素周期表,我们可以发现,化合价随着周期的增加而变化。
一般情况下,元素的化合价等于其价电子数。
例如,第一周期的元素通常具有+1的化合价,因为它们只有一个价电子;而第二周期的元素通常具有+2的化合价,因为它们有两个价电子。
化学元素周期表的元素性质

化学元素周期表的元素性质化学元素周期表是化学界广泛应用的一种分组化工具,它将各种元素按照一定的规律排列起来,向我们展示了元素的周期性和趋势性。
每个元素都有特定的原子性质和化学性质,在周期表中,这些性质根据元素的位置和排列有着明显的规律和变化。
本文将详细介绍一些常见元素的性质,包括物理性质、化学性质以及元素的周期趋势。
第一部分:元素周期表的基本结构与命名规则化学元素周期表是由英国化学家门德莱夫于1869年首次提出的。
它由一系列水平排列的横行和垂直排列的竖列组成,横行称为周期,竖列称为族。
横行的周期数越高,原子序数越大。
周期表的左侧是碱金属元素,右侧是气体元素,中间是过渡金属元素。
元素的命名规则遵循国际纯粹与应用化学联合会 (IUPAC) 的规定,通常采用拉丁文命名,并用缩写代表,如氢元素是H,氧元素是O。
第二部分:元素的物理性质元素的物理性质是指元素在无变化化学环境下所具有的性质。
其中包括原子量、电子排布、状态、熔点、沸点、导电性等。
例如,氧元素的原子量是16,电子排布为2,6,氧气在常温下是气体状态,熔点为-218.8°C,沸点为-183°C,而氧元素是一种良好的氧化剂。
第三部分:元素的化学性质元素的化学性质是指元素与其他元素或化合物发生化学反应时所表现出来的性质。
化学性质包括元素的化合价、化学活性、氧化还原性等。
举个例子,钠是一种具有强烈金属性质的化学元素,它具有+1的单一化合价,与氧元素反应时会产生氧化钠。
第四部分:元素的周期趋势在元素周期表中,第一周期只有两个元素,氢和氦。
随着周期数的增加,元素的原子量、原子半径、电子亲和能力、电离能等特性都会发生逐渐的变化。
比如,原子半径随着周期数增加而逐渐增大,而电离能随着周期数增加而逐渐增大。
这些周期性趋势对于理解元素的性质和预测元素的反应非常重要。
结语化学元素周期表是化学研究中不可或缺的基础工具,通过它我们可以了解各种元素的性质和趋势。
化学之元素周期表的性质
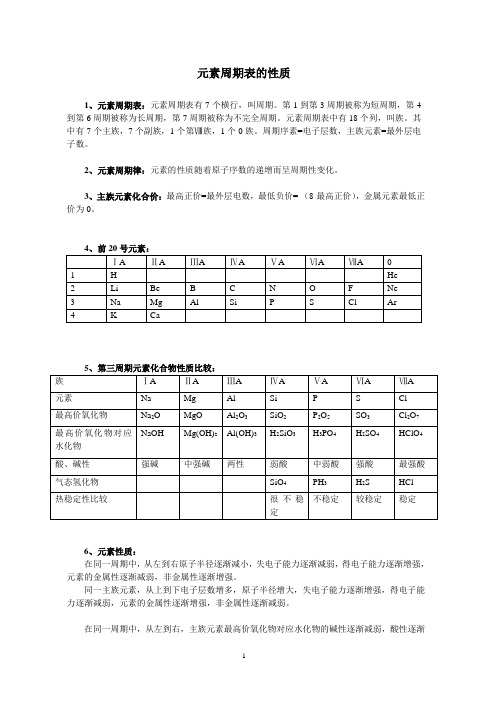
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学元素周期表性质
1元素周期表中元素及其化合物的递变性规律
1.1原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
1.2元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同
1.3单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
1.4元素的金属性与非金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
(2)同一主族元素从上到下金属性递增,非金属性递减。
1.5最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
1.6非金属气态氢化物
元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
1.7单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
2.推断元素位置的规律
判断元素在周期表中位置应牢记的规律:
(1)元素周期数等于核外电子层数;
(2)主族元素的序数等于最外层电子数;
(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
