初中化学元素周期表课件
合集下载
化学必修元素周期表ppt课件

ppt课件.
41
总结:
碱金属的原子结构
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性: 电子层数
原子半径
核对最 外层电 子的引 力
失电 子能 力
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
ppt课件.
40
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
相似性 和递变性 。
在元素周期表中,同主族元素从上到下原 子核外电子层数依次 增多 ,原子半径逐 渐 增大 ,失电子能力逐渐 增强 ,金 属性逐渐 增强 。
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性
质彼此相似 ,它们都能与 水 等非金属单质以及氧气 反应,表现出金属性(还原性).
4Li+O2=2Li2O
2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 +1 。
49
卤族元素: 氟(F)
F +9 2 7
氯(Cl)
Cl + 1 7 2 8 7
溴(Br)
Br +35 2 8 18 7
碘(I)
I +53 2 8 1818 7
化学:《元素周期表-周期表结构》课件(新人教版必修2)

氕 (氢)
(重氢) 氘
(超重氢) 氚
H、D、T这三种核素互称为同位素
常见的同位素:
碳 碳-12
12C
6
碳-13
13C
6
碳-14
14C
6
氧 氯 铀
16O
8
17O
8
18O
8
35Cl
17 92
37Cl
17
234U
235U
92
238U
92
【同位素小结】
两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
(2)碱金属元素从上到下(Li 、Na、K、 Rb、Cs),随着核电荷数的增加,碱金属 元素原子的电子层数逐渐 增多 ,原子核 对 最外层电子 的引力逐渐减弱,原子失 电子的能力逐渐 增强 。 元素的金属性逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
第88号元素: 88-86 =2
第五周期第ⅦA 族。
第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
6、下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D )
A.0 11 18 19
C.
6 11 12 13 24
D.
6 14 31 32
7
7. A、B、C是周期表中相邻的三种元素,其中A、B是同 周期,B、C是同主族。此三种元素原子最外层电子数之
卤素原子结构的相似性,决定了单质化学性质的相似性。
与氢反应的能力渐弱 氢化物的稳定性渐弱 与水反应的能力渐弱
元素非金属性强弱判断依据:
1、单质跟氢气反应生成气态氢化物的 难易;
九年级化学上册第3章第2课时元素周期表自然界中元素的存在元素与人体降背记手册习题课件沪教版ppt

第3章 物质构成的奥秘
第2节 组成物质的化学元素 第2课康
一、元素周期表
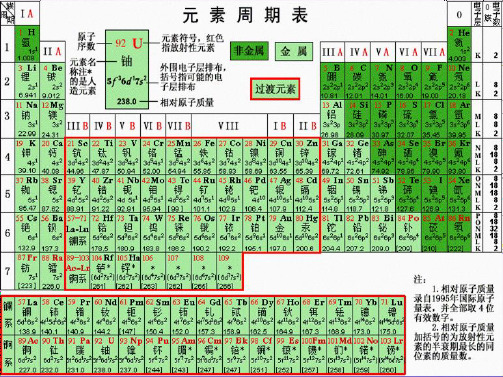
1.元素周期表的由来 根据元素的原子结构和性质,将已知的一百余种元素 按原子序数(数值上等于核电荷数)科学有序地排列起来, 得到了元素周期表。
拓展最早的元素周期表由俄国著名化学家门捷列夫提出, 当时按原子量大小排列;现在所用元素周期表,其中的 原子序数跟核电荷数相同,是更加科学和完善的周期表。 2.元素周期表的结构 (1)横行:周期,每一横行代表一个周期,共有7个周期。 (2)纵行:族,元素周期表中共有18个纵行,每一个纵行叫做一 个族,8、9、10三个纵行共同组成一个族,所以共有16个族。
3.人体中元素的分布 人体中水约占70%,组成人体的元素,含量由多到少依次 是氧、碳、氢、氮等。
4.空气中元素分布 空气中含量最多的是氮元素。
5.太阳中含量最多的是氢元素,其次是氦元素。
三、元素与人体健康 1.人体中化学元素含量的多少直接影响人体的健康。健康的生命所
必需的元素称为生命必需元素。 常量元素: 氧(O)、碳(C)、氢(H)、氮(N)、钙(Ca)、磷(P)、硫(S)、钾(K)等。 微量元素: 铁(Fe)、铜(Cu)、锰(Mn)、锌(Zn)、钴(Co)、碘(I)、硒(Se)等。 口诀:常见的微量元素:锰、铜、铁、锌、钴、碘、硒(门童铁 心古典戏)。
(3)格:每一种元素占据一个格,即元素在周期表中的位置,每 一格的信息包括:元素的原子序数、元素符号、元素名称、 相对原子质量。示例: 由图可知:钙元素的原子序数是20 ,元素符号是Ca,相对 原子质量是40.08。 【规律总结】 原子序数=核电荷数=核外电子数=质子数
3.元素周期表的规律 (1)同一周期从左到右原子序数递增,电子层数相同。 (2)同一族从上到下电子层数递增,最外层电子数相同(氦
第2节 组成物质的化学元素 第2课康
一、元素周期表
1.元素周期表的由来 根据元素的原子结构和性质,将已知的一百余种元素 按原子序数(数值上等于核电荷数)科学有序地排列起来, 得到了元素周期表。
拓展最早的元素周期表由俄国著名化学家门捷列夫提出, 当时按原子量大小排列;现在所用元素周期表,其中的 原子序数跟核电荷数相同,是更加科学和完善的周期表。 2.元素周期表的结构 (1)横行:周期,每一横行代表一个周期,共有7个周期。 (2)纵行:族,元素周期表中共有18个纵行,每一个纵行叫做一 个族,8、9、10三个纵行共同组成一个族,所以共有16个族。
3.人体中元素的分布 人体中水约占70%,组成人体的元素,含量由多到少依次 是氧、碳、氢、氮等。
4.空气中元素分布 空气中含量最多的是氮元素。
5.太阳中含量最多的是氢元素,其次是氦元素。
三、元素与人体健康 1.人体中化学元素含量的多少直接影响人体的健康。健康的生命所
必需的元素称为生命必需元素。 常量元素: 氧(O)、碳(C)、氢(H)、氮(N)、钙(Ca)、磷(P)、硫(S)、钾(K)等。 微量元素: 铁(Fe)、铜(Cu)、锰(Mn)、锌(Zn)、钴(Co)、碘(I)、硒(Se)等。 口诀:常见的微量元素:锰、铜、铁、锌、钴、碘、硒(门童铁 心古典戏)。
(3)格:每一种元素占据一个格,即元素在周期表中的位置,每 一格的信息包括:元素的原子序数、元素符号、元素名称、 相对原子质量。示例: 由图可知:钙元素的原子序数是20 ,元素符号是Ca,相对 原子质量是40.08。 【规律总结】 原子序数=核电荷数=核外电子数=质子数
3.元素周期表的规律 (1)同一周期从左到右原子序数递增,电子层数相同。 (2)同一族从上到下电子层数递增,最外层电子数相同(氦
初中化学元素周期表 PPT课件 图文

返回
锂
元素名称锂 元素符号Li 原子序数3 相对原子质量(12C = 12.0000)6.941 英文名称Lithium 物理性质:状态:软的银白色金属,是最轻的金属。
返回
铍
元素名称铍
返回
元素符号Be
原子序数4
相对原子质量(12C = 12.0000)9.012182
返回
氯
元素名称氯 元素符号Cl 原子序数17 相对原子质量(12C = 12.0000) 35.4527 英文名称Chlorine 物理性质:状态:黄绿色卤气。
返回
氩
元素名称氩 元素符号Ar 原子序数18 相对原子质量(12C = 12.0000)39.948 英文名称Argon 物理性质:状态:无色、无臭、无味的惰性气体。
返回
铝
元素名称铝 元素符号Al 原子序数13 相对原子质量(12C = 12.0000)26.981539 英文名称Aluminum 物理性质:状态:银色,轻质,非磁性的可锻金属。
返回
硅
元素名称硅 元素符号Si 原子序数14 相对原子质量(12C = 12.0000)28.0855 英文名称Silicon 物理性质:状态:硬的深灰色非金属。
返回
氮
元素名称氮 元素符号N 原子序数7 相对原子质量(12C =12.0000) 14.00674 英文名称Nitrogen 物理性质:状态:无色、无味、无臭的气体。
返回
氧
元素名称氧 元素符号O 原子序数8 相对原子质量(12C = 12.0000)15.9994 英文名称Oxygen 物理性质:状态:无色、无臭、无味的气体。
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
鲁教版化学八年级全一册《元素周期表》课件

2.氧气是人类赖以生存的重要物质,右图是元素周
期表中的一格,你从中获得信息有:
①该元素的名称为氧;
8O 氧
②该元素的符号为O; ③该元素的核电荷数等于8;
16.00
④该元素原子的相对原子质量等于16.00;
⑤该元素属于非金属元素;
⑥该元素形成的单质氧气常温下为气体。
+1 1
1H
+321 +422 +523
“梦见”元素周期表1869年一天的深夜,门捷列夫像往常一样,在自己的 书房里苦苦思索。长时间的劳累让门捷列夫有点支持不住了,他趴在桌上,不 知不觉进入了梦乡。但是,睡眠也无法阻止他继续思考,就在半梦半醒之间, 门捷列夫的脑海里突然显示出一张表格:表格中的每一行、每一列都那么有规 律;相对原子质量依次递增,按周期排列;有些元素在性质上有类似之处…这 不就是自己日思夜想的“元素表”吗?世界上第一张化学元素周期表,就这样 戏剧性地诞生了。在将所有的已知元素排列进元素周期表的过程中,门捷列夫 发现,必须在表中保留若干个空位,因为一旦把已知的元素放进空位中,就会 破坏元素之间的协调关系。于是,门捷列夫做出了一个大胆的预言:元素周期 表中的每一个空位都是一个未知元素。他还根据空位旁边已知元素的性质,推 论出了这些未知元素(他称之为“类硼”、“类铝”、“类硅”……)的性质。
根据原子结构示意图,周期数、主族 数的含义是什么?
周期数等于电子层数 主族数等于最外层电子数
(二)元素周期表规律
1.同一周期(左 右): (1)电子层数相同; (2)质子数(或核电荷数)依次增加; (3)最外层电子数依次增加。 2.同一主族(上 下): (1)最外层电子数相同; (2)电子层数依次增加。 3.周期数=电子层数
鲁教版化学八年级全一册《元素周期表》课件

中它容易__得__到__(填“得到”或“失去”)电子; (3)磷元素在元素周期表中位于第__第__三____周期。
6.锶元素的粒子结构示意图和在元素周期表中显示的信息如下图所 示:
图1
图2
图3
(1)锶属于__金__属____(填“金属”或“非金属”)元素。
(2)锶元素的原子序数为___3_8____,相对原子质量为__87.6__2____。 (3)图2所表示的粒子的化学符号是__ S_r_2_+___。
2.氧气是人类赖以生存的重要物质,右图是元素周
期表中的一格,你从中获得信息有:
①该元素的名称为氧;
8O 氧
②该元素的符号为O; ③该元素的核电荷数等于8;
16.00
④该元素原子的相对原子质量等于16.00;
⑤该元素属于非金属元素;
⑥该元素形成的单质氧气常温下为气体。
+1 1
1H
+321 +422 +523
子数。下列说法正确的是( D )。
A.该元素位于周期表第二周期 B.该粒子为阴离子 C.该粒子核电荷数为10 D.该粒子为Na+
9.下图为元素周期表的一部分。下列叙述错误的是( C)。
A.钙的核电荷数是20 B.镁在化学反应中较易失去电子 C.硫离子的结构示意图为 D.每个周期结尾元素的化学性质比较稳定
玩“纸牌”的化学教授
门捷列夫给学生们上无机化学时发现自己遇到了一个大问题:该如何排列 已发现的63种化学元素呢?门捷列夫决心寻找这种次序,去发现化学元素之间 的规律性。很快,门捷列夫的家人就注意到了一件怪事:一向珍惜时间的教授, 突然开始迷上玩“纸牌”了。每天,门捷列夫都会拿着这些卡片,摆开、收起, 再摆开、再收起,玩得不亦乐乎。
6.锶元素的粒子结构示意图和在元素周期表中显示的信息如下图所 示:
图1
图2
图3
(1)锶属于__金__属____(填“金属”或“非金属”)元素。
(2)锶元素的原子序数为___3_8____,相对原子质量为__87.6__2____。 (3)图2所表示的粒子的化学符号是__ S_r_2_+___。
2.氧气是人类赖以生存的重要物质,右图是元素周
期表中的一格,你从中获得信息有:
①该元素的名称为氧;
8O 氧
②该元素的符号为O; ③该元素的核电荷数等于8;
16.00
④该元素原子的相对原子质量等于16.00;
⑤该元素属于非金属元素;
⑥该元素形成的单质氧气常温下为气体。
+1 1
1H
+321 +422 +523
子数。下列说法正确的是( D )。
A.该元素位于周期表第二周期 B.该粒子为阴离子 C.该粒子核电荷数为10 D.该粒子为Na+
9.下图为元素周期表的一部分。下列叙述错误的是( C)。
A.钙的核电荷数是20 B.镁在化学反应中较易失去电子 C.硫离子的结构示意图为 D.每个周期结尾元素的化学性质比较稳定
玩“纸牌”的化学教授
门捷列夫给学生们上无机化学时发现自己遇到了一个大问题:该如何排列 已发现的63种化学元素呢?门捷列夫决心寻找这种次序,去发现化学元素之间 的规律性。很快,门捷列夫的家人就注意到了一件怪事:一向珍惜时间的教授, 突然开始迷上玩“纸牌”了。每天,门捷列夫都会拿着这些卡片,摆开、收起, 再摆开、再收起,玩得不亦乐乎。
人教版九上化学第三单元 课时2 元素符号元素周期表【课件】

铜CU 锌ZN 银AG 氯cl 钙cA
Cu
Zn
Ag
Cl
Ca
试一试,给元素分类
元素 名称 氢 氦 锂 碳 氮 氧
元素 符号
H He Li C N O
元素 名称 氟 氖 钠 镁 铝 硅
金属元素
分类标准:元素名称的偏旁
元素 符号
F Ne Na Mg Al Si
元素 名称 磷 硫 氯 氩 钾 钙
元素 符号
金属元素
非金属元素
稀有气体元素
4.原子序数=核电荷数=核内质子数=核外电子数
思考
如果你已经知道了元素的原子序数,你能在元素周期表中查找元素吗?
已知元素的原子 序数为13
根据原子序数,查找元素周期表可得: (1)元素名称:铝 (2)元素符号:Al (3)相对原子质量:26.98
针对训练
1. 元素在元素周期表中的相关信息如图所示。下列关于该元素说法错
氢H
氟F
磷P
锰 Mn
氦 He
氖 Ne
硫S
铁 Fe
锂 Li
钠 Na
氯 Cl
铜 Cu
碳C
镁 Mg
氩 Ar
锌 Zn
氮N
铝 Al
钾K
银 Ag
氧O
硅 Si
钙 Ca
汞 Hg
试一试,给元素分类
分类标准:电子排布方式(最外层电子数)
元素 元素 原子 元素 元素 原子 元素 元素 原子 元素 元素 名称 符号 结构 名称 符号 结构 名称 符号 结构 名称 符号
氧元素
汞
意义 O
Hg 汞元素
1个氧原子
1个汞原子
随堂检测
1. 新趋势 跨学科 下表是生物细胞中的部分元素及其组成,其中属 于金属元素的是( C )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学课件 元素周期表
问题1: 请画出氧原子结构示意图。指出氧元 素在周期表的位置,它所在位置与氧原子结构 有什么关系?
小结:
利用原子结构我们可以推测元素在周期表位置及元素的性 质,因此,经常从创设有关原子结构信息出发设置推断题
元素周期律
一规律——元素的性质随着原子序数 的递增而呈周期性变化的规律。
最低负价从__到___ 想一想:元素化合价与原子结构存在什么关系?
四变化 ——元素性质的周期性变化主 要体现在核外电子排布、原子半径、元 素的主要化合价、元素的金属性及非金 属性的周期性变化等方面。
实质:原子核外电子排布的周期性变化。
回忆与再现
同周期从左往右,半径从____到______ 同主族从上到下,半径从_____到_______ 想一想:如何比较S2-和S的半径大小呢?
微粒间半径比较规律:
1、电子层数越多,半径越大 2、电子层数相等,质子数越大,半径反 而越小 3、电子层数相同,质子数相同,核外电 子数越多,半径越大
回忆与再现
第二周期从左往右,最高正价从__到___ ---------------------------最低负价从__到___ 第源自周期从左往右,最高正价从__到___
问题1: 请画出氧原子结构示意图。指出氧元 素在周期表的位置,它所在位置与氧原子结构 有什么关系?
小结:
利用原子结构我们可以推测元素在周期表位置及元素的性 质,因此,经常从创设有关原子结构信息出发设置推断题
元素周期律
一规律——元素的性质随着原子序数 的递增而呈周期性变化的规律。
最低负价从__到___ 想一想:元素化合价与原子结构存在什么关系?
四变化 ——元素性质的周期性变化主 要体现在核外电子排布、原子半径、元 素的主要化合价、元素的金属性及非金 属性的周期性变化等方面。
实质:原子核外电子排布的周期性变化。
回忆与再现
同周期从左往右,半径从____到______ 同主族从上到下,半径从_____到_______ 想一想:如何比较S2-和S的半径大小呢?
微粒间半径比较规律:
1、电子层数越多,半径越大 2、电子层数相等,质子数越大,半径反 而越小 3、电子层数相同,质子数相同,核外电 子数越多,半径越大
回忆与再现
第二周期从左往右,最高正价从__到___ ---------------------------最低负价从__到___ 第源自周期从左往右,最高正价从__到___
