临床试验审批表(药物类)
临床试验审批表(药物类)

临床试验审批表(药物类)
临床试验审批表(药物类)
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。
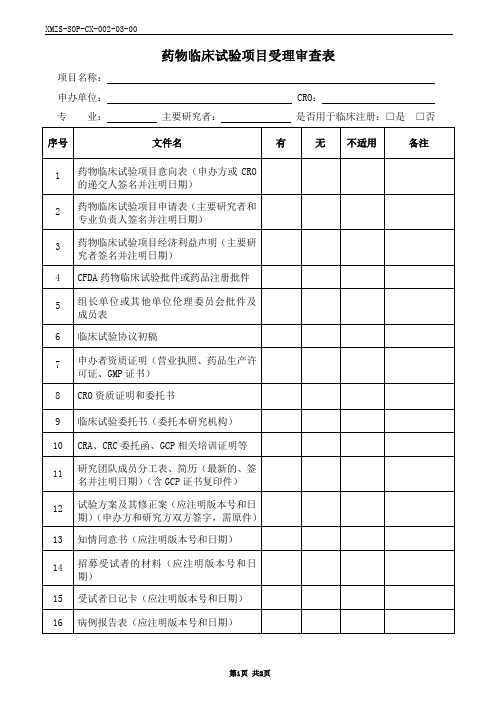
药物临床试验项目受理审查表
试验用药品检验报告(包括试验药物和对照药品)
20
设盲试验的破盲规程
21
保险合同或说明
22
参加单位名单及联系方式
23
其他
备注:
1.所有文件提交纸质版并加盖首页章和骑缝章,同时提交电子版。
2.目录中要求注明版本号和日期的,请务必在备注栏写明。
3.提交的材料按照清单的顺序依次排列,如需自行添加目录的,请写明添加的内容。目录顺序不能变动,如该项资料没有,请空页。
4.请使用快劳夹(黑色,高315mm)装订,且必须提供册封,册封注明项目名称和申办方名称。
5.送审人签字为本项目的主要研究者。
机构审查结论:□同意递交伦理,机构编号:
□不同意递交伦理,原因:
送审人签字:时间:年月日
受理人签字:时间:年月日
4
CFDA药物临床试验批件或药品注册批件
5
组长单位或其他单位伦理委员会批件及成员表
6
临床试验协议初稿
7
申办者资质证明(营业执照、药品生产许可证、GMP证书)
8
CRO资质证明和委托书
9
临床试验委托书(委托本研究机构)
10
CRA、CRC委托函、GCP相关培训证明等
11
研究团队成员分工表、简历(最新的、签名并注明日期)(含GCP证书复印件)
药物临床试验项目受理审查表
Hale Waihona Puke 项目名称:申办单位:CRO:
专业:主要研究者:是否用于临床注册:□是□否
序号
文件名
有
无
不适用
备注
1
药物临床试验项目意向表(申办方或CRO的递交人签名并注明日期)
2
药物临床试验项目申请表(主要研究者和专业负责人签名并注明日期)
药物临床试验项目审批表

签字: 年月日
例
二. 申办方信息
公司名称
申办方
通讯地址 法人代表
联系人
联系电话
公司名称
CRO
通讯地址
(如有)
法人代表
联系人
联系电话
临床监查员姓名
联系电话
组长单位(如有)
组长单位主要研 究者(如有)
三. 附件材料(纸质版和电子版均需要)
□ NMPA 药物临床试验批件或通知书(上市药物应有药品注册证书)
□ 药物检验合格报告
GCP 机构办主任签字:
学科办主任签字:
年月日 伦理委员会审查意见:
年月日
盖章: 年月日
1.合同/协议 2.法律意见书: GCP 机构办审批意见: 学科办意见:
财务部意见:
机构副主任意见:
审计科意见:
总会计师意见:
机构主任意见:
签字: 年月日
签字: 年月日
签字: 年月日
签字: 年月日
签字: 年月日
加盖单位红章。
□ 项目经理的法人委托书原件,项目经理身份证或/和工作证复印件,GCP 证书,
并加盖单位红章。
□ 临床试验方案(需注明版本号)
□ 病例报告表样表(需注明版本号)
□ 知情同意书样本(需注明版本号) □ 研究者手册(需注明版本号) □ 受试者招募方案和广告(需注明版本号) □ 课题负责人简历、医师资格证、注册证、GCP 培训证书 □ 药物临床试验团队名单 □ 申办方公司/CRO 公司委托医院试验的委托函,加盖申办方公章。 □ 组长单位伦理批件(如有) □ 保险凭证(如有) □ 其他
申办方单位联系人签字(盖章):
年月日
经费预算情况(请罗列该项目涉及的所有经费情况,包括但不限于检验检测费、
临床试验立项申请审批表CTI-A--A02-V0临床试验立项申请审批表

临床试验申请审批表(申请者签名、盖章并签署日期)
2.
国家食品药品监督管理总局《药物临床试验批件》部分Ⅳ期可不要求
3.
申办者资质证明及委托函;
4.
试验用药物检验合格报告
5.
临床试验方案摘要
6.
临床试验方案(注明版本号和日期)
7.
病例报告表(注明版本号和日期)
8.
知情同意书(注明版本号和日期)
9.
研究者手册(注明版本号和日期)
临床试验申请审批表(申请者签名、盖章并签署日期)
2.
申办者资质证明(法人证书、营业执照、GMP证书)
3.
医疗器械说明书
4.
注册产品标准或相应的国家、行业标准
5.
试验用医疗器械/诊断试剂研制的质量保证和质量控制文件
6.
试验用医疗器械/诊断试剂的自检报告
7.
临床试验方案摘要
8.
临床试验方案(注明版本号和日期)
□义肢□特殊管理药物(麻醉药申办者签字
(盖章)
日期
以下由专业科室及机构办填写
专业科室评估:
1.是否能保证招募足够的受试人群:是□,否□
2.研究者是否具备足够的试验时间:是□,否□
3.是否具备相应的仪器设备和其他技术条件:是□,否□
4.目前科室承担的与试验药物疾病相同的在研项目:无□,1项□,2项□,2项以上□
科室是否使用过同类药物或医疗器械是□否□
试验用产品
□药物
名称
CFDA批件号:
□食品
名称
CFDA批件号:
□医疗器械
1.□境内II类□境内III类□进口II类□进口III类
2.□有源□无源
3.□植入□非植入
药物临床试验伦理初始审查申请与审批表

年月日——年月日
分类
1.□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期2.□新药□仿制药3.□国家药品监督管理局批文:
多中心临床试验
ห้องสมุดไป่ตู้1.□是□否
2.该临床试验方案有无其他伦理委员会意见?
□有(请提供副本)□无3.本中心招募受试者人数/总人数
临床试验对象
□正常人□病人
受试者年龄范围
弱势群体
(如涉及请提交弱势群体保护措施)
□是□否
11
组长单位伦理委员会审查意见(如有)
□是□否
12
其它伦理委员会对该项目伦理审查的重要决定(如有)
□是□否
13
申办者及代理人资质证明文件(如有)
□是□否
14
国家药品监督管理局临床试验批文
□是□否
15
保险合同
□是□否
16
申办者保证所提供资料真实性的声明
□是□否
17
研究者保证所提供资料真实性的声明
□精神疾病□病危者□孕妇□文盲
□未成年人□认知损伤者□其他(请具体说明)
□无
要求排除对象
□无□男性□女性□儿童□其他(请具体说明)
要求具备的特殊条件
□重症监护□隔离区□手术□儿童重症监护
□静脉输注□计算机断层扫描□基因治疗
□义肢□管制药品(麻醉药/精神药)□妇科
□其他(请具体说明)□无
需提交的文件
1
□是□否
18
其他与伦理审查相关的材料
□是□否
主要研究者签名:
主要研究者所在科室意见:
负责人签名:
临床试验机构的药物器械临床试验管理部门意见及签章:
签章
年月日
伦理委员会审查意见:
药物临床试验申请审批表

3.申办者对试验过程质量保证的能力:强□,一般□,弱□
评估意见:同意□ →主要研究者:研究者:
不同意□
机构办主任签字:
日期:年月日
3.是否具备相应的仪器设备和其他技术条件:是□,否□
4.目前科室承担的与试验药物疾病相同的在研项目:无□,1项□,2项□,2项以上□
5.主要研究者在研科研课题:无□,1项□,2项□,3项□,3项以上□
6.主要研究者:
评估意见:同意□,不同意□
主要评估者签字:
日期:年月日
机构办公室评估、立项备案:
1.临床前研究资料是否齐全:是□,否□
药物临床试验申请审批表
项目名称
试验类型
Ⅱ期□,Ⅲ期□,IV期□,其他□
承担科室
临床试验项目主要研究者PI联系电话临床试验专业负责人联系电话
申办者/CRO
申办者/CRO项目经理
联系电话
申办者/CRO监察员CRA
联系电话
专业科室评估:
1.是否能保证招募足够的受试人群:是□,否□
2.研究者是否具备足够的试验时间:是□,否□
药物临床试验立项资料审核表

备注:
如为注册临床试验项目(BE除外),本条款任何一项为“否”且括号中也为“否”,本条款不合格;如为BE项目或非注册临床试验项目,本条款不适用。
3
组长单位伦理委员会批件(如有)
□是□否□NA
3.1 设组长单位
□是□否
3.2盖申办方红章
□是□否
3.3附签名的伦理委员会成员表
□是□否
备注:
7
药品说明书(对照药品、联合用药品、IV期药物等)
□是□否□NA
7.1 有上市后药品
□是 □否
7.2盖申办方红章
□是 □否
7.3 涵盖了方案中所有的上市药品
□是 □否
备注:
如有上市后药品,本条款均为“是”,本条款合格;如无上市后药品条款不适用。
8
主要研究者资质
□是□否
8.1 履历表已签名、签日期
□是 □否
□是 □否
备注:
本条款任何一项为“否”,本条款不合格。
12
(电子)病例报告表(样表)
□是 □否 □ NA
12.1 有病例报告表
□是 □否
12.2盖申办方红章
□是 □否
12.3为本项目病例报告表
□是□否□NA
备注:
如果有病例报告表,本条款任何一项为“否”,本条款不合格;如果无病例报告表,本条款不适用。
药物临床试验立项资料审核表
项目名称
方案编号
专业组
主要研究者
序号
内容
是否合格
1
药物临床试验立项申请表
□是□否
1.1盖申办方红章
□是□否
1.2项目名称与方案一致
□是□否
1.3 主要研究者签名、签日期
药物临床试验申请表药物临床试验申请表
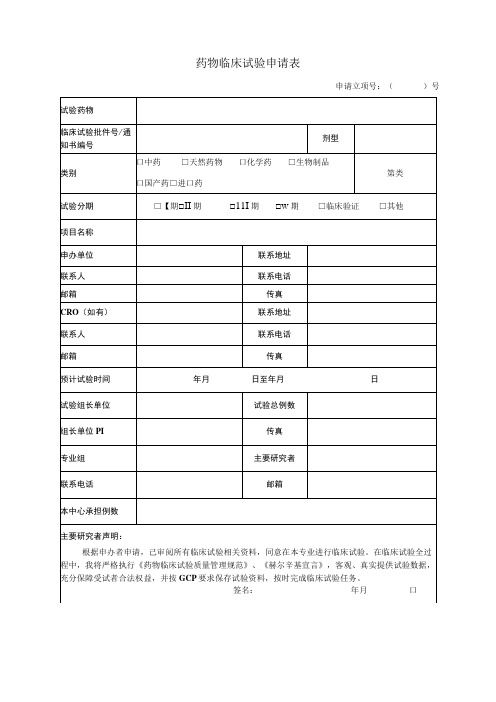
申请立项号:()号
试验药物
临床试验批件号/通知书编号
剂型
类别
口中药□天然药物口化学药□生物制品
口国产药□进口药
第类
试验分期
□【期□II期□11I期□w期□临床验证□其他
项目名称
申办单位
联系地址
联系人
联系电话
邮箱
传真
CRO(如有)
联系地址
联系人
联系电话
邮箱
传真
预计试验时间
年月日至年月日
□
□
15
招募受试者材料(包括广告)
□
□
16
保险凭证
□
□
17
其他有关资料(受试者日记卡、试验协议初稿、光盘、
CRC授权委托书等,如有必要请自行增加)
□
□
递交人(PI):日期:年月日
机构办公室审核人签字:日期:年月日
备注:1、递交的材料封面均盖上公章,递交一份完整资料即可;
2、如有特殊情况,请在备注栏说明。
□
□
7
病例报告表(样表)
□
□
8
知情同意书(盖章)
□
□
9
申办者/合同研究组织;第三方检测机构资质证明
□
□
10
申办者对监查员的授权委托书
□
□
11
试验药物的药检证明
□
□
12
对照药品的药检证明、药品说明书
□
□
13
研究团队的人员组成名单及分工表
□
□
14
主要研究者及参加试验其他研究者的最新简历
(签名并注明日期)
签名:年月口
机构办公室审查意见:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床试验审批表(药物类)
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。
