2010年跨国药企药品研发概览
2010年全球制药前50强企业及其畅销药物(中文名)

来)
Alimta
力比泰
Humira
10(11)
美国
Abbott(雅 培)
Trilipix/Tri 199 27.7 37.24
Cor
Kaletra
克力芝
Bristol-My
ers
11(10) 美国 Squibb(百 195 时美-施贵 宝)
以色 Teva(梯瓦
12(16)
161
列 制药)
Amgen(克)
FluLaval
vaccine
Flixotide/Fl 辅舒酮 fluticasone
氟替卡松
ovent
AstraZenec
Crestor
可定
Rosuvastatin 罗伐他汀
7(6)
英国 a(阿斯利
333
1.4
42 Nexium
耐信
Esomeprazole 艾美拉唑
Perindopril 培哚普利
1.3 6.71 Avastin
阿瓦斯 丁
Bevacizumab 贝伐单抗
2.4 8.97 Remicade
infliximab
英利昔单抗
Migard/All 0.2 N/A
egro 2.3 8.47 Cerezyme 7.9 8.05 Botox 7.4 10.54 Lexapro
利培酮 奥氮平 度洛西汀
培美曲塞二钠
Adalimumab 阿达木单抗
Fenofibrate 非诺贝特
Luopinawei/L 洛匹那韦/利
ituonawei
托那韦
clopidogrel bisulfate
氯吡格雷硫酸 氢盐
glatiramer acetate
2010年新药研发领域中的品种透视(二)

2 年新药研发领域 中的品种透视 ( ) 0 1 0 二
是 人 体 免 疫 球 蛋 白 静 脉 注 射 液
(1 ) , 在 欧 盟 市 场 上 称 为 I G V
Ko i m ,主 要 用 于 治 疗 轻 中 度 阿 尔 i g vt 茨 海 默 病 。 该 药 物 是 通 过 美 国 食 品
与 药 品 管 理 局 ( D )的 新 药 应 用 F A
用 药 、 减 肥 类 药 物 、 呼 吸 系 统 用 药和 罕 见 疾 病 用 药 等 , 已成 为 众 望 所 归 的品 种 。
的 历 史 新 高 。 同 样 ,进 入 药 物 临
床 试 验 的 项 目也 是 巨 大 的 , 从 等
待 上 市 的 新 药 和 进 入 Ⅲ期 临 床 实
竞 争 ,其 中 新 的 口服 释 药 系 统 制
丰 富
好 的
剂 占 据 了较 大 的 比 例 。
性 ,
在 研 治 疗 痛 类 药 物 系 列 品 种 表 现 不 俗 之 外 , 还 有 几 类 药 物 值 得 关 注 。 主 要 是 中 枢 神 经 类 的 阿 尔 茨 海 默 病
调 查 性评 估 的项 目,随着 Ⅲ 期 临床
试 验 的开 展 ,预 示 着 将成 为 未来 市
场 的领 跑 者 。
Kiv g m 含 有 多 种 形 式 的 免 o it
疫 球 蛋 白 。 尽 管 在 治 疗 阿 尔 茨 海
2010年上半年全球首次批准新药_马培奇

上海食品药品监管情报研究
药 品 与 医 疗 器 械
药品与医疗器械
2010年上半年 全球首次批准新药
马培奇
2010年上半年,全球共首次批准了7个新分 子实体和5个新生物制剂(表1),其中包括3个代 谢疾病治疗新药、2个抗肿瘤新药、1个抗感染新 药、1个血管系统疾病治疗新药、1个精神神经系 统疾病治疗新药、1个免疫系统疾病治疗新药、1 个肌骨骼疾病治疗新药、1个生殖系统用新药和1 个其它疾病治疗新药。 一、代谢疾病治疗新药 (一)溶组织梭菌胶原酶 (collagenase clostridium histolyticum /Xiaflex) Auxilium制药有限公司开发,2010年2月获得 美国FDA批准,用于治疗成人已有可触知索带的 杜氏挛缩症(Dupuytren’ contracture)患者。杜 s 氏挛缩症又称掌腱膜挛缩症,而溶组织梭菌胶原 酶是迄今FDA批准的第一个和唯一一个杜氏挛缩 症治疗药物。 杜氏挛缩症是一种影响手掌皮下结缔组织 的进行性手疾病,以掌中皮下胶原异常沉着并蓄 积、致使皮下凹陷和形成结节为特征。随着疾病 进展,患者会出现一条或多条从手掌到指尖的 硬、厚的绳状样索带,进而导致手指挛缩、整只 手不能伸直,手的功能受到限制。杜氏挛缩症 在高加索人种(北欧血统的白种人)男子中的 发病率最高(在全球高加索人种中的发病率为 3%~6%,其中欧美地区约有24万患者),发病 年龄一般在50岁以上。杜氏挛缩症原仅有手术这 一种治疗方法。 溶组织梭菌胶原酶中含有来自溶组织梭状芽 孢杆菌的两种微生物产胶原酶,注射到杜氏挛缩 症患者手掌索带里后可使索带软化并最终消退, 由此恢复手掌和手指的灵活性。一项对306例受试 者进行的关键性临床研究显示,溶组织梭菌胶原 酶治疗能使64%的杜氏挛缩症患者的手指达到可 动性这一主要疗效终点。相比之下,安慰剂组达 到此终点的患者比例只有7%。另一项仅包括44例 受试者的小型试验也获得了类似结果,溶组织梭 菌胶原酶和安慰剂两组的治疗成功率分别为44% 和5%。 溶组织梭菌胶原酶治疗的最常见副反应是 注射位置或手肿胀、注射位置出血或硬伤、注射 位置或手疼痛或触痛、肘或腋下淋巴结肿胀、瘙 痒、皮肤泛红和腋下疼痛。溶组织梭菌胶原酶 治疗也可能引致某些不太常见、但却严重的副反 应,如腱或韧带断裂或损伤、手神经损伤和严重
2010年美国FDA批准新药简析_谭初兵

现代药物与临床 Drugs & Clinic 第26卷第2期2011年3月• 81 •• 综述 • 2010年美国FDA批准新药简析谭初兵1,汤立达2*,徐为人11. 天津药物研究院天津市新药设计与发现重点实验室,天津 3001932. 天津药物研究院药代动力学与药效动力学省部共建国家重点实验室,天津 300193摘 要:2010年美国食品药品监督管理局(FDA)共批准21个新药,简要介绍其中的重点品种,并就新药研发的现状与趋势进行分析。
在FDA批准上市的新药中,迪诺苏单抗(Prolia™,denosumab)、达比加群酯(Pradaxa®,dabigatran etexilate)、芬戈莱默(Gilenya®,fingolimod)等新药作用独特或市场前景广阔,颇受关注。
2010年上市新药总体数量未见增加,但其中的孤儿药和特色药数量明显增多,生物制品的比重也显著增加,体现出医药产业界研发重心和模式的转变。
关键词:新药;孤儿药;迪诺苏单抗;达比加群酯;芬戈莱默中图分类号:R954 文献标志码:A 文章编号:1674 - 5515(2011)02- 0081- 03Analysis of new drugs approved by FDA in 2010TAN Chu-bing1, TANG Li-da2, XU Wei-ren11. Tianjin Key Laboratory of Molecular Design and Drug Discovery, Tianjin Institute of Pharmaceutical Research, Tianjin300193, China2. State Key Laboratory of Pharmacokinetics and Pharmacodynamics, Tianjin Institute of Pharmaceutical Research, Tianjin300193, ChinaAbstract: The US Food and Drug Administration (FDA) approved 21 new drugs in 2010. In this article, the profile of some exciting products and the trends of drug R&D was provided. Among the FDA approvals, denosumab (Prolia™), dabigatran etexilate (Pradaxa®) and fingolimod (Gilenya®) are particularly mechanistically interesting or commercially exciting. In 2010, there was not increase in the overall number, but the proportion of orphan drugs and specialty care products increased significantly, and the proportion of biologics raised obviously too, which could suggest the change of focus and mode of drug R&D.Key words: new drug; orphan drug; denosumab; dabigatran etexilate; fingolimod2010年美国食品药品监督管理局(FDA)共批准首次上市新药21个,其中新分子实体(new molecular entity, NMEs)15个,新生物制品(biologic license applications, BLAs)6个,包括癌症、糖尿病等常见病用药[1-3]。
2010年度FDA批准的21种新药

药物名称:Lumizyme(α-葡萄糖苷酶)
适应症:庞贝氏症(Pompe disease)
公司:健赞(Genzyme)
批准日期:2010年5月24日
药品类型:生物制品
简要说明:它是一种溶酶体内特异性糖原水解酶。该药品适用于治疗年龄≥8岁、无心脏肥大征象的晚发型(非婴儿期发病)Pompe病患者。所有的Pompe病患者通常会发生进行性肌无力及呼吸困难,但病情进展速度因发病年龄和脏器受累程度而有较大差异。症状出现于出生后数月内时,婴儿常表现出心脏显著增大并于1岁内死亡。当症状出现在儿童期、青少年期或成人期时,患者可能会发生持续进行性无力并因呼吸衰竭而过早死亡。
药物名称:Asclera (polidocanol)
适应症:小血管静脉曲张
公司:Chemische Fabrik Kresussler
批准日期:2010年3月30日
药品类型:小分子药物
简要说明:Asclera被批准用于治疗蜘蛛状血管病(管径小于1mm的微型静脉曲张)和网状静脉的(直径为1至3mm)的治疗。Asclera通过破坏血管内皮细胞而起作用。Asclera常见的不良反应包括注射部位受损血管渗血、水肿、瘀伤、变色和疼痛。
药物名称:EllaOne
适应症:紧急避孕
公司:HRA Pharma, Watson
批准日期:2010年8月13日
药品类型:小分子药物
简要说明:该药物可在无防护措施或避孕失败120小时(5天)内使用。EllaOne是处方药,只能用于紧急避孕不可作为常规避孕手段。
药物名称:芬戈莫德(Gilenya)
药物名称:Xiaflex (collagenase clostridium histolyticum)
世界制药巨头2010年第三季度业绩综述与分析

世界制药巨头2010年第三季度业绩综述与分析在多数企业通过规模并购、开发新兴市场、拓宽经营业务等策略实现销售增长的同时,非专利药物竞争、结构调整、药品召回以及诉讼等问题却大大影响了企业的净收益表现。
长远看来,医药业的整合风仍将继续。
行业发展将呈现出两大趋势,一些企业聚焦于新产品的研发,另一些则致力于非专利药物的生产,那些无所作为的企业很可能在未来的市场竞争中惨遭淘汰。
从10月中旬到11月上旬,世界制药巨头陆续公布了2010年第三季度业绩报告。
在大多数企业实现销售增长的同时,非专利药物竞争、结构调整、药品召回以及诉讼等问题却大大影响了企业的净收益表现。
十强企业的三季度报告中,销售收入增长的企业有6家,然而净收益增长的企业仅3家。
从表1可见,三季度销售收入增长最为显著的企业是美国默克公司(Merck)和辉瑞公司(Pfizer),增幅分别达到84%和39%,二者之前分别并购了先灵葆雅公司(Schering-Plough)和惠氏公司(Wyeth),三季度的销售激增继续体现着并购后的协同优势。
与之相对应的是,三季度净收益增长最为显著的企业是瑞士诺华公司(Novartis)和法国赛诺菲-安万特公司(Sanofi-Aventis),增幅分别达到10%和9%。
巧合的是,这两家企业有着不错的非专利药物经营业绩,本季度非专利药业务均达到两位数增幅。
业界对赛诺菲-安万特收购健赞、诺华收购爱尔康依然保有高度的关注,医药业的整合风仍在继续。
长远看来,行业发展将呈现出两大趋势,一些企业聚焦于新产品的研发,另一些则致力于非专利药物的生产,而那些无所作为的企业很可能在未来的市场竞争中惨遭淘汰。
2010年已经过去3/4,制药巨头能否顺利完成年初的预订目标,交出一份满意的业绩报表?让我们拭目以待。
表1 制药巨头2010年第三季度业绩概况公司名称销售收入(亿美元)变化净收益(亿美元)变化全年每股收益预期(美元)辉瑞162 +39% 8.66 -70% 2.17~2.22 强生150 -1% 34 +2% 4.70~4.80 赛诺菲-安万特78亿欧元+6% 25亿欧元+9% 预期增长2% 诺华126 +13% 23 +10%罗氏115亿瑞士法郎-7% / /葛兰素史克68亿英镑+1% 13亿英镑-3.5%默克111 +84% 3.42 -90% 3.31~3.39阿斯利康79 -4% 15 -27% 6.50~6.65雅培87 +12% 8.91 -40% 4.16~4.18安进38 0 12 -11% 5.05左右1、辉瑞公司:并购惠氏影响三季度业绩,公司上调全年收益预期美国辉瑞公司(Pfizer)11月2日公布2010年第三季度业绩报告。
全球药品研发进展_2010_05_

杂类
(新市场)
Pharmaceuticals
注
在美国上市)
注册 新制剂/固定剂 (新市场) 量复方制剂,
ketoprofen + omeprazole (酮洛芬+奥美拉唑)
Meda
环氧合酶1、2抑制剂,H+、 K+转运ATP酶抑制剂
口服
类风湿性关节炎,强直 意大利,波兰,葡萄 抗炎和抗风湿药 骨骼与肌肉用药 性脊柱炎,骨关节炎, 牙,西班牙(2010年首
本月在新市场补充注册的药物有 7 个,其中有 4 个新活性物质,分属骨骼与肌肉用药 (Berinert-P)、 抗感染药 ( 肺炎球菌疫苗 )、皮肤科用药 ( 阿利维 A 酸 ) 和杂类 ( 乙酰半胱氨酸 )。3 个新制剂,分属骨骼与 肌肉用药的酮洛芬 + 奥美拉唑固定剂量复方制剂 ( 同 属 24 h 内缓释制剂,口服肠溶制剂 )、生殖系统用药 及性激素的地诺孕素 + 雌二醇固定剂量复方制剂 ( 同 属其它口服制剂 ),以及神经系统用药的芬太尼其它 缓释制剂 ( 同属局部用透黏膜制剂和全身用透黏膜制 剂 )。
中国医药工业杂志 Chinese Journal of Pharmaceuticals 2011, 42(3)
· XXI ·
全球药品研发进展(2010.05)
Progress of Global Pharmaceutical R&D in May 2010
刘玲玲
(中国医药工业信息中心,上海 200040)
意大利,卢森堡公国 (2009年首次在美国上
市) 印度,土耳其(2010年
首次在美国上市)
抗炎和抗风湿药 疫苗
骨骼与肌肉用药 抗感染药
中国医药工业杂志 Chinese Journal of Pharmaceuticals 2011, 42(3)
2010年FDA批准的新药
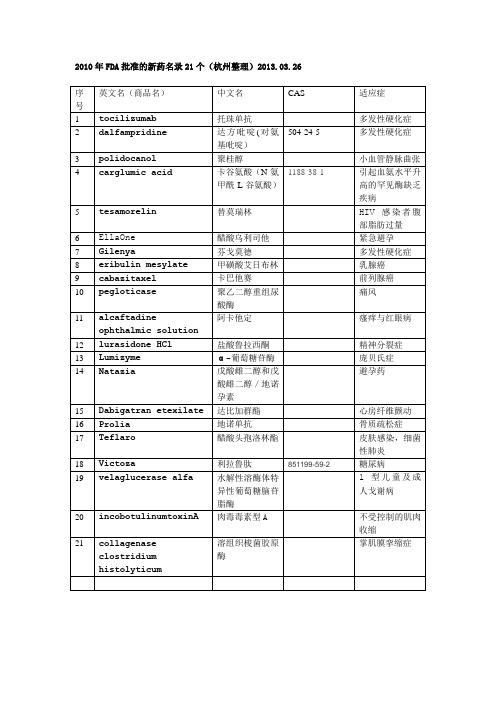
2010年FDA批准的新药名录21个(杭州整理)2013.03.26序号英文名(商品名)中文名CAS 适应症1 tocilizumab托珠单抗多发性硬化症2 dalfampridine 达方吡啶(对氨基吡啶)504-24-5 多发性硬化症3 polidocanol聚桂醇小血管静脉曲张4 carglumic acid卡谷氨酸(N-氨甲酰-L-谷氨酸)1188-38-1引起血氨水平升高的罕见酶缺乏疾病5 tesamorelin替莫瑞林HIV 感染者腹部脂肪过量6 EllaOne醋酸乌利司他紧急避孕7 Gilenya芬戈莫德多发性硬化症8 eribulin mesylate甲磺酸艾日布林乳腺癌9 cabazitaxel卡巴他赛前列腺癌10 pegloticase聚乙二醇重组尿酸酶痛风11 alcaftadineophthalmic solution阿卡他定瘙痒与红眼病12 lurasidone HCl盐酸鲁拉西酮精神分裂症13 Lumizymeα-葡萄糖苷酶庞贝氏症14 Natazia戊酸雌二醇和戊酸雌二醇/地诺孕素避孕药15 Dabigatran etexilate达比加群酯心房纤维颤动16 Prolia地诺单抗骨质疏松症17 Teflaro醋酸头孢洛林酯皮肤感染,细菌性肺炎18 Victoza利拉鲁肽851199-59-2糖尿病19 velaglucerase alfa水解性溶酶体特异性葡萄糖脑苷脂酶1 型儿童及成人戈谢病20 incobotulinumtoxinA肉毒毒素型A不受控制的肌肉收缩21 collagenaseclostridiumhistolyticum 溶组织梭菌胶原酶掌肌膜挛缩症。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2010年跨国药企新药研发概览2010年,美国食品药品管理局(FDA)批准的新药为21个(2009年和2008年分别为25个和21个),欧洲药品管理局(EMA)批准的新药仅为14个,创近年来的新低;跨国药企研发的新药在FDA或EMA严格的审核下,或被批准,或遭受到拒绝或退市的命运,一些被寄予厚望的新药在Ⅲ期临床中遭遇失败的现象也屡见不鲜。
本文对刚刚过去的2010年跨国药企新药研发中遭遇的临床试验失败、批准被推迟、获得批准、黯然退市的情况分别进行了概括和分析,这既是对过去一年国际上新药研发状况的总结,更是对国际上药品研发管理所反映出的具有代表性问题的反思。
2010年制药公司的研发(R&D)生产率和高R&D投入依旧是热门话题,被取缔的新药依旧保持在近年来的每年20~25个的范围内,而生物制品(单克隆抗体和疫苗)占据着获批新药的重要份额;安全问题导致了新减肥药批准的推迟以及西布曲明、西他生坦(Thelin)和梵帝雅(Avandia,在欧洲退市,在美国使用受限)的退市;辉瑞有3个新药获得FDA批准,成为最大赢家;礼来则有3个Ⅲ期临床失败产品和一只生物制品申请遭拒;罗氏、诺华和阿斯利康也分别有2个新药申请遭FDA和其咨询委员会的拒绝;葛兰素史克和默沙东分别有4个和3个新药获得EMA批准,然而却未有新分子实体(NME)通过FDA批准。
对于现在药物增加新适应证或者新的复合药物将不在本文讨论范围内。
研究失败的药物2010年,跨国药企开发更加安全有效的新药以满足患者的现实需要的需求愈发强劲,然而,由于新药开发过程中需要与安慰剂和有效对照药物进行长期试验,新药获得批准的势头依旧低迷。
对于癌症药物,患者存活率是新药批准的主要终点。
近几年,制药行业的并购并没有拯救制药公司新药研发的生产力,事实上正在导致这一能力的下降;并购活动也导致了R&D人员缩减和定位的调整。
制药行业不断增加的R&D预算与新药的批准数量并不匹配。
在过去的五年里,罗氏一直都是有效利用R&D并获得大量产品的公司,不过在2010年却仅有1个新药获得批准,2个主要药物遭遇Ⅲ期临床试验的失败,阿瓦斯汀也被FDA撤销了乳腺癌的适应证;辉瑞在充分有效利用R&D并有3个新药获得批准的同时,也遭遇了2个新药Ⅲ期临床试验的失败。
因安全和疗效而失败的具有“重磅炸弹”级潜力的Ⅲ期新药可能导致制药公司损失数十亿美元(见表1)。
另外,2010年,作为热门研究领域的癌症药物研究也纷纷遭遇了失败(见表2)。
表1 2010年具有“重磅炸弹”级潜力Ⅲ期试验失败的新药适应证(疾病) 药物公司阿尔茨海默病Dimebon 辉瑞和MediavationSemagacestat 礼来糖尿病Tapsoglutide 罗氏和益普生(Ipsen)Teplizumab 礼来HIV Apricitabine 艾维克(Avexa)Vicriviroc 默沙东(原先灵葆雅公司产品)Raltegravir (Isentress) 默沙东严重肢体缺血NV1FGF 赛诺菲-安万特和Vical脑出血Clozosentan Actelion慢性阻塞性肺病Aclidinium bromide ***罗(Almirall)和Forest旅行者腹泻肠毒素大肠杆菌(ETEC)疫苗Intercell和葛兰素史克特发性肺纤维变性Ambrisentan 吉利德(Gilead)表2 2010年Ⅲ期试验失败的癌症新药公司适应证药物辉瑞乳腺癌和前列腺癌Sutent非小细胞型肺癌Figitumumab阿斯利康转移性结直肠癌和恶性胶质瘤Cediranib前列腺癌Zibotentan安进头颈部癌症VectibixAntisoma和诺华非小细胞型肺癌ASA404Genmab 头颈部癌症Zalutumumab真科生物技术(Genvec)胰腺癌TNFerade礼来头颈部癌症Alimta黑素瘤Tasis***Novelos 非小细胞型肺癌NOV-002诺华乳腺癌复发Zometa罗氏胃肠癌和乳腺癌Avastin推迟批准的药物如今,FDA更强调新药对患者的整体安全性和药物相关的不良反应情况。
FDA已经开始采取新的措施在批准新药时增加了安全和疗效的规定,主要是针对在已证实的抗生素耐药领域开发的新的抗生素、仿制药和个体化用药的生物标记物,以及需要为患者提供更详细信息的标签更换。
在过去的一年里,基于上述原因,FDA也对一些新药的批准采取了推迟措施(见表3)。
表3 2010年FDA推迟批准的新药药物FDA咨询委员会推荐意见(支持-反对-弃权)和时间推迟时间(月) 批准时间Egrifta 16-0(2010-5-27) 6 2010-11-12Prevnar 13 10-1(2009-11-19) 3 2010-2-24Gilenya 25-0(2010-6-11) 3 2010-9-21Acthar 20-1-2(2010-5-6) 3(2010-9-8再次因标签修订推迟) 2010-10-15Afrezza FDA于2010-12-29决定推迟评审决议4周至2011-1-29Benlysta 13-2(2010-11-16) 处方药申报者付费法案(PDUFA)日期从2010-9-12推迟至2011-3-10Brilinta FDA要求阿斯利康提供此药对18000患者与Plavix对比研究的新分析,说明对美国患者疗效较差而对其他地区患者疗效较好的原因,在2010年3~4季度进行再次评审。
Halaven 未经FDA咨询委员会评议3 2010-11-18获得批准的药物2010年,FDA批准的具有数十亿美元销量潜力的药物有达比加群酯(Dabigatran)、芬戈莫德(Fingolimod)、利拉鲁肽(Lir aglutide)、普瑞巴林(Pregabalin)、Tesamorelin、妥克利骨胶囊(Tocilizumab)、狄诺塞麦(Denosumab)和疫苗Prevnar 13、Provenge、Menveo。
辉瑞有3个新药获得FDA批准,成为最大的赢家。
FDA也拒绝了一些新药或者发出回复信,生物制品申请/新药上市申请(NDA/BLA)获得批准的机会已经从2009年的75%降至2010年的60%。
下面列出的是部分具有“重磅炸弹”级潜力药物的研究结果。
Denosumab 安进公司递交给FDA和欧洲药品评价局(EMEA)的Denosumab文件包括对10500名绝经后骨质疏松症和1700名乳房和前列腺癌手术患者的30项临床研究资料。
安进这一药物的癌症试验项目纳入8000名患者,成为单克隆抗体或者生物制剂产品中涉及患者最多的项目。
在绝经后骨质疏松症研究中,Denosumab与骨质疏松症治疗药Fosamax(目前治疗的“金标准”药物)对比试验显示出其具有更好的安全性和疗效;在对骨癌的研究中,该药一项与Zometa的对比试验研究显示具有优势;另外一项研究结果显示其疗效无差异;在第三项对2046名晚期乳腺癌妇女Ⅲ期骨转移试验中,Denosumab的疗效明显优于Zom eta。
在两年的FREEDOMS研究中,Fingolimod可使复发型的多发性硬化症复发率下降44%~62%,与安慰剂相比,致残进展延迟3 0%。
在对1153名患者治疗一年的研究中,复发率很低并且相对危险度(RR)下降了31%,脑MRI显示T2损害下降67%。
Fi ngolimod由三菱田边制药公司(Mitsubishi Tanabe)发现和开发的,被诺华购买获得。
Tocilizumab 在罗氏开展的Tocilizumab治疗类风湿性关节炎的双盲试验中,安慰剂组患者为979人,低剂量(4mg/kg)组患者为546人,4周1次高剂量(8mg/kg)静脉给药组患者为2792人,其中大多数患者为白种女性类风湿因子阳性患者。
试验结果显示,服用缓解疾病的抗风湿性药物无效的患者在使用tocilizuma治疗后有33%的人病情得到缓解,8mg/kg组中48%的患者临床症状缓解,65%的患者在用药2小时后见效。
Pradaxa Pradaxa(dabigatran)是一种被FDA批准用于治疗房颤患者发生卒中风险的口服凝血酶抑制剂,是FDA近50年来首个批准的口服抗凝血药。
在全球44个国家的900家医院对Pradaxa进行的Ⅲ期试验结果显示,Pradaxa可显著降低卒中风险,与华法林相比可使全身性栓塞降低35%。
150mg剂量的Pradaxa可使主要出血事件、脑内出血和血管发病率降低。
而且Pradaxa 无需像华法林那样进行监测或者调整剂量,并且与食物和几种常见联合使用的药物无相互作用。
2010年,EMA批准的“重磅炸弹”级的潜力药物有Tocilizumab、Denosumab、Ofatuzumab和帕唑帕尼(Pazopanib)。
葛兰素史克有4个新药获得EMA 批准,成为欧洲R&D的佼佼者,默沙东紧随其后,有3个新药获得批准。
不过文迪雅的退市使欧洲药物市场黯然失色。
黯然退市的药物2010年,辉瑞、葛兰素史克和雅培等大型制药公司都面临了药物退市的风波,主要是基于药物的安全问题(见表4)。
表4 2010年药物主要退市事件公司药物退市原因雅培西布曲明(Meridia)心脏病发作和卒中不良反应增加辉瑞Mylotarg 治疗急性单核细胞性白血病缺乏疗效和意外死亡,2009年价值1200万美元药物退市Thelin (sitaxentan) 诱发肝损伤导致3例死亡葛兰素史克文迪雅(罗格列酮) 心血管风险增加,欧洲退市,美国使用受限Xanodyne 达尔丰(Darvon),达尔持特(Darvocet)和其他含有丙氧酚的止痛药增加心脏节律异常风险ReGen Menaflex膝关节植入物潜在的政治压力和无科学依据性罗氏Avastin 该药给患者带来的益处并不能超过其潜在的用药风险。
FDA和EMA撤销了Avastin在晚期乳腺癌的应用并要求罗氏修改处方药标签信息相关链接2010年药物销量排行榜尽管几只“重磅炸弹”级药物面临着艰难的市场环境和专利到期的命运,不过2010年全球的药物市场还是达到了8500亿美元。
其中,中枢神经系统疾病、心血管疾病和癌症药物销量位居前三名;单克隆抗体、疫苗和TNF抑制剂位居生物制品前三甲;生物技术药物和仿制药再次展现了强劲的增长势头,销售额分别达到1400亿美元和1200亿美元;虽然面临着仿制药和新竞争产品的压力,降血脂药物立普妥(Lipitor)的销量轻微下跌,但其仍旧保持着全球最畅销药物领头羊的位置,紧随其后的是波立维(P lavix),年销售额超过90亿美元;有6种生物制品进入全球最畅销药物前12名,8种生物制品进入前20名。
