热力学基础PPT课件
大学物理热力学基础PPT课件

d Q 微小热量 :
> 0 表示系统从外界吸热; < 0 表示系统向外界放热。
等价
2
精选PPT课件
上页 下页 返回 退出
二、热力学第一定律 (The first law of thermodynamics)
某一过程,系统从外界吸热 Q,对外界做功 W,系 统内能从初始态 E1变为 E2,则由能量守恒:
循环过程
V
1. 热力学第一定律适用于任何系统(固、液、气);
2. 热力学第一定律适用于任何过程(非准静态过程亦 成立)。
6
精选PPT课件
上页 下页 返回 退出
四、 W、Q、E的计算
1.W的计算(准静态过程,体积功)
F
(1)直接计算法(由定义)
系统对外作功,
2
W=1
Fdx
=
2
1
PS
dx
V2
W = PdV
W = 1 P dV =
RT
2
1
dV V
W
RTl nV( 2 ) V1
P1V1
ln(V2 V1
)
P1V1
ln(P1 P2
)
系统吸热全部用来对外做功。
思考:CT ( 等温摩尔热容量)应为多大?
15
精选PPT课件
上页 下页 返回 退出
§7.4 理想气体的绝热过程 (Adiabatic process of the ideal gas)
吸热一部分用于对外做功,其余用于增加系统内能。
14
精选PPT课件
上页 下页 返回 退出
三.等温过程(isothermal process) P
2024《化学热力学基础》PPT课件

《化学热力学基础》PPT课件目录CONTENCT •引言•热力学基本概念与定律•热化学与化学反应的热效应•熵与熵增原理•自由能与化学平衡•相平衡与相图•结论与展望01引言化学热力学的定义与重要性定义化学热力学是研究化学变化过程中热量和功的相互转化以及有关热力学函数的科学。
重要性化学热力学是化学、化工、材料、能源等领域的重要基础,对于理解化学反应的本质、优化化学反应条件、开发新能源等具有重要意义。
化学热力学的发展历史早期发展19世纪初,随着工业革命的发展,热力学理论开始形成,并逐步应用于化学领域。
经典热力学建立19世纪中叶,经典热力学理论建立,包括热力学第一定律、热力学第二定律等基本定律被提出。
现代热力学发展20世纪以来,随着量子力学、统计力学等理论的发展,化学热力学在微观层面上的研究取得了重要进展。
课程目标与学习内容课程目标掌握化学热力学的基本概念、基本原理和基本方法,能够运用热力学知识分析和解决实际问题。
学习内容包括热力学基本概念、热力学第一定律、热力学第二定律、化学平衡、相平衡、化学反应热力学等。
通过学习,学生将了解热力学在化学领域的应用,培养分析和解决化学问题的能力。
02热力学基本概念与定律80%80%100%系统与环境系统是指我们研究对象的那一部分物质或空间,具有明确的边界。
环境是指与系统发生相互作用的其他部分,是系统存在和发展的外部条件。
系统与环境之间通过物质和能量的交换而相互影响。
系统的定义环境的定义系统与环境的相互作用状态是系统中所有宏观物理性质的集合,用于描述系统的状况。
状态的概念状态函数的定义常见状态函数状态函数是描述系统状态的物理量,其值只取决于系统的始态和终态,与路径无关。
温度、压力、体积、内能等。
030201状态与状态函数热力学第一定律热力学第一定律的表述热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
热力学第一定律的数学表达式ΔU=Q+W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示外界对系统所做的功。
大学物理热力学基础PPT课件

大学物理 I 曹颖
8
15. 3 热力学第一定律、等值过程的应用 一、等容过程 气体容积保持不变 (dV = 0 ) 等容过程中的功 A = 0 (dV = 0) 等容过程内能
i RdT dE M (微小过程) 2 i M E 2 R(T2 T1 ) (有限过程)
内能仅与始末态温度有关。
3)循环过程的功: 正 循 环 A 0 净 A净~净面积 逆 循 环 A净 0 V
2018年10月7日星期日
大学物理 I 曹颖
22
热机:利用工作物质,不断地把热转化为功的装 置。其循环为正循环。A净> 0
高温热源 Q1
系统
A
(工作原理示意图)
Q2
低温热源
水 水蒸汽 废汽 水
' ' ' Q1 E1 A1 A2 A1 0 ' ' ' Q3 E3 A3 A2 A3 0
' A1
' A2
' A3
放热过程。 吸热过程。
2018年10月7日星期日
大学物理 I 曹颖
21
15. 6 循环过程 卡诺循环
一、循环过程 (系统)从某态经历一系列变化过程又回 到初态的(周而复始的)过程。 P b P-V 图上为一闭合曲线。 1)特性: E 0 a c 2)循环过程有正、逆之分。
内
i
ki
i
pi
对于理想气体,忽略分子间的作用 ,则
m i 平衡态下气体内能: E RT M2
2018年10月7日星期日
E理 Ek=E (T )
大学物理 I 曹颖
大学物理-热力学基础-课件
Wa
CV m (T2
T1)
p1V1 p2V2
1
本题用 Wa E 计算较方便
关键用绝热方程
T2
T1
( V1 V2
)
1
先求出 T2
p
p2
2 T2
T2' T1
Q0
p2'
2'
p1
TC
T1
1
o V2 V2' V1 10 V1 V
18.
*四. 多方过程 — 实际过程( 满足 PV n C)
绝热 n = ( CPm / CVm )
等温 n = 1 等压 n = 0
W p1V1 p2V2 n 1
满足 E CV (T2 T1)
Q Cn (T2 T1)
等体 n = ∞
p
可以证明
n= n=∞
n=1
Cn
(
n
n 1
)CV
n=0
o
V
19.
13 – 5 循环过程 卡诺循环
一. 循环过程
1. 特点 E 0 W = Q ( 热功转换 )
1
2
W
(2)热一定律 dQP dE PdV
o V1
V2 V
QP
E
V2 PdV
V1
v
i 2
R(T2
T1 )
P(V2
V1 )
7.
2.摩尔定压热容 CPm
1mol
:
CPm
dQp dT
理论值:
CPm
dE pdV dT
CVm
R
i2R 2
(近似)
实验值:查表 (精确)
QP
dQP
热力学基础PPT课件

REPORTING
目录
• 热力学基本概念与定律 • 热力学过程与循环 • 热力学第二定律与熵增原理 • 理想气体状态方程及应用 • 热力学在能源利用和环境保护中应用
PART 01
热力学基本概念与定律
REPORTING
热力学系统及其分类
孤立系统
与外界没有物质和能量交换的系统。
一切实际过程都是不可逆过程。
热力学温标及其特点
热力学温标 热力学温标是由热力学第二定律引出的与测温物质无关的理想温标。
热力学温度T与摄氏温度t的关系为:T=t+273.15K。
热力学温标及其特点
01
02
03
04
热力学温标的特点
热力学温标的零点为绝对零度 ,即-273.15℃。
热力学温标与测温物质的性质 无关,因此更为客观和准确。
01
可逆过程
02
系统经过某一过程从状态1变到状态2后,如果能使系统 和环境都完全复原,则这样的过程称为可逆过程。
03
可逆过程是一种理想化的抽象过程,实际上并不存在。
04
不可逆过程
05
系统经过某一过程从状态1变到状态2后,无论采用何种 方法都不能使系统和环境都完全复原,则这样的过程称为 不可逆过程。
06
PART 03
热力学第二定律与熵增原 理
REPORTING
热力学第二定律表述及意义
热力学第二定律的两种表述
01
04
热力学第二定律的意义
克劳修斯表述:热量不能自发地从低温物 体传到高温物体。
02
05
揭示了自然界中宏观过程的方向性。
开尔文表述:不可能从单一热源取热,使 之完全变为有用功而不产生其他影响。
热学基础知识.ppt

无摩擦准静态过程,其特点是没有摩擦力,外界在准静态过 程中对系统做的功,可以用系统本身的状态参量来表示。 外界在准静态过程中对系统做的功等于系统对外界做的功的负值
设气缸内的气体进行膨胀过程,当活塞移动微小ห้องสมุดไป่ตู้移dl 时,气
体对外界所作的元功为(系统对外作功为正) V是系统体积
dA
pS
dl
pdV
系统体积由V1变为V2,系统对外界作总功
为:
V2
面积
A pdV 体积功 V1
p
pe
形状不规则的容器(例如充气袋)中的气体作功呢?
p1
a
b
功的数值不仅与初态和末态有关,而且还 依赖于所经历的中间状态,功与过程的路 2 径有关。
功是过程量
0
V1
V V2
求准静态过程的功,即 为求虚线部分的面积
无法用统一的状态参量来描述其状态.
一个过程,如果任意时刻的中间态都无限接近于一个
平衡态,则此过程为准静态过程。显然,这种过程只 有在进行的 “ 无限缓慢 ” 的条件下才可能实现。
对于实际过程则要求系统状态发生变化的时间 △t 远远大于弛豫时间τ才可近似看作准静态过程 。
举例1:外界对系统做功
非平衡态到平衡态的过渡时间,
RT
vi RT
(i 1,2, , n)
n
其中,M mi为n种理想气体的总质量
1
pi 为第i种理想气体单独存在时的压强
n个方程相加得:
( p1 p2 pn )V (v1 v2 vn )RT
n
n
令 p pi v vi
1
1
道尔顿分压定理
pV vRT
化学热力学基础幻灯片

式中,V——混合气体的总体积
式中,ni/n——称为第i种组分气体的物质的量分数
适用条件:
➢ 分压定律仅适用于理想气体混合物 ➢ 对低压下的真是气体混合物也可以近似适用。
例:在潜水员自身携带的水下呼吸器中充有氧气和氦气混合 气。现将25℃ 0.10MPa的12L He和0.10MPa的46LO2充入体 积为5.0 L的贮罐中。计算在25℃在该罐中两种气体的分压和 混合气体的总压。
3.1.2 液体
1、基本特征:流动性 2、蒸汽压
➢ 敞口容器中,液体会无限制蒸发成蒸汽,直至完全蒸发 ➢ 密闭容器中,液体蒸发有限 饱和蒸汽压:当液体的蒸发速率与蒸汽的凝聚速率相同时,蒸气压达到
平衡。 蒸气压表示液体分子向外逸出的趋势,其大小取决于液体的本性,与
液体的量无关。
3、沸点 沸点:气化先在液体表面发生,温度越高,蒸气压越大。当温度增加到
量方程式的书写有 辨别:3H2+N2=2NH3与1.5H2+0.5N2=0.5NH3,当反应进关度。ζ=1mol时的物
理意义
3.2.2 能量守恒与转化
▪ 系统:所需研究的对象 ▪ 环境:系统之外而与体系有关的部分 ▪ 系统的分类:
➢ 敞开系统:在系统与环境之间既有物质交换,又有能量交换。 ➢ 封闭系统:在系统与环境之间没有物质交换,只有能量交换。 ➢ 孤立系统:在系统与环境之间既没有物质交换,也没有能量交换。 状态函数:确定系统状态的函数,温度、压力、体积、质量、密度、
蒸气压等于外界压力时,气体在液面及液体内部同时发生,内部液体 的气化产生大量气泡上升到液面破裂,即沸腾,此刻的温度即沸点。 液体在一定外压下有固定的沸点,增大外压,沸点上升。
3.1.3 固体
1、基本特征:一定体积、一定形状 2、分类: ➢ 晶体:粒子按一定规则排列,各向异性,有一定沸点 ➢ 无定形体:内部粒子无规则排列,没有固定熔点,各向同
大学物理热学第十三章 热力学基础 PPT

Mayer公式
•摩尔热容比
CP,m i 2
CV ,m i
泊松比
CV ,m
i 2
R
Cp,m
CV ,m
R
i
2 2
R
单原子分子理想气体 i 3 1.67
双原子分子理想气体 i 5 1.40
多原子分子理想气体 i 6 1.33
pV m RT RT
M
Q CV ,m (T2 T1)
•过程曲线: p b T2
0
a T1 V
吸收得热量全部用来内能增加;或向外界放热以内能减小为代 价;系统对外不作功。
3、理想气体定体摩尔热容 CV ,m
•定义:1mol、等体过程升高1度所需得热量
•等体过程吸热 QV CV ,m (T2 T1)
•等体过程内能得增量
E
QV
i 2
R
T2
T1 CV ,m T2
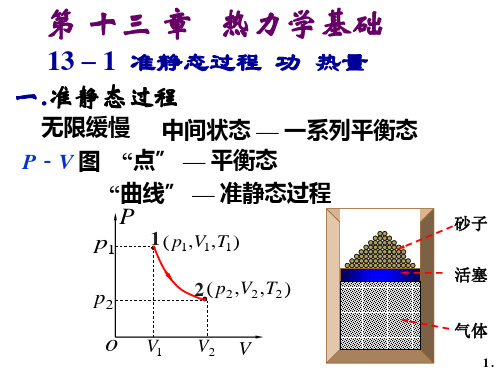
13-1 准静态过程 功 热量
一、准静态过程
可用P-V 图上得一条有
方向得曲线表示。
二、功
准静态过程系统对外界做功:
元功: dW Fdl pSdl pdV
dl
系统体积由V1变 为V2,系统对外 界作总功为:
V2
W= pdV
V1
p F S pe
光滑
注意:
V2
W= pdV
V1
1、V ,W>0 ;V ,W<0或外界对系统作功 ,V不变时W=0
V2 PdV
V1
i CV ,m 2 R
CP,m
CV ,m
CP,m CV ,m R
等容 等压
WV 0
QV CV ,m (T2 T1) E
QP Cp,m (T2 T1) CV ,m (T2 T1) P(V2 V1) WP P(V2 V1) R(T2 T1)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
2
1
p (pA,VA,TA) 2
2. 准静态过程 状态变化过程进行得非常缓慢,以
至于过程中的每一个中间状态都近似 于平衡态。
——平衡过程——理想过程!
准静态过程的过程曲线可以用p-V 图来描述,图上的每一点分别表示系 统的一个平衡态。
dl
dWpS dl pdV
W V2 pdV V1
p-V图 p (pA,VA,TA)
结论:系统所做的功在数热值力上学等基于础p-V 图上过程曲线以下的面积。 热力学系统作功的本质:
无规则的分子热运动与有规则的机 械运动之间的能量转化。
功是过程量 系统对外作功 :W0
外界对系统作功 :W0
(pB,VB,TB)
1mol理想气体在压强不变的状态 下,温度升高一度所需要吸收的热量。
Cp
1
dQ dT
p
c 1 dQ m dT
单位: JK1kg1
(3)Cv,和Cp,的关系
实验证明: Cp CV R
3、摩尔热容(Molar specific heat):
1摩尔物质的热容量。
C
1
dQ dT
i 表示不同的过程
令 Cp CV
EEk(T)
m M
i 2
RT
T
(3)分子内部、原子内部运动的能量;
——是温度的单值函数
(4)电场能、磁场能等。
T 不太高时,系统状态变化主要由:
热运动的能量
E m i RT
M2
(
分子间势能的变化
内能变化E只与初末状态有关,
与所经过的过程无关,可以在初、 所引起,其它形式的运动能量不改变。 末态间任选最简便的过程进行计算。
3. 作功与热传递[heat transfer]的区别:
热传递是通过分子间碰撞完成的,即通过微观粒子相互 作用将分子无规则热运动能量自一物体转移到另一物 体;
10.06.2020
P.6/42
作功是通过物体的宏观位移,将物体有规则的 机械能转化为系统分子无规则热运动能量,从
而改变 E ;
热力学基础
例题8-1: 一定量的气体吸收热量,体积膨胀并对外做功,则此过程的末 态与初态相比, ( D )
A.气体内能一定增加 B.气体内能一定减小 C.气体内能一定不变 D.气体内能是增是减不能确定
例题8-2:一定质量的理想气体,从某一状态开始,经过一系列变化后又
另一叙述: 第一类永动机 是不可能制成的。
Q :表示系统吸收的热量, W: 表示系统所作的功,
第一类永动机:Q = 0,A > 0的机器;
E: 表示系统内能的增量。
符号规定
Q
EE2E1 W
+ 系统吸热 内能增加 系统对外界做功
系统放热 内能减少 外界对系统做功
10.06.2020
P.9/42
热力学基础
(pB,VB,TB)
O
V 在整个过程中,系统一直处于非平 衡态,直至过程结束才达到平衡态, 这样的过程称为非静态过程
非平衡态则不能用一组确定的状态 参量来表示,所以也无法在状态图 上表示出来.
10.06.2020
P.2/42
8.1.2 准静态过程压力的功 热力学系统作功的装置——活塞
F dV
S p,V
O V1
dV
V2 V
10.06.2020
P.3/42
例-1. 摩尔理想气体从状态1
状态2,设经历等温过程。 求气体对外所作的功是多少? 【解】
3
8.1.3 热量
热力学基础
系统之间由于热相互作用而传递的能量。
(1798年,美国物理学家本杰明.汤姆逊,
即伦福德伯爵在德国进行炮膛钻空实验时
提出此概念;1799年,戴维H. Davy,法
拉第的老师,做真空中的摩擦实验,以证 明热是物体微粒的振动所致。)
热量传递的本质:无规则的分子热运动 之间的能量转化。热量是过程量
系统吸热 :Q0
V 2
W PdV
V2
RT / V dV
系统放热 :Q0
(1)传热的条件:系统和外界存在温度差 (2)传热既与系统和外界的状态有关,
V1
V1
还与系统所经历的具体过程有关
一般气体系统内能:
做功
EEk(T)Ep(V)E(T,V)
内能变化方式 热传递
——气体内能是系统状态的单值函数
10.06.2020
改变系统状态
P.5/42
8.1.5 热功等效性(1850年提出)
热力学基础
1. 作功和热量传递具有相同的效果 1 卡 = 4.186 J ( 1878年焦耳贡献 )
2. 热-功转换是不能直接进行的,必须通过内能来转换, 内能是中介;
10.06.2020
Fire syringe
P.7/42
8.1.6 热容量
热力学基础
1、热容量(thermal capacity):
CV
1
dQ dT
V
物体温度升高一度所需要吸收的热量。 (2)定压摩尔热容:
C dQ dT
单位: J K1
2、比热(specific heat):
单位质量物质的热容量。
(First law of the来自modynamics)热力学第一定律适用于任何系统(气液 固)的任何过程(非准静态过程也适用),
本质:包括热现象在内的能量守
QEPdV
恒和转换定律。
Q = 0 系统不吸热
若 E = 0 系统内能不变
E2 E1 W Q(E2E1)W
Q
dQdEdW
A > 0 系统对外界作正功
CV
i 2
R
——迈耶公式
摩尔热容比 (绝热系数)
Cp
i
2 2
R
(1)定体摩尔热容:
单原子 i=3
1mol理想气体在体积不变的状态下,
i为自由度数: 双原子 i=5
温度升高一度所需要吸收的热量。
多原子 i=6
10.06.2020
P.8/42
§8.2 热力学第一定律
热力学基础
§8.2.1 热力学第一定律
RT ln V 2/V 1
体积功的几何意义是什么?
热量的单位:国际单位:焦耳(J)
工程单位:卡 焦耳当量: 1卡 = 4.186 焦耳
10.06.2020
P.4/42
8.1.4 系统内能 ——热力学系统的能量E
热力学基础
对理想气体的内能:
内能包含系统内: (1)分子热运动的能量; (2)分子间势能和分子内的势能;
§8.1 准静态过程 功 热量 §8.2 热力学第一定律 §8.3 热力学第一定律对理想气体等值过程的应用 §8.4 理想气体的绝热过程 §8.5 循环过程和卡诺循环 §8.6 热力学第二定律 卡诺定理 §8.9 热力学第二定律的统计意义
热源 QV
§8.1 准静态过程 功 热量
热力学基础
8.1.1 准静态过程
