热力学各章总结
化工热力学复习总结

第2章流体的P-V-T 关系1.掌握状态方程式和用三参数对应态原理计算PVT 性质的方法。
2.了解偏心因子的概念,掌握有关图表及计算方法。
1. 状态方程:在题意要求时使用该法。
① 范德华方程:常用于公式证明和推导中。
② R —K 方程: ③ 维里方程:2. 普遍化法:使用条件:在不清楚用何种状态方程的情况下使用。
三参数法:① 普遍化压缩因子法② 普遍化第二维里系数法3、Redlich-Kwong (RK )方程3、Soave (SRK )方程4、Peng-Robinson (PR )方程()22a 0.45724c r cR T T P α=0.0778c cRT b P =§2-5高次型状态方程5、virial 方程 virial 方程分为密度型:和压力型:第3章 纯物质的热力学性质1、热力学性质间的关系dU TdS pdV =-H=U+PV d H T d S V d =+A=U-TS d A S d Tp d V =--G=H-TS d G S d TV d p =-+ Maxwell 关系式S V T P V S ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ S P T V P S ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ V T P S T V ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ P TV S T P ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ 转换公式: 1Z X YX Y Z Y Z X ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪⎪∂∂∂⎝⎭⎝⎭⎝⎭3.2计算H ∆和S ∆的方法1.状态方程法: P P V d H C d T V T d PT ⎡⎤∂⎛⎫=+- ⎪⎢⎥∂⎝⎭⎣⎦ P PC V d S d T d PT T ∂⎛⎫=- ⎪∂⎝⎭ 2.剩余性质法:①普遍化压缩因子图()()1R R RTC C C H H H RT RT RT ω=+ ()()1R R RTS S SRRRω=+②普遍化的第二维里系数方法0101R T r r r C r r H dB dB P B T B T RT dT dT ω⎡⎤⎛⎫=-+-⎢⎥ ⎪⎝⎭⎣⎦ 01R T r r r S dB dB P R dT dT ω⎛⎫=-+ ⎪⎝⎭0 1.60.4220.083r B T =-14.20.1720.139r B T =-导出:0 2.60.675r r dB dT T = 15.20.772r rdB dT T = 第6章 化工过程能量分析热力学第一定律一、功 Wp dVδ=-外不可逆过程: 2112W P dV =-⎰外体可逆过程: 21V rev V W p dV =-⎰体体规定:体系吸热为正,放热为负;对外做功为负,接受功为正。
工程热力学知识点总结

工程热力学大总结'…第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
)开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
}均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
:热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
热力学总结

2 P2
3
W PV P1V1 RT1 P1 1
吸热 ∶
V1
Q12
CV (T2
T1)
3 2
RT1
4 V2 V
Q23 C p (T3 T2 )
5 2
RT2
5RT1
Q1
Q12
Q23
3 2
RT1
5RT1
13 2
RT1
W Q1
2 15% 13
例 4 (书上P226例1)已知∶5mol H2 , P1=1atm, t1=200C, 将其在下列过程 中压缩到原体积的 1/10,
(1). 两条绝热线能否相交? (2) 绝热线和等温线能否
p
绝热线
有两个交点?
绝热线
等温线
O
V
问题13 19图
绝热线
等温线
例:用热力学第二定律证明:在pV 图上任意
两条绝热线不可能相交
证:反证法
p
设两绝热线相交于c 点, 在ab间作一条等温线, abca构成一循环过程。 在此循环过程该中
O
Qab W
(4) A→B→C→A循环过程的效率 ;
p /1.0 10 5 Pa
方法1,利用:
W Q1
A 2
1 C
W=WAB+WBC 0.77 103 J
总吸热Q1=QAB+QCA
B
Q1 7.77 103 J
O
1
2
W Q1
9.9%
V /(2.0 10 2 m 3 )(4)求效率方法2:
Q1 7.77 103 J , Q2 CP ,m TC TB 7.00103 J
例2:13-23题:0.32kg的氧气经过一个循环ABCDA,设 V2=2V1,T1=300K,T2=200K,其中A B,C D均为 等温过程, B C,D A均为等体过程,
热力学总结

1 2
δQ dU pdV 可逆:
开口系统:
Q H Wt
可逆: Q dh vdp
q h wt
Q H vdp
1 2
七、应用 (1)锅炉和换热器: q h
(2)汽轮机和燃气轮机 w t h h1 h 2 (3)泵、风机和压气机 w -w h h c t 2 1 (4)喷管等管道 1 2 1 2 h1 c f1 h 2 c f2 2 2
ux hx ps vx
2.水蒸气的热力性质表,h-s图 3.水蒸气的基本热力过程 定压过程
wt 0
q h2 h1
w p(v2 v1 )
绝热膨胀过程
q0
w u u1 u 2
w t h h1 h 2
定容过程
w0
q u u 2 u1
2 dv dp cp cV 1 v p
1
v2 p2 c p ln cV ln v1 p1
5.理想气体的基本热力过程
四个基本热力过程及可逆多变过程的初 终态参数、热量、过程功和熵变的计算
及其在p-v图和T-s图上的表示,
可逆多变过程的多变指数的求法。 表4-1 图4-7
二、水蒸气
2.比热容
定义: c
Q
dT
c与过程有关 c是温度的函数
1
Cm Mc 0.0224 c'
cp cV
cp cV Rg
cp
Rg
1 cV Rg 1
C pm CVm R
空气的绝热指数k=1.4 空气定压比热容Cp=1.004 KJ/(Kg.k)
工程热力学-第三、四章公式总结
pvk=c
pvn=c
初终态p、v、T的关系式
热力学能变化Δu
0
焓变化Δh
0
熵变化Δs
0
定容过程
定压过程
定温过程
定熵过程
多变过程
过程功
0
技术功
0
过程热量
q
0
过程比热容
∞
0
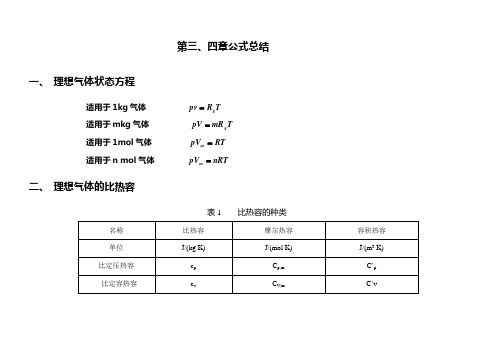
第三、四章公式总结
一、理想气体状态方程
适用于1kg气体
适用于mkg气体
适用于1mol气体
适用于n mol气体
二、理想气体的比热容
表1比热容的种类
名称
比热容
摩尔热容
容积热容
单位
J/(kg K)
J/(mol K)
J/(m3K)
比定压热容
cp
Cp,m
C’p
比定容热容
cv
CV,m
C’v
迈耶方程 或
;
真实比热容
平均比热容
定值比热容
三、理想气体的热力学能、焓、熵
表2理想气体的热力学能、焓、熵
类型
热力学能
焓
熵
微元变化
有限变化
(真实比热容)
有限容)
四、理想气体的热力过程
表3理想气体的各种热力过程
定容过程
定压过程
定温过程
定熵过程
多变过程
多变指数n
±∞
0
1
k
n
过程方程式
v=c
p=c
热力学公式总结

第一章气体的pVT关系主要公式及使用条件1.理想气体状态方程式pV (m/ M )RT nRT或pV p(V /n) RTm式中p,V,T 及n 单位分别为Pa,m3,K 及mol。
3,K 及mol。
V m V / n 称为气体的摩尔体3 积,其单位为m-1·mol 。
R=8.314510 J m·ol-1·K -1 ,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2.气体混合物(1)组成摩尔分数y B (或x B) = n B / nAA体积分数 B y V /m, BBy A V m,AA式中n为混合气体总的物质的量。
V m,A 表示在一定T,p 下纯气体 A 的摩AA尔体积。
y A V 为在一定T,p下混合之前各纯组分体积的总和。
m, A y A V 为在一定T,p下混合之前各纯组分体积的总和。
A(2)摩尔质量M m ix y M m/ n M / nB B B BB B B式中m m 为混合气体的总质量,B n n 为混合气体总的物质的量。
上BB B述各式适用于任意的气体混合物。
(3)y n / n p / p V /VB B B B式中p B 为气体B,在混合的T,V 条件下,单独存在时所产生的压力,称为 B的分压力。
VB为B 气体在混合气体的T,p 下,单独存在时所占的体积。
3.道尔顿定律p B = y B p,p pBB上式适用于任意气体。
对于理想气体p B n B RT/V4.阿马加分体积定律*/V n RT pB B此式只适用于理想气体。
第二章热力学第一定律主要公式及使用条件1.热力学第一定律的数学表示式U Q W或'd UδQδWδQ p d VδWa m b规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中p amb为环境的压力,W?为非体积功。
上式适用于封闭体系的一切过程。
2.焓的定义式H U pV3.焓变(1)H U(pV)式中(pV)为pV乘积的增量,只有在恒压下()()pV p V2V在数值上等于体1积功。
完整版工程热力学大总结大全

第一章基本概念1. 基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(u )或密度(p )、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。
新版工程热力学大总结_第五版-新版.pdf

可逆过程 :当系统进行正、反两个过程后,系统与外界均能完全回复到初始状态,这样的过程称为
可逆过程。
膨胀功 :由于系统容积发生变化(增大或缩小)而通过界面向外界传递的机械功称为膨胀功,也称
容积功。
热量 :通过热力系边界所传递的除功之外的能量。
热力循环 :工质从某一初态开始,经历一系列状态变化, 最后又回复到初始状态的全部过程称为热
1K( 1℃)所吸收或放出的热量,称为该物
体的定容比热。
定压比热 :在定压情况下,单位物量的物体,温度变化
1K( 1℃)所吸收或放出的热量,称为该物
体的定压比热。
定压质量比热 :在定压过程中,单位质量的物体,当其温度变化
1K (1℃)时,物体和外界交换的
5
热量,称为该物体的定压质量比热。
定压容积比热 :在定压过程中,单位容积的物体,当其温度变化
热力循环 :
qw
或 u 0 , du 0
循环热效率 : t w0 q1 q2 1 q2
q1
q1
q1
式中
q1—工质从热源吸热; q2—工质向冷源放热; w 0—循环所作的净功。
制冷系数 :
q2
q2
1
w0 q1 q2
式中
q1—工质向热源放出热量; q2—工质从冷源吸取热量;
w 0—循环所作的净功。
3
供热系数:
第一章 基 本 概 念
1.基本概念
热力系统 :用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,
称为热力系
统,简称系统。
边界 :分隔系统与外界的分界面,称为边界。
外界 :边界以外与系统相互作用的物体,称为外界或环境。
闭口系统 :没有物质穿过边界的系统称为闭口系统,也称控制质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章总结 1、热力学第一定律 1)实质:能量守恒,即能量总量是守恒的 2)计算 ⑴能量平衡 ①封闭系统 U Q W ②稳流系统(在不同条件下简化)
H 1 2 m u mg z Q W s
2
⑵可逆功的计算
W 体=
V2
P dV
W SR
V1
P2
3
24
P 0
P
0
V dP 恒温 V T T P
3 40
S
R
R V dP 恒温 T P P
3 41
EXIT
③计算真实气体任意两状态间的△H、△S
VdP
EXIT
P1
2、热力学第二定律
①实质:能量存在质的差别
②作用:进行过程的方向和限度判断
③热机效率
T
W 净功 Q 吸收 1 QL QH
卡诺热机效率 -----热功转换的最高限度
c 1
QL QH 1 TL TH
EXIT
3、熵增原理及熵产生
Q R
St 0
熵产生:系统内部不可逆性引起的熵变化
Whol型经验方程 基于无热溶液、局部组成概念的模型
0, H
E
0
G = H
E
S
E
0, H
E
0
G
E
-TS
E
Wilson eq
基团溶液模型
各结构基团的性质迭加。 UNIFAC eq
EXIT
第五章总结
1、掌握相律公式及应用
F=C-π+2
dT=0、dP=0
dG T , P
0
p
3
24
EXIT
⑴理想气体的H、S计算
dH
ig
C p dT
ig
H =
ig
T2
T1
C p dT
R P
Байду номын сангаас
ig
(3 - 32)
dS =
ig
Cp T
ig
dT
dP
S =
ig
T2
T1
C p d ln T - Rln
ig
p2 p1
( 3 34 )
EXIT
⑵真实气体 ①通式:
V dH C p T V T dP T P
3
22
②剩余性质 在相同的温度和压力下,理想气体的热力学性质与 真实气体的热力学性质的差值。(其中M代表U、H、S、 G等) R ig M M T , p M T , p 3 37
H
R
V dS dT dP T T P C
p
W id W s a=
s=
WS W SR
W id Ws
=
W SR WS
W id W id W L
EXIT
等熵效率 产功
耗功 s=
第七章总结 ⑴气体的压缩过程 气体压缩的种类 气体压缩功 获得较高压力的压缩方式
⑵气体的膨胀过程 节流膨胀(等焓) 等熵膨胀(可逆绝热对外做功) ①特点 ②微分效应系数 ③积分效应 ④两种膨胀的比较
y i P = ri x i Pi
K i yi / xi
S
P
12
k1 k2
ri x i P i
4、热力学一致性检验的方法--G-D方程应用
恒温、恒压时 = x d M 0
i i
5、了解低压下正偏差、负偏差类型的溶液与拉 乌尔定律的偏差情况(P-X图对照)。 6、共沸点处的特点。
Tj
S g= S 累积
EXIT
4、理想功、损耗功及热力学效率 理想功
W id H T 0 S
W L W s W id
定义
损耗功
W L T0 S Q T0 S t
热力学效率 产功 耗功
W id W s a= Ws W id = W id W L W id
dS 熵 ①熵定义 T 变 ②理想气体 S C ln T 2 R ln P2 计 p T1 P1 算 ③相变化
S
H V TV
④环境熵变 ⑤熵平衡式
S sur
Q sur T sur
Q sys T sur
m
i
i
S i 入
m
i
i
S i 出
Q j
第一章 复习 1、热力学的四个定律分别是什么?它们各 表述了什么内容?有何作用? 2、什么是状态函数?它有何特征?常见的 热力学参数中哪些是状态函数? 3、热与功是否是状态函数?它们的正负取 值的规定是什么? 4、热力学研究中常见的过程有哪几种?它 们各有什么特点? 5、化工热力学的研究方法主要有哪两种? 它们分别从什么角度来研究问题?
三个基本定义
H U PV A U TS G H TS
EXIT
3、计算H、S 基本关系式
V dH C p T V T dP T P
3
22
V dS dT dP T T P C
等P线 等H线 等S线(垂线) 等T线(水平线) VLE(两相区)
4′
节流膨胀过程 H 0 可逆绝热过程 S 0
两相区性质的计算
M xM
SV
(1 x ) M
SL
EXIT
第四章总结
1、掌握偏摩尔性质的定义与计算
( nM ) ni T
5、提高蒸气动力循环热效率有哪些方法?在朗肯 循环基础上进行改进的循环有哪些循环?它们分别 通过采取什么措施来提高热效率或扩大应用范围的? 6、画出单级蒸汽制冷循环原理图和T-S图,并分别 以过程中的每个设备及整套装置为系统进行热力分 析,写出能量方程并对各相应系统进行方程简化。 7、为达到获得较低的制冷温度,而能耗不增加的 目的可采用什么制冷循环?吸收式制冷有何特点? 热泵与制冷有什么区别? 8、林德循环与克劳特循环的特点和差异是什么?
(5-5)
2、掌握达到相平衡的条件及相平衡判据
5 - 1
i i i
(5 - 2)
fi
fi
fi
(5 - 3)
EXIT
3、掌握低压下VLE的计算(完全理想系和化学系)
汽液相平衡计算的理论基础式
fi
V
fi
L
5 5
S
M M
(x M
i
i
i
)
M i= M i M
Mi是在溶液的T,P下,纯组分i的摩尔性质 ⑶超额性质
M
E
M M
id
Mid是与溶液的T、P及组成相同的理想溶液的性质
EXIT
⑷混合超额变量
H = H
E E
M
E
M
E
H
U
E
U = U
E
V
E
V = V
E
G = G G
始态(真) T1、P1 ΔH=H2-H1 ΔS=S2-S1 终态(真) T2、P2 ⑶剩余性质
⑴剩余性质 中间态(理) T1、P1 ⑵理想气体
中间态(理) T2、P2
R ig
H H 1 H 2 H 3
H 1 H
H2
R
S S 1 S 2 S 3 S R S ig S R 1 2
E
id
G
E
G
S = S S
E
id
S
E
S
EXIT
4、活度系数模型
⑴理想溶液的模型
G
E
ˆ ai xi
0
G
E
ri 1
0
i
0
H
E
S
E
⑵非理想溶液的模型
正规溶液模型
S
E
RT
(x
lnr i )
( n G E /RT ) lnr i ni T , P ,n ji
P0
1
fi yi i P
c.混合物的逸度
dG RTd ln f m
lim fm P
P0
恒温
f m P
1
EXIT
3、掌握活度、活度系数的定义 ⑴ 理想溶液的定义和特性 ①凡符合L-R定则的溶液为理想溶液 L-R定则:理想溶液中组分的逸度与其摩尔分 数成正比。
fi
ln ˆi
ˆ ln a i
ln ri
M
i
EXIT
2、掌握逸度、逸度系数的定义
a. 纯组分的逸度
dG i RTd ln f i
lim
恒温
fi i P
fi P
P0
1
b.混合物中组分i的分逸度
d G i RTd ln f i
T , y i 一定
lim
fi yiP
EXIT
④剩余性质法解决真实气体的焓、熵计算 a.图解积分法 b.状态方程法 c.普遍化方法
普维法
H
R
RT
1 dB 0 dB Pr dT dT r r
B B T T r r
0 1
