2018年湖北黄冈中学自主招生化学试题
2018年湖北黄冈中学自主招生化学试题2(无答案)

黄冈中学自主招生化学试题2时间:40分钟分值:50分可能用到的相对原子质量:H :1,C :12,N :14,O :16,S :32,K :39,Ca :40,Fe :56 一、单项选择题(每小题2分,共8小题,共16分)1.以下是我们熟悉的几种气体,其中可用右图所示装置干燥并收集的是(省略了铁架台等仪器) :( ) ①H 2 ②O 2 ③CO 2 ④SO 2 ⑤CH 4 A .①② B .③④ C .①⑤ D .①②⑤2.某同学用含有杂质碳酸钠的烧碱样品与盐酸发生中和反应,那么与等质量等溶质质量分数的盐酸溶液恰好中和时,所用烧碱样品质量比用纯氢氧化钠的质量( ) A .偏高 B .偏低 C .不变 D .无法比较3.有A 、B 两种混合粉末,质量分别为m 1,m 2。
A 由CaCO 3和KHCO 3组成,B 由MgCO 3和NaHCO 3组成。
将A 、B 分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg 。
下列说法正确的是( ) (已知:KHCO 3+HCl=KCl+CO 2↑+H 2O NaHCO 3+HCl=NaCl + CO 2↑+ H 2O ) A .100m 1 = 84m 2 B .m 1 = m 2C .混合物B 中MgCO 3和NaHCO 3质量比可为任意比D .混合物A 中CaCO 3和KHCO 3质量比一定为1∶1 4.取一定量氧化铁与氧化铜的混合物,向其中加入50克、14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是( ) A.6.4克B.3.2克 C .1.6克 D .0.8克5.已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品。
下列有关说法正确的是( )A .第①步中除去粗盐中的SO 42﹣、Ca 2+、Mg 2+等杂质,加入的试剂顺序为:Na 2CO 3溶液、NaOH溶液、BaCl 2溶液,过滤后加盐酸B .第②步中加入的试剂为CaCl 2溶液C .第③步中发生分解反应D .在第④步中溴元素被还原6.把5.1g 镁和铝的合金加入到一定质量、一定质量分数的稀硫酸中,恰好完全反应,产生的0.5gH 2,向反应后的溶液中加入一定量的NaOH 溶液,恰好使上述溶液中的MgSO 4、Al 2(SO 4)3完全转化为沉淀,则同时生成的Na 2SO 4的质量为( )A .32.5gB .35.5gC .40.5gD .45.5g7.为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如下图所示的实验。
湖北省黄冈中学化学自主招生试卷
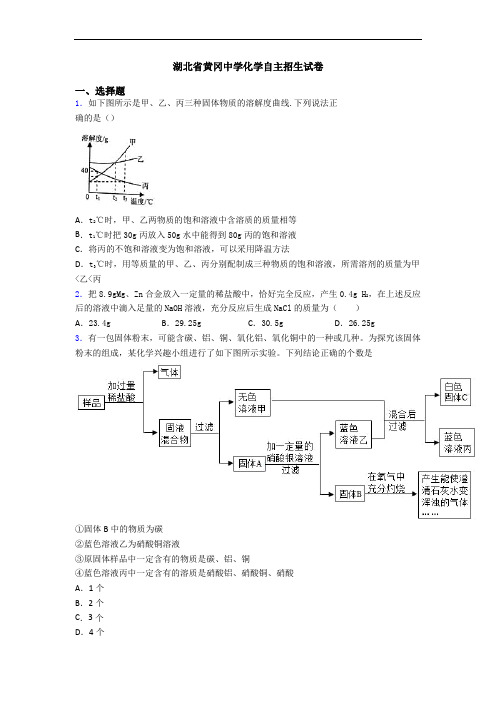
湖北省黄冈中学化学自主招生试卷一、选择题1.如下图所示是甲、乙、丙三种固体物质的溶解度曲线.下列说法正确的是()A.t2℃时,甲、乙两物质的饱和溶液中含溶质的质量相等B.t1℃时把30g丙放入50g水中能得到80g丙的饱和溶液C.将丙的不饱和溶液变为饱和溶液,可以采用降温方法D.t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙2.把8.9gMg、Zn合金放入一定量的稀盐酸中,恰好完全反应,产生0.4g H2,在上述反应后的溶液中滴入足量的NaOH溶液,充分反应后生成NaCl的质量为()A.23.4g B.29.25g C.30.5g D.26.25g3.有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。
为探究该固体粉末的组成,某化学兴趣小组进行了如下图所示实验。
下列结论正确的个数是①固体B中的物质为碳②蓝色溶液乙为硝酸铜溶液③原固体样品中一定含有的物质是碳、铝、铜④蓝色溶液丙中一定含有的溶质是硝酸铝、硝酸铜、硝酸A.1个B.2个C.3个D.4个4.如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种.图中相连的两圆表示相应物质能发生反应,已知乙是铁.下列说法错误的是A.五种物质中,只有铁是单质B.丙是盐酸C.戊是氢氧化钙D.甲与丁反应属于复分解反应5.除去下列各组物质括号内的杂质,所选用的试剂及操作方法均正确的是A.Fe2O3(Fe)——用盐酸浸泡,然后过滤、洗涤、烘干B.CO(CO2)——先通入足量的浓NaOH溶液,后通过浓硫酸C.CaO(CaCO3)——加水溶解,过滤、烘干D.NaCl(Na2CO3)——加入过量CaCl2溶液,过滤、蒸发、结晶6.用数形结合的方法表示某些化学知识直观、简明、易记.下列用数轴表示正确的是()A.不同物质的着火点:B.硫及其化合物与化合价的关系:C.50g19.6%的稀硫酸与足量的金属反应产生氢气的质量:D.物质形成溶液的pH:7.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。
2016—2018年湖北省黄冈中学自主招生化学汇编:工业流程(含详细解析)

2016_2018湖北省黄冈中学自主招生化学汇编:工业流程(含详细解析)一.填空题(共4小题)1.(2018•黄州区校级自主招生)为防止大气污染,工业上产生的硫化氢(H2S)要经过处理,使其变成硫单质.富玛克斯法治理硫化氢的方法和步骤如下:①用2%~3%的Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为NaHS;②再加入一种RNO(液)(R表示一种有机基团)与生成的这种酸式盐的水溶液反应生成硫、碱和RNHOH;③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;④RNHOH与空气中的氧发生反应又得到RNO.(1)写出上述四步反应的化学方程式.①H2S+Na2CO3=NaHCO3+NaHS;②NaHS+RNO+H2O=S↓+NaOH+RNHOH;③NaOH+NaHCO3=Na2CO3+H2O;④2RNHOH+O2=2RNO+2H2O.(2)富玛克斯法的总反应的化学方程式为:2H2S+O22S↓+2H2O,RNO在整个过程中起到催化的作用.【解答】解:(1)根据信息Na2CO3和H2S反应两种酸式盐,其中一种是NaHS,则另一种为NaHCO3,化学方程式为H2S+Na2CO3=NaHCO3+NaHS;(2)由信息可知该反应的反应物为NaHS和RNO和H2O,生成物为S和NaOH和RNHOH,化学方程式为NaHS+RNO+H2O=S↓+NaOH+RNHOH;(3)第三步反应的反应物为NaOH和NaHCO3;生成物为Na2CO3和H2O化学方程式为NaOH+Na HCO3=Na2CO3+H2O;(4)RNHOH与空气中的氧发生反应又得到RNO,反应物为RNHOH和O2,生成物为RNO和H2O,化学方程式为2RNHOH+O2=2RNO+2H2O(5)由以上四个化学方程式叠加,左右两边相同的删除,可得出总反应式为2H2S+O2=2S↓+2H2O,RNO在整个过程中起到催化作用.故答案为:(1)H2S+Na2CO3=NaHCO3+NaHS;(2)NaHS+RNO+H2O=S↓+NaOH+RNHOH;(3)NaOH+NaHCO3=Na2CO3+H2O;(4)2RNHOH+O2=2RNO+2H2O;(5)2H2S+O22S↓+2H2O;催化2.(2014•黄冈)以氯化钾和硫酸亚铁为原料生产硫酸钾和氧化铁(铁红颜料),其主要流程如下,请认真观察工艺流程,回答下列问题:(1)铁红的化学式是Fe2O3;(2)FeSO4与NH4HCO3反应生成FeCO3、(NH4)2SO4、H2O和CO2,其反应的化学方程式是FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑;(3)硫酸酸化是为了除去过量的NH4HCO3,反应后逸出的气体是二氧化碳;(4)沉淀池Ⅱ中溶质有KCl、K2SO4、H2SO4,还含有(NH4)2SO4.【解答】解:(1)铁红是氧化铁,氧化铁中铁元素的化合价为+3,氧元素的化合价为﹣2,化学式为:Fe2O3;(2)FeSO4与NH4HCO3反应生成FeCO3、(NH4)2SO4、H2O和CO2,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3+(NH4)2SO4+H2O+CO2↑;(3)加入酸,酸化的目的是除去溶液中的HCO3﹣,硫酸和NH4HCO3反应生成二氧化碳,故反应后逸出的气体是二氧化碳;(4)由(2)(3)可知沉淀池Ⅱ中溶质有KCl、K2SO4、H2SO4,还含有生成的(NH4)2SO 4.答案:(1)Fe 2O 3;(2)FeSO 4+2NH 4HCO 3=FeCO 3↓+(NH 4)2SO 4+H 2O+CO 2↑;(3)二氧化碳;(4)(NH 4)2SO 4.3.(2016•黄州区校级自主招生)硅单质及其合物应用范围很广.请回答下列问题:(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl 3)还原法是当前制备高纯硅的主要方法.生产过程示意图如图:①写出由纯SiHCl 3,制备高纯硅的化学反应方程式 SiHCl 3+H 2高温 Si+3HCl .②整个制备过程必须严格控制无水无氧.SiHCl 3遇水剧烈反应生成H 2SiO 3,HCl 和另一种物质,写出配平的化学反应方程式 SiHCl 3+3H 2O ═H 2SiO 3↓+H 2↑+3HCl ;H 2还原SiHCl 3过程过程中若混入O 2,可能引起的后果是 爆炸 .(2)石英砂的主要成分是二氧化硅,高纯度的二氧化硅可用于制造高性能通讯材料﹣光导纤维.二氧化硅和二氧化碳一样,也能与氢氧化钠溶液生成硅酸钠9其水溶液称水玻璃和水.请写出二氧化硅与氢氧化钠溶液的化学方程式 2NaOH+SiO 2=Na 2SiO 3+H 2O .【解答】解:(1)①SiHCl 3,能与氢气高温反应生成硅和氯化氢气体,故填:SiHCl 3+H 2高温 Si+3HCl ;②SiHCl 3与水反应生成H 2SiO 3,HCl 和氢气,H 2还原SiHCl 3过程过程中若混入O 2,可能引起爆炸,故填:SiHCl 3+3H 2O ═H 2SiO 3↓+H 2↑+3HCl ,爆炸;(2)氢氧化钠能与二氧化硅反应生成硅酸钠和水,故填:2NaOH+SiO 2=Na 2SiO 3+H 2O .4.(2016•黄冈校级自主招生)肼(N 2H 4)是氮和氢形成的一种化合物,易溶于水.工业上利用尿素法生产肼,同时得到出副产品十水合碳酸钠,其工艺流程如下:制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH═N2H4+Na2CO3+NaCl+H2O.(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有BD(填编号).A.漏斗B.烧杯C.烧瓶D.量筒(2)已知:Cl2+H2O═HCl+HClO,请推测Cl2与NaOH溶液发生反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:160.(3)在实验室中,欲从母液中分离出十水合碳酸钠晶体.可采用的操作依次为BED (填编号).A.蒸馏B.蒸发C.灼烧D.过滤E.冷却结晶(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等.请写出肼除氧时发生反应的化学方程式:N2H4+O2=N2+2H2O.【解答】解:(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择:BD;(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160;(3)碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法,所以先将溶液加热蒸发,再降温,使晶体析出,再进行过滤,所以步骤为:BED;(4)肼除氧的反应物是肼和氧气,因为氧化产物无污染所以是氢和氧结合成的水,根据质量守恒定律可知生成物还有氮气,再根据观察法配平,所以化学方程式是:N2H4+O2=N 2+2H 2O .故答案为:(1)BD ;(2)Cl 2+2NaOH =NaCl+NaClO+H 2O ,160;(3)BED ;(4)N 2H 4+O 2=N 2+2H 2O .二.解答题(共9小题)5.(2017•黄州区校级自主招生)醋酸钙[Ca (Ac )2]是国家允许使用的补钙制剂之一。
2018年湖北省黄冈市试中考理综化学真题及参考解析

湖北省黄冈市二○一八年初中学业考试暨高中阶段统一招生考试理综(化学部分)试题注意事项:1.答题前,考生务必先核对条形码上的姓名、准考证号和座号,然后用0.5毫米黑色墨水签字笔将本人的姓名、准考证号和座号填写在答题卡相应位置。
2.答第Ⅰ卷时,必须使用2B铅笔填涂答题卡上相应题目的答案标号,如需改动,必须先用橡皮擦干净,再改涂其它答案。
3.答第Ⅱ卷时,必须使用0.5毫米黑色墨水签字笔在答题卡上书写。
务必在题号所指示的答题区域内作答。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 C1-35.5 Ca-40五、选择题(每小题只有一个选项符合题意。
每小题2分,共16分)18、下列四个事例中一定发生了化学变化的是①玻璃片上出现水珠②大理石投入到稀盐酸中③自制汽水④品红在水中扩散A.①②B.②③C.③④D.①④19、下列实验操作错误的是A.滴加液体B.点燃酒精灯C.称量反应物质量D.稀释浓硫酸20、下列说法:①二氧化硫和臭氧都是空气污染物;②洁净的空气和水都是纯净物;③因为水体有自净能力,所以生活污水可任意排放;④降低可燃物的着火点是灭火的途径之一;⑤烧碱和熟石灰的溶液都显碱性;⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。
其中正确的是A.①⑤⑦B.①②④⑥C.④⑤⑦D.①②⑤⑥21、小雨同学依据描述书写的化学符号:①3个锌原子;3Z N;②两个氢分子:2H2;③两个氢氧根离子:2OH-;④原子结构示意图对应的粒子:Mg2+;⑤氯化亚铁的化学式:FeCl2;⑥-2价的氧元素:O2-。
其中正确的有A.②③⑤B.①⑤⑥C.②③④D.①③⑤22、一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,不正确的是A.x的值等于0.5B.甲一定是化合物C.丙和丁的质量变化比为8:1D.该反应是化合反应23、金属钨(W)可做白炽灯泡的灯丝。
湖北省黄石二中自主招生考试试题2018年素质考核化学试卷和答案(word版)

湖北省黄石二中自主招生考试试题2018年素质考核化学试卷和答案(word版)2018 年化学试卷可能用到的相对原子质量:H:1 C:12 O:16 Na:23 P:31 S:32 K:39 Ti:48 一、选择题(本题共5 小题,每小题8 分,共40 分。
每小题只有一个选项符合题目要求。
)1.中国科技大学钱逸泰教授以CCl4和金属钠为原料,700℃时制造出纳米级金刚石粉末,该成果发表在世界权威的《科学》杂志上,立即被科学家评价为“稻草变黄金”。
同学们对此的一些“理解”,不正确的是()A.CCl4是一种化合物B.制造过程中元素种类没有变化C.金刚石属于金属单质D.这个反应是置换反应2.工业上用海水晒盐,使食盐晶体析出。
这样制得的食盐含有较多的杂质,叫做粗盐。
要除去粗盐中含有的可溶性杂质CaCl2、MgCl2及Na2SO4,加入的化学试①HCl②NaOH③Na2CO3④BaCl2先后顺序正确的是()A.①②④③B.④②①③C.②①③④D.④②③①3.为完全中和某一强酸溶液,需用10 克溶质的质量分数为4%的NaOH 溶液。
如果改用10 克溶质的质量分数为4%的KOH 溶液,反应后,溶液的pH()A.大于7 B.小于7 C.等于7 D.无法判断4.现有10.6g 碳酸钠和8.4g 碳酸氢钠,分别与过量的盐酸反应,其中()A.碳酸钠消耗的氯化氢多B.碳酸钠生成的二氧化碳多C.碳酸氢钠消耗的氯化氢多D.碳酸氢钠生成的二氧化碳多5.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。
现有142g 温度为T2 K 的饱和硫酸钠溶液,当温度降为T1 K 或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K 时Na2SO4的溶解度为( )。
A.30g B.32.8g C.40g D.40.8g二、填空题(本题包括 6、7、8、9、10 五道题,共 60 分)6.(12分)I.右图中 A、B、C、D、E 是初中化学常见的五种不同类别的物质。
2018年湖北黄冈中学自主招生化学试题1(无答案)

黄冈中学自主招生化学试题1 时间:40分钟分值:50分可能用到的相对原子质量:H:1,C:12,N:14,O:16,S:32,K:39,Ca:40,Fe:56一、单项选择题(每小题2分,共8小题,共16分)1.下列四套装置中,在注入酸起反应后对气球的变化情况作出正确分析的是()A.气球①不胀大,②-④都能迅速胀大B.气球②逐渐胀大,气球④迅速胀大C.气球②逐渐胀大,气球③缓缓膨胀后停止,气球④迅速胀大D.以上都不正确2.有一部分潮解和变质的苛性钠样品W g,为验证其变质的程度,将其加入98g质量分数为20%的稀H2SO4中,充分反应后,再加入20g 20%的NaOH液恰好呈中性,则把溶液蒸干,可得固体的质量为( )。
A.19.6g B.14.2g C.28.4g D.30.4g3.将CO2通入滴有酚酞的BaCl2、NaOH混合溶液中,出现白色沉淀.下列说法错误的是()A.溶液的红色逐渐变浅或变为无色B.产生白色沉淀的化学方程式为:BaCl2+CO2+H2O=BaCO3+2HCl C.反应后的溶液中一定有NaCl D.反应过程中,溶液里的BaCl2、NaOH的质量分数均减小4.工业用CaO和硝酸反应制Ca(NO3)2·4H2O晶体,为确保制备过程既不补充水分,又无水剩余,则应选用的硝酸质量分数()A.30% B.63% C.70% D.84%5.右图是某燃煤发电厂处理废气的装置示意图,下列说法不正确的是()A.进入烟囱的气体为混合物B.此过程中硫元素的化合价没有发生改变C.使用此废气处理装置可减少酸雨的形成D.整个过程的反应可表示为2SO2+2CaCO3+O2 = 2CaSO4+2CO26.表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。
下列反应均能发生,其中不符合该规律的是()7.向t℃时饱和的Na2CO3溶液中加入n g无水Na2CO3,会析出m g Na2CO3·10H2O,则(m-n)的值为( ) A.饱和溶液失去水的质量B.饱和溶液失去溶质的质量C.饱和溶液失去水和溶质的质量之和D.其数值为0,即溶液质量不变8.将一定量铝粉和氧化铜混合加热,反应的化学方程式为:3Cu O +2Al高温3Cu+A12O3。
湖北黄冈中学自主招生化学试题1(无答案)
黄冈中学自主招生化学试题1时间:40分钟分值:50分可能用到的相对原子质量:H:1,C:12,N:14,O:16,S:32,K:39,Ca:40,Fe:56一、单项选择题(每小题2分,共8小题,共16分)1.下列四套装置中,在注入酸起反应后对气球的变化情况作出正确分析的是()A.气球①不胀大,①-①都能迅速胀大B.气球①逐渐胀大,气球①迅速胀大C.气球①逐渐胀大,气球①缓缓膨胀后停止,气球①迅速胀大D.以上都不正确2.有一部分潮解和变质的苛性钠样品W g,为验证其变质的程度,将其加入98g质量分数为20%的稀H2SO4中,充分反应后,再加入20g 20%的NaOH 液恰好呈中性,则把溶液蒸干,可得固体的质量为( )。
A.19.6g B.14.2g C.28.4g D.30.4g3.将CO2通入滴有酚酞的BaCl2、NaOH混合溶液中,出现白色沉淀.下列说法错误的是()A.溶液的红色逐渐变浅或变为无色B.产生白色沉淀的化学方程式为:BaCl2+CO2+H2O=BaCO3+2HCl C.反应后的溶液中一定有NaCl D.反应过程中,溶液里的BaCl2、NaOH 的质量分数均减小4.工业用CaO和硝酸反应制Ca(NO3)2·4H2O晶体,为确保制备过程既不补充水分,又无水剩余,则应选用的硝酸质量分数()A.30% B.63% C.70%D.84%5.右图是某燃煤发电厂处理废气的装置示意图,下列说法不正确的是()A.进入烟囱的气体为混合物B.此过程中硫元素的化合价没有发生改变C.使用此废气处理装置可减少酸雨的形成D.整个过程的反应可表示为2SO2+2CaCO3+O2 = 2CaSO4+2CO26.表中pH 大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。
下列反应均能发生,其中不符合该规律的是()7.向t①时饱和的Na2CO3溶液中加入n g无水Na2CO3,会析出m g Na2CO3·10H2O,则(m-n)的值为( )A.饱和溶液失去水的质量B.饱和溶液失去溶质的质量C.饱和溶液失去水和溶质的质量之和D.其数值为0,即溶液质量不变8.将一定量铝粉和氧化铜混合加热,反应的化学方程式为:3CuO + 2Al高温3Cu+A12O3。
湖北省黄石二中自主招生考试试题2018年素质考核化学试卷和答案(word版)
湖北省黄石二中自主招生考试试题2018年素质考核化学试卷和答案(word版)2018 年化学试卷可能用到的相对原子质量:H:1 C:12 O:16 Na:23 P:31 S:32 K:39 Ti:48 一、选择题(本题共5 小题,每小题8 分,共40 分。
每小题只有一个选项符合题目要求。
)1.中国科技大学钱逸泰教授以CCl4和金属钠为原料,700℃时制造出纳米级金刚石粉末,该成果发表在世界权威的《科学》杂志上,立即被科学家评价为“稻草变黄金”。
同学们对此的一些“理解”,不正确的是()A.CCl4是一种化合物B.制造过程中元素种类没有变化C.金刚石属于金属单质D.这个反应是置换反应2.工业上用海水晒盐,使食盐晶体析出。
这样制得的食盐含有较多的杂质,叫做粗盐。
要除去粗盐中含有的可溶性杂质CaCl2、MgCl2及Na2SO4,加入的化学试①HCl②NaOH③Na2CO3④BaCl2先后顺序正确的是()A.①②④③B.④②①③C.②①③④D.④②③①3.为完全中和某一强酸溶液,需用10 克溶质的质量分数为4%的NaOH 溶液。
如果改用10 克溶质的质量分数为4%的KOH 溶液,反应后,溶液的pH()A.大于7 B.小于7 C.等于7 D.无法判断4.现有10.6g 碳酸钠和8.4g 碳酸氢钠,分别与过量的盐酸反应,其中()A.碳酸钠消耗的氯化氢多B.碳酸钠生成的二氧化碳多C.碳酸氢钠消耗的氯化氢多D.碳酸氢钠生成的二氧化碳多5.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。
现有142g 温度为T2 K 的饱和硫酸钠溶液,当温度降为T1 K 或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K 时Na2SO4的溶解度为( )。
A.30g B.32.8g C.40g D.40.8g二、填空题(本题包括 6、7、8、9、10 五道题,共 60 分)6.(12分)I.右图中 A、B、C、D、E 是初中化学常见的五种不同类别的物质。
黄冈中学自主招生化学汇编:实验题(含详细解析).doc
黄冈中学自主招生化学汇编:实验题(含详
细解析)
一.解答题(共11小题)
1.(2018•黄州区校级自主招生)在焊接两根铁轨时,为确保施工质量,工程技术人员常用到一种叫做“引火铁”的反应活性材料.实验室的制备过程如下:
(1)在高温条件下用普通铁粉和水蒸气反应,得到粉末状的四氧化三铁;
(2)将四氧化三铁粉末在高温条件下经过与上述过程相反的反应生成“引火铁”粉末.请分别用以下两套装置,制取四氧化三铁和“引火铁”.实验中必须使用普通铁粉和稀硫酸,其他试剂和用品自选.(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
2018年湖北省黄冈中学自主招生化学模拟试卷(含答案解析)
2018年湖北省黄冈中学自主招生化学模拟试卷(1)一、单选题(本大题共8小题,共16.0分)1.下列对a、b、c、d四套装置中,在注入酸起反应后对气球的变化情况作出正确分析的是()A. 气球①不胀大,②−④都能迅速胀大B. 气球②逐渐胀大,气球④迅速胀大C. 气球②逐渐胀大,气球③缓缓膨胀后停止,气球④迅速胀大D. 以上都不正确【答案】C【解析】解:A、气球①不胀大,②−④都能迅速胀大,故A说法错误;B、气球②逐渐胀大,气球④迅速胀大,说法不全面,故B说法不符合题意;C、气球②逐渐胀大,气球③缓缓膨胀后停止,气球④迅速胀大,故C说法正确;D、以上都不正确,故D说法错误;故选:C。
根据a装置中酸碱分数中和反应,气球无变化;b装置中大理石与稀盐酸反应生成二氧化碳,气球逐渐胀大;c装置中稀硫酸与块状大理石反应生成微溶于水的硫酸钙,会覆盖在大理石表面,是反应难以继续进行;因此气球③缓缓膨胀后停止;d装置中稀硫酸与碳酸钠迅速反应生成二氧化碳,因此气球④迅速胀大;进行解答本题.本题考查学生对实验室制取二氧化碳的反应原理的理解与掌握,并能在解题中灵活应用的能力.2.有一部分潮解和变质的苛性钠样品W g,为验证其变质的程度,将其加入98g质量分数为20%的稀H2SO4中,充分反应后,再加入20g 20%的NaOH液恰好呈中性,则把溶液蒸干,可得固体的质量为( )A. 19.6gB. 14.2gC. 28.4gD. 30.4g【答案】C【解析】解:设蒸发后所得得到的晶体的质量为x2NaOH+H2SO4=Na2SO4+H2O98 14298g×20% x98 142= 98g×20% x解得,x=28.4g故选C。
NaOH与稀硫酸反应生成硫酸钠和水,蒸发所得的溶液,得到的晶体是硫酸钠,其质量可根据化学反方程式求得.解答本题的关键是要知道最后得到的固体是硫酸钠,所以只要根据硫酸的质量可直接求得硫酸钠的质量.3.将CO2通入滴有酚酞的BaCl2、NaOH混合溶液中,出现白色沉淀.下列说法错误的是()A. 溶液的红色逐渐变浅或变为无色B. 产生白色沉淀的化学方程式为:BaCl2+CO2+H2O=BaCO3+2HClC. 反应后的溶液中一定有NaClD. 反应过程中,溶液里的BaCl2、NaOH的质量分数均减小【答案】B【解析】解:A、因为氢氧化钠属于碱,能使酚酞变红,通入二氧化碳后,二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡反应生成碳酸钡沉淀和氯化钠,所以碱性会减弱或消失,所以溶液的红色逐渐变浅或变为无色,故A说法正确;B、产生白色沉淀的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,故B错;C、二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡反应生成碳酸钡沉淀和氯化钠,所以最后溶液中一定含有氯化钠,故C说法正确;D、根据二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡反应生成碳酸钡沉淀和氯化钠,可知BaCl2、NaOH都是反应物,在不断减少,所以质量分数在不断减小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
黄冈中学自主招生化学试题时间:40分钟分值:50分
可能用到的相对原子质量:H:1,C:12,N:14,O:16,S:32,K:39,Ca:40,Fe:56
一、单项选择题(每小题2分,共8小题,共16分)
1.下列四套装置中,在注入酸起反应后对气球的变化情况作出正确分析的是()
A.气球①不胀大,②-④都能迅速胀大B.气球②逐渐胀大,气球④迅速胀大
C.气球②逐渐胀大,气球③缓缓膨胀后停止,气球④迅速胀大D.以上都不正确
2.有一部分潮解和变质的苛性钠样品W g,为验证其变质的程度,将其加入98g质量分数为20%的稀H2SO4中,充分反应后,再加入20g 20%的NaOH液恰好呈中性,则把溶液蒸干,可得固体的质量为( )。
A.19.6g B.14.2g C.28.4g D.30.4g
3.将CO2通入滴有酚酞的BaCl2、NaOH混合溶液中,出现白色沉淀.下列说法错误的是()A.溶液的红色逐渐变浅或变为无色B.产生白色沉淀的化学方程式为:BaCl2+CO2+H2O=BaCO3+2HCl C.反应后的溶液中一定有NaClD.反应过程中,溶液里的BaCl2、NaOH的质量分数均减小
4.工业用CaO和硝酸反应制Ca(NO3)2·4H2O晶体,为确保制备过程既不补充水分,又无水剩余,则应选用的硝酸质量分数()
A.30% B.63% C.70% D.84%
5.右图是某燃煤发电厂处理废气的装置示意图,下列说法不正确
的是()
A.进入烟囱的气体为混合物
B.此过程中硫元素的化合价没有发生改变
C.使用此废气处理装置可减少酸雨的形成
D.整个过程的反应可表示为2SO2+2CaCO3+O2=2CaSO4+2CO2
6.表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。
下列反应均能发生,其中不符合该规律的是()
7.向t℃时饱和的Na2CO3溶液中加入n g无水Na2CO3,会析出m g Na2CO3·10H2O,则(m-n)的值为( ) A.饱和溶液失去水的质量B.饱和溶液失去溶质的质量
C.饱和溶液失去水和溶质的质量之和D.其数值为0,即溶液质量不变
8.将一定量铝粉和氧化铜混合加热,反应的化学方程式为:3Cu
O+2Al
高温3Cu+A12O3。
反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。
下列叙述的现象中,能说明氧化铜没有完全反应的是()
A.加入稀硫酸后,有气泡生成 B.加入稀硫酸后,没有气泡生成
C.加入稀硫酸后,溶液中有红色不溶物质 D.插入溶液中的铁片表面有红色物质析出
选择题答题卡:每小题2分,共16分
二、填空简答题(共9小题,每空1分,共34分)
9.(4分)有元素化合价升降的反应是氧化还原反应。
失去电子,化合价升高的物质是氧化剂;得到电子,化合价降低的物质是还原剂。
①反应4Zn+10HNO3=4Zn(NO3)2+N x O y+5H2O中,N x O y的化学式为,还原剂是。
②四种基本反应类型中肯定属于氧化还原反应的有,肯定不是氧化还原反应的有。
10.(2分)可变价的金属往往只有一种价态较稳定:铁+3价、铜+2价较稳定,而汞的0价较稳定。
下列金属硫化物在空气中灼烧时均产生SO2气体。
试写出它们在空气中灼烧的化学方程式:
①FeS2:。
②HgS:。
11.(5分)在A、B、C、D四支试管中分别盛有NaHSO4、Na2CO3、BaCl2、BaCO3固体,某同学在只有蒸馏水和若干试管的条件下,将它们一一鉴别出来.
(1)NaHSO4在水中会解离出Na+、H+、SO42﹣.从物质分类的角度考虑,NaHSO4属于
(A.酸B.碱C.盐D.氧化物);
(2)最先检验出来的固体物质是,利用它又可直接检验出的固体物质是;(3)剩余两种固体被检验出来时发生反应的化学方程式分别是、。
12.(2分)肥皂的主要成分为硬脂酸钠(C17H35COONa),它是一种有机酸的钠盐,在肥皂水中滴入盐
酸会出现白色沉淀,这沉淀物是(写化学式);若在肥皂水中加入硬水(含Ca2+、Mg2+)也会出现白色沉淀,此沉淀主要是(写化学式)。
13.(4分)有NaCl、AgCl、Fe(OH)3三种物质的固体混合物,要将它们逐一分离出来,现进行下列实验:
(1)根据实验判断X、Y、Z依次为(填写化学式)。
(2)实验中操作①的名称是,操作②的名称是。
(3)该物质分离过程中至少需要、、、、铁架台、酒精灯、药匙等仪器。
14.(4分)以氯化钾和硫酸亚铁为原料生产硫酸钾和氧
化铁(铁红颜料),其主要流程如下,请认真观察工艺
流程,回答下列问题:
(1)铁红的化学式是;
(2)FeSO4与NH4HCO3反应生成FeCO3、(NH4)2SO4、
H2O和CO2,其反应的化学方程式是;
(3)硫酸酸化是为了除去过量的NH4HCO3,反应后逸
出的气体是;
(4)沉淀池Ⅱ中溶质有KCl、K2SO4、H2SO4,还含有.
15.(4分)在实验室用氧化铜、硫酸、和氢氧化钠溶液制备氢氧化铜。
①小芳取少量氧化铜和一定溶质质量分数较大的硫酸,略微加热后得到蓝色溶液,接着滴入几滴氢氧化钠溶液,结果没有发现蓝色沉淀生成。
请你帮助小芳分析未得到蓝色沉淀的原因;
②小刚取少量氧化铜和一定量稀硫酸,经过长时间加热,氧化铜全部溶解后,立即加入氢氧化钠溶液,结果也没有得到蓝色沉淀,试管中却意外出现了黑色固体。
请写出生成黑色固体的化学方程式。
③小孙取一定的氧化铜加入100克14%的稀硫酸,微热至氧化铜全部溶解。
再加入11克的铁粉,充分反应后过滤,得到滤渣低温干燥后为6.2克。
分析滤液中的溶质为,原来氧化铜的质量为。
16.(6分)在焊接两根铁轨时,为确保施工质量,工程技术人员常用到一种叫做“引火铁”的反应活性材料。
实验室的制备过程如下:⑴在高温条件下用普通铁粉和水蒸气反应,得到粉末状的四氧化三铁;⑵将四氧化三铁粉末在高温条件下经过与上述过程相反的反应生成“引火铁”粉末。
请分别用以下两套装置,制取四氧化三铁和“引火铁”。
实验中必须使用普通铁粉和稀硫酸,其他试剂和用品自选。
(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)
填写下列空白:
(1)实验过程中第(1)、(2)两个相反步骤的反应方程式是:
①;
②。
(2)在实验装置中,烧瓶B的作用是。
(3)实验时试管D处可收集到的气体是。
(4)实验时在U型管G中常加入固体是。
(5)实验过程中,两套装置里所有需要加热的仪器是(填字母)。
17.(3分)向质量为m的20%的氢氧化钠溶液中逐滴加入硫酸镁溶液,至恰好完全反应时,滤去沉淀,称量所得滤液总质量为3m.
(1)计算生成Mg(OH)2沉淀的质量(用m表示);
(2)计算所加硫酸镁溶液中溶质的质量分数(最后结果精确到0.1%).。
