卤素
什么是卤素

什么是卤素|卤素种类|卤素危害|卤素限制什么是卤素?卤素指周期系第7(ⅦA)族非金属元素,包括氟(Fluorine)、氯(Chlorine)、溴(Bromine)、碘(Iodine)和砹(Astatine)等五种元素,总称为卤素。
卤素性质:卤素元素作为一种典型的,最活泼的非金属,在自然界中多以卤化物形式存在(碘以碘酸盐的形式存在,砹为放射性元素)。
其特性是:最外电子层都有7个电子,都易于得到一个电子形成稳定的卤化物。
工业上应用的卤素化合物多为有机卤化物大多数的有机卤化物是人工合成的产物,商品卤代烃超过15000种。
由于它们具有一些优异的使用性能,如阻燃、易溶解、反应活性高等,被广泛用于各个领域,如阻燃剂,制冷剂,溶剂,有机化工原料,农药杀虫剂,漂白剂,羊毛脱脂剂卤素的危害及限制有机卤化合物在人体中可导致癌症,而且其低生物降解率会导致生态系统中的积累,一些挥发性的有机卤化物对臭氧层也有极大的破坏作用,进而对环境和人类健康造成严重影响,因此卤素化合物被列为对人类和环境有害的化学品,禁止或限量使用。
目前卤素以各种化合物的形式存在并应用于各个领域,尽管世界各国还没有出台专门针对卤素的法规,但国际上许多非政府组织的环保机构正积极推动Halogen-free行动,同时一些大型跨国公司也都制定了自己的环保法规,其中就包括对卤素的限制或限量,并要求自己的供应商遵守该限制或限量从而生产出绿色环保产品。
杭州佰标检测技术有限公司是针对中国企业提供各类产品TUV 检测服务的专业认证服务机构,公司着力为企业解决产品出口的检测认证困绕,根据国外买家的要求结合当地的法令政策向客户提供最优惠的测试方案,和最快捷的检测认证服务。
专业提供:REACH-SVHC 、RoHS、EN71、ASTM F963、FDA、LFGB、PAHs/多环芳烃、Phthalates/邻苯二甲酸盐、BPA/双酚A 、Pofs、 Cd/镉含量、 AZO/偶氮化合物、DMF 、Organotins/有机锡化合物、VOCs 挥发性有机物、Ni/镍含量释放量、 PCB/多氯联苯、 PCN/多氯化萘、 SCCP/短链氯化石蜡、Formaldehyde/甲醛、Asbestos/石棉、Nonyl Phenol【NP】/壬基苯酚、 PVC及其混合物、 PCT/聚氯三联苯、TBBP-A 四溴双酚、 A Halogen/卤素、 1,2,3-Benzotriazole/苯并三唑、ODCs破坏臭氧层化学测试、PFOS 全氟辛烷磺酰基化合物、PFOA 全氟辛酸铵、HBCDD/六溴环十二烷测试等。
卤素的知识点归纳总结

卤素的知识点归纳总结一、卤素的性质1. 物理性质卤素的物理性质各异,如氟气为浅黄色气体,氯气为黄绿色气体,溴为红褐色液体,碘为紫黑色晶体,烷为暗紫色晶体。
卤素的沸点和熔点逐渐升高,原子量增大。
2. 化学性质卤素在化学性质上也有很多相似之处,例如:(1)卤素的电负性逐渐减小,化活性逐渐减弱;(2)卤素能与氢形成卤化氢,如氟与氢结合为氢氟酸、氯可与氢结合为盐酸,溴合氢结合为溴化氢,碘与氢结合为碘化氢;(3)卤素与金属反应,形成卤化物,如氟与钠反应形成氟化钠,氯与钾反应形成氯化钾,溴与钙反应形成溴化钙,碘与铝反应形成碘化铝。
3. 卤素的氧化性和还原性卤素可以表现出比较复杂的氧化性和还原性。
例如,氟气能与水蒸气反应生成氢氟酸和氧气;氯气与水反应生成盐酸和电子;溴与水反应生成溴化氢和氧气。
二、卤素在生活和工业中的应用1. 卤素在医疗和药物工业中的应用卤素及其化合物在医疗和药物工业中有着广泛的应用。
例如,碘和氯制成的药物可用于消毒和杀菌;氟化合物可用于制作药物和牙膏等。
2. 卤素在农业中的应用卤素及其化合物在农业中也有着重要的应用,例如氯化钠、氯化钾和氯化镁可用于土壤改良和植物生长;氯气可制成杀虫剂和杀菌剂。
3. 卤素在化工生产中的应用卤素及其化合物在化工生产中也有着广泛的应用,比如氯和氯化物可用于橡胶生产、塑料制造和合成纤维等;氟和氟化物可用于制作冷冻剂和高分子化合物。
三、卤素的环境影响1. 卤素对环境的影响卤素及其化合物对环境有着重要的影响,比如氯氟烃类气体和氟化物等对臭氧层和温室气体的破坏,对生态系统的影响;氯化物和碘化物等对水体和土壤的污染。
2. 卤素的环境保护为了减少卤素对环境的影响,需要加强卤素的环境保护工作,采取科学的措施进行处理和利用,减少对环境的影响。
四、卤素元素的发现及历史1. 卤素元素的发现卤素元素的发现可追溯到古代。
人类在早期,就发现了一些卤素原素。
比如,古埃及人用氯化钠制成各种药品,古希腊人发现了碘元素。
名词解释卤素

名词解释卤素卤素是一种有机化合物,又称作“卤化物”,是指在卤素核心部分,带有一个或多个氯原子的化合物,其化学式一般为RX,其中R表示有机部分,可以是烷烃、烯烃、烃烷或其它有机物,X表示卤素核心部分,即氯原子,也可以是氟、硫、氢等原子。
由于卤素表现出特殊的极性特性,有机物中含卤素化合物常常以溶解材料的形式存在,从而发挥重要的起到作用。
卤素溶剂具有良好的溶质丰富性、水溶性良好、酸碱性可调、极差极性可调等优点,可以作为分子排斥、聚集、自结构等晶体反应的催化剂,使反应更加有效地进行。
卤素溶剂的应用涉及到核电子传输、液晶显示器、汽车油漆等各个领域。
卤素也可以用于分离、净化、分解各种有机物质,具有优异的极性、相互作用性、水溶性和溶解性能。
卤素溶剂可以将来自某些特定环境的有机物质分解,形成各种混合物、混合溶液和混合溶胶,可以用作放射性核素的催化物。
卤素溶剂也被广泛应用于各种油品的加工、改性、提纯和氧化等工艺过程中。
此外,卤素溶剂还可以用于有机合成中,如高分子化学、合成有机分子等,可以影响有机物质的分子结构,形成新的结构,从而改变有机物质的性质。
尽管卤素溶剂具有众多优势,但在实际应用中仍存在一些不足。
首先,卤素溶剂本身具有毒性,过度接触可能对人体健康造成威胁。
其次,部分卤素溶剂具有自蒸发性,因此必须存储在完全密封的容器中,以防止析出物。
虽然有这些局限性,但卤素溶剂的应用范围仍然很广泛,正在展现出更大的潜力,而且在未来几年也将受到越来越多的重视。
总之,卤素溶剂是一种广泛应用于化学、分离、净化、合成等工艺过程中的主要有机溶剂,具有优异的极性、相互作用性、水溶性和溶解性能,可以有效地提高反应作用的效率,是一种重要的有机溶剂。
卤素

(2)物质的颜色与吸收光颜色的关系 )
物质的颜色
绿 黄 青
橙 红
白光 蓝 紫
青蓝
黄绿 黄 橙 红 紫红 紫 蓝 青蓝 青
吸收光 波长(nm) 颜色 波长(nm) 400— 紫 400—450 450— 蓝 450—480 480— 青蓝 480—490 490— 青 490—500 500— 绿 500—560 560— 黄绿 560—580 580— 黄 580—600 600— 橙 600—650 红 ) X2为非极性分子,分子间作用 为非极性分子, 力主要为┄┄ ┄┄色散力 力主要为┄┄色散力 熔沸点F 依次升高。 ∴熔沸点 2→I2 依次升高。 聚集态 F2(g)→CI2(g)→Br2(l)→I2(g) Br2:非金属中的唯一液体 I2:固体易升华,紫黑 粉红 固体易升华,紫黑→粉红
(2)与非金属作用 )
F2
反应活性 与H2反应条件 暗处 光照 Pt/350℃ 高温 ℃ F2可与所有除 O2、N2,稀有气体He和Ne外的非金属作用 稀有气体 和 外的非金属作用 直接化合成高价氟化物。 直接化合成高价氟化物。 Cl2也可与大多数非金属单质化合,但不如 2猛烈。 也可与大多数非金属单质化合,但不如F 猛烈。 2 S(s) + Cl2(g) = S2Cl2(l) 红黄色液体 S(s) + Cl2(g)(过量 = SCl2(l) 深红色发烟液体 过量) 过量 2 P(s) + 3 Cl2(g) = 2 PCl3(l) 无色发烟液体 2 P(s) + 5 Cl2(g) (过量 = 2 PCl5(l) 淡黄固体 过量) 过量 Br2和I2与许多非金属作用反应,但不如 2、Cl2激烈,不能 与许多非金属作用反应,但不如F 激烈, 氧化到最高价。 氧化到最高价。
卤素
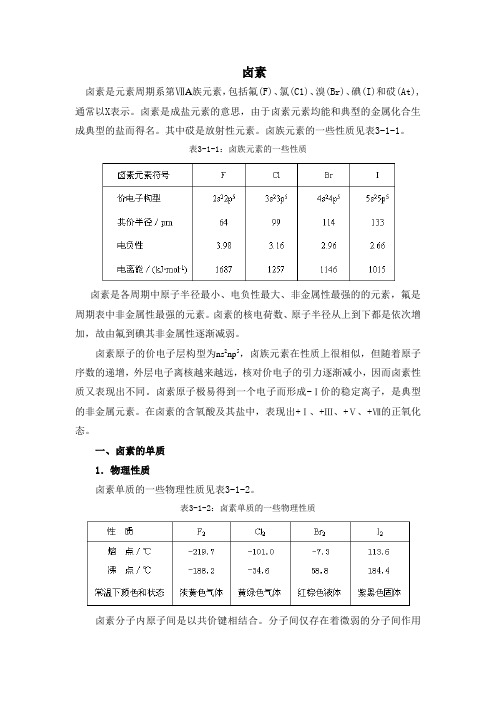
卤素卤素是元素周期系第ⅦA族元素,包括氟(F)、氯(C1)、溴(Br)、碘(I)和砹(At),通常以X表示。
卤素是成盐元素的意思,由于卤素元素均能和典型的金属化合生成典型的盐而得名。
其中砹是放射性元素。
卤族元素的一些性质见表3-1-1。
表3-1-1:卤族元素的一些性质卤素是各周期中原子半径最小、电负性最大、非金属性最强的的元素,氟是周期表中非金属性最强的元素。
卤素的核电荷数、原子半径从上到下都是依次增加,故由氟到碘其非金属性逐渐减弱。
卤素原子的价电子层构型为ns2np5,卤族元素在性质上很相似,但随着原子序数的递增,外层电子离核越来越远,核对价电子的引力逐渐减小,因而卤素性质又表现出不同。
卤素原子极易得到一个电子而形成-Ⅰ价的稳定离子,是典型的非金属元素。
在卤素的含氧酸及其盐中,表现出+Ⅰ、+Ⅲ、+Ⅴ、+Ⅶ的正氧化态。
一、卤素的单质1.物理性质卤素单质的一些物理性质见表3-1-2。
表3-1-2:卤素单质的一些物理性质卤素分子内原子间是以共价键相结合。
分子间仅存在着微弱的分子间作用力,随着相对分子质量的增大,分子的变形性逐渐增大,分子间的色散力也逐渐增强,因此,卤素单质的一些物理性质呈现规律性变化。
如卤素单质的熔点、沸点等按F—C1—Br—I的顺序依次升高。
常温下,氟和氯是气体,溴是易挥发的液体,碘为固体(易升华)。
可见卤素单质的颜色随着相对分子质量的增大而逐渐加深,这是由于从氟至碘外层电子离核越来越远,相应的外层电子更易被激发,所以外层电子被激发所需要的能量就越少,故使物质的颜色逐渐变深。
卤素单质是非极性分子,在水中的溶解度不大,易溶于有机溶剂。
氟不溶于水,它能剧烈地分解水而放出氧气。
溴在有机溶剂中的颜色随溴浓度的增加而逐渐加深,从黄色到棕红色。
碘溶于溶剂中所形成溶液的颜色随溶剂不同而有区别。
卤素单质均有刺激气味,吸人较多的蒸气会发生严重中毒,甚至造成死亡。
它们的毒性从氟到碘依次减轻。
溴易挥发,高浓度的液溴可使皮肤严重灼伤;碘的蒸气有毒,强烈刺激皮肤和眼睛;使用时要特别小心。
12-卤素

BrO4
-
BrO3
-
BrO-
Br2(l)
Br-
HI3O62- 0.65 IO3- 0.15 IO- 0.42 I2(s) 0.54 I在 0B图中,除X2/X-电对外,其余电对的电极电势虽为正值,但 均较小,即在碱性介质中,各种含氧酸盐的氧化性较含氧酸弱。
14.2.2 卤素单质物理性质
卤素单质
聚集状态 颜色 熔点/℃ 沸点/℃ 汽化热/(KJ· mol-1) 溶解度/g· (100gH2O)-1
• Cl2也可与大多数非金属化合,但不如F2猛烈。 Br2 、I2更差。 2S + Cl2 = S2Cl2 S + Cl2(过量) = SCl2
2P + 3Cl2 = 2PCl3
2P + 5Cl2(过量) = 2PCl5 2P + 3Br2 = 2PBr3 2P + 5Br2(过量) = 2PBr5
氟
气 浅黄 -219.6 -188 6.32 分解水
氯
气 黄绿 -101 -34.6 20.41 0.732
溴
液 红棕 -7.2 58.78 30.71 3.58
碘
固 紫黑 113.5 184.3 46.61 0.029
密度/(g· cm-3)
1.11(l)
1.57(l)
3.12(l)
4.93(s)
F F F I F F
Cl Cl
F F F F F I F F
I
例:ICl2 (7 + 1×2) / 2 = 4.5 (杂化轨道理论:sp3d),直线型 例:IF7 (7 + 1×7) / 2 = 7 五角双锥
对于ClF3 (7+3) 2 = 5
卤素PPT课件

05
卤素在生活生产中应用
食盐与人体健康关系探讨
食盐的化学成分及作用
主要成分为氯化钠(NaCl),是人体必需的营养元素之一,对于维持细胞内外渗透压平衡、 神经传导和肌肉收缩等生理功能具有重要作用。
食盐摄入量与健康关系
适量摄入食盐对维持人体健康至关重要,但过量摄入可能导致高血压、心血管疾病等健康问 题。世界卫生组织建议每日食盐摄入量不超过5克。
06
卤素对环境影响及治理措 施
大气中卤代烃污染现状及危害
卤代烃在大气中的来源
工业排放、汽车尾气、农药使用等。
大气中卤代烃的浓度及分布
受排放源、气象条件、地形等因素影响,浓度分布不均。
卤代烃对大气的危害
破坏臭氧层,导致紫外线辐射增强;形成光化学烟雾,危害人类健 康。
水体中卤代烃污染现状及危害
卤代烃在水体中的来源
溴和碘
物理性质
溴是一种红棕色、有刺激性气味 的液体,密度比水大,易挥发; 碘是一种紫黑色、有金属光泽的
固体,密度比水大,易升华。
化学性质
溴和碘的化学性质较为相似,都 具有氧化性,能与多种元素直接
化合生成溴化物和碘化物。
用途
溴和碘在有机合成、医药、农药 等领域有着广泛的应用。例如, 溴可用于制取溴化物、染料、灭 火剂等;碘可用于制取碘化物、
氯气可以与大多数金属直接反应,生 成相应的氯化物。
卤素性质变化规律
01
随着原子序数的增加, 卤素的非金属性逐渐减 弱,金属性逐渐增强。
02
卤素单质的颜色逐渐加 深,从氟气的浅黄绿色 到碘单质的紫黑色。
03
04
卤素单质的密度逐渐增 大,熔点和沸点也逐渐 升高。
卤素单质的氧化性逐渐 减弱,还原性逐渐增强。
第二章 卤素

3. 在水中溶解度
HF分子极性大,在水中可无限制溶解。1 m3的 水可溶解 500 m3 HCl,常压下蒸馏氢卤酸,溶液 的沸点和组成都在不断的变化,最后溶液的组成 和沸点恒定不变时溶液叫恒沸溶液。
恒沸溶液的沸点叫该物质的恒沸点。 此时气 相、液相组成相同,在此温度下H2O和HX共同蒸 出。 例:HCl溶液恒沸点110℃,组成:含 HCl 20.20%。 许多有机化合物混合后,都可组成恒沸 液而难以分离。
MnO2 H 2I Mn I 2 2H2 O
2
5 卤素的用途 氟用于制备六氟化铀(UF6),它是富集核燃料的重要化 合物。聚四氟乙烯[-(CF2-CF2)n-]是耐高温绝缘材料,氟化烃 可做血液的临时代用品。氟化石墨 (CF)n,是一种性能优异 的无机高聚物,与金属锂可制成高能量电池,氟化物玻璃 (主要成分为ZrF4-BaF2-NaF)可制作光电纤维。 氯是一种重要的工业原料。主要用于合成盐酸、聚氯乙 烯、漂白粉、农药、有机溶剂、化学试剂等,氯也用于自来 水消毒,但近年来逐渐改用臭氧或二氧化氯作消毒剂,因为 发现氯能与水中所含的有机烃形成致癌的卤代烃。 溴用于染料、感光材料、药剂、农药、无机溴化物和溴 酸盐的制备,也用于军事上制造催泪性毒剂。 碘和碘化钾的酒精溶液在医药上用作消毒剂,碘仿 (CHI3)用作防腐剂。食用加碘盐中加入的是KIO3,用于防 治甲状腺肿大。碘化银用于制造相底片和人工降雨。
12.3 卤化氢和氢卤酸
一.物理性质
卤化氢是具有强烈刺激臭味的无色气体。 1. 沸点:沸点除HF外,逐渐增高,因为HF 形成分子间 氢键,所以沸点是本族最高的一个,液态HF,无色液体,无 酸性,不导电。 2. 气体分子聚集态:常温常压下,因为 HF 分子间存在 氢键,蒸汽密度测定表明,常温下HF主要存在形式是(HF)2 和(HF)3,在 359 K以上 HF 是气体才以单分子状态存在。 其它卤化氢气体, 常温下以单分子状态存在. 固态时
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十四章卤素一、是非题.1.除氟外,各种卤素都可以生成几种含氧酸根,例如:ClO4-、ClO3-、ClO2-、ClO-在这些酸根中,卤素的氧化态越高,它的氧化能力就越强。
即ClO4-> ClO3- > ClO2- > ClO-。
2.所有的非金属卤化物水解的产物都有氢卤酸。
3.氟的电离势,电子亲合势,F2的离解能均小于同族的氯。
4.歧化反应就是发生在同一分子内的同一元素上的氧化还原反应。
5.卤素是最活泼的非金属,它们在碱溶液中都能发生歧化反应,反应产物随浓度及温度的不同而不同。
6.次卤酸都是极弱酸,且酸性随着卤素原子量递增而增强。
即:酸性HClO < HBrO < HIO。
7.各种卤酸根离子的结构,除了IO65-离子中的I是sp3d2杂化外,其它中心原子均为sp3杂化。
二、选择题1. 如果用浓盐酸与漂白粉作用制备氯气,在所制得的氯气中可能会出现的杂质是:A.二氧化碳B.水蒸气C.氯化氢D.以上三种2.氟的电子亲合势和F2的离解能小于氯,原因是:元素氟的A. 原子半径小,电子密度大,斥力大B. 原子半径大,电负性大C. 原子半径小,电离势高D. 以上三者都有3 卤族元素从上到下哪一性质是无规律的变化A. 原子半径B. 第一电离势C. 电子亲合势D. X-的水合能4 在常温下,氟和氯是气体,溴是易挥发的液体,碘为固体,在各卤素分子之间是靠什么力结合的A.色散力B.取向力C.诱导力D.氢键5 氢氟酸是一弱酸,同其它弱酸一样,浓度越大,电离度越小,酸度越大;但浓度大于5mol.L-1时,则变成强酸。
这点不同于一般弱酸,原因是A. 浓度越大,F-与HF的缔合作用越大B. HF的浓度变化对HF的Ka有影响,而一般弱酸无此性质C. HF2-的稳定性比水合F-离子强D.以上三者都是6 在低温下已制成FOH,但很不稳定,在室温时与水反应立即放出氧气,其中元素氧的氧化数为:A. 0B. -1C. +2D. -27. 氟与水反应很激烈,并有燃烧现象,它的主要产物是:A. HF和O2B. HF、O2、O3C. HF、O2、O3、H2O2、OF2D. HF、O2、O3、H2O28. 有关Cl2的用途,不正确的论述是:A.用来制备Br2B.用来作为杀虫剂C.用在饮用水的消毒D.合成聚氯乙烯9.下列各组化合物中,均难溶于水的是A. BaCrO4,LiFB.Mg(OH)2,Ba(OH)2C. MgSO4,BaSO4D.SrCl2,CaCl210. 在常温下,Cl2、Br2、I2与NaOH 作用正确的是A. Br2生成NaBr,NaBrOB. Cl2生成NaCl,NaClOC. I2生成NaI,NaIOD. Cl2生成NaCl,NaClO311. 下列反应不可能按下式进行的是A.2NaNO 3 + H 2SO 4(浓)−→−Na 2SO 4 + 2HNO 3B.2NaI + H 2SO 4(浓)−→−Na 2SO 4 + 2HIC.CaF 2 + H 2SO 4(浓)−→−CaSO 4 + 2HFD. 2NH 3 + H 2SO 4−→−(NH 4)2SO 412. 下列化合物与水反应放出 HCl 的是A. CCl 4B.NCl 3C.POCl 3D.Cl 2O 713.下列有关卤素的论述,正确的是A.溴是由Cl - 作氧化剂制得的B.F -是最强的氧化剂C.所有卤素都可以通过电解法得到D.碘是最强的还原剂14. 在热碱性溶液中,次氯酸根离子不稳定,它的分解产物是A. Cl -(aq) 和Cl 2(g)B. Cl -(aq) 和ClO 3-(aq)C. Cl -(aq) 和ClO 2-(aq)D.Cl -(aq) 和ClO 4-(aq)15下列各种说法正确的是A 、氯的电负性比氧小,因而氯气的氧化能力比氧弱B 、卤化氢的热稳定性由HF →HI 依次增加C 、X -的还原性由I -→F -依次降低D 、MXO 、MXO 2、MXO 3、MXO 4氧化能力依次增强16 大苏打与碘反应的产物之一是 ( )A 、Na 2SO 4B 、Na 2S 2O 4C 、Na 2S 4O 6D 、Na 2SO 3 17 加热就能生成少量氯气的一组物质是( )A .42SO H NaCl 和;B .2MnO NaCl 和;C .HCl KMnO 和4;D .2Br HCl 和三、填空题1.NaClO 4和KClO 4相比, 溶解度更大。
2. 漂白粉的有效成分是________________,漂白粉在空气中放置时,会逐渐失效的方程式是__________________________。
3.列出卤素含氧酸酸性的强弱顺序___________________________列出卤素单质氧化性的强弱顺序___________________________4.O2 F2分子轨道及电子填充为__________________________________5、将氯气通入热的Ca(OH)2溶液中,反应的产物是;低温下Br2与Na2CO3溶液反应的产物是;常温下I2与NaOH溶液反应的产物是.工业上制取Br2,先将海水日照浓缩,调成酸性,通入__________,将Br 氧化成Br2;之后鼓入空气将Br2吹出,用Na2CO3溶液吸收,反应方程式为:_____________________________________;最后加酸制得Br2,发生的反应是_________________________________。
6、漂白粉是。
次氯酸盐的最大用途是和。
这类漂白剂的氧化能力是以有效氯的含量为标志。
有效氯的定义为:7、按要求正确排序(用“>”或“<”表示=(1)HClO HClO2HClO3 HClO 4的氧化能力(2)HClO 4 H 2SO 4 H 3PO 4 H 2SiO 4的酸性(3)HF HCl HBr HI的沸点(4)ClO 3-BrO 3-IO 3-的氧化能力(5)NaClO NaClO2NaClO3 NaClO 4的碱性(6)Ø(ClO3-/Cl2) φØ(BrO3-/Br2) φØ (IO3-/I2)四、简答题1. 氯的电负性比氧小,但为何很多金属都比较容易和氯作用,而与氧反应较困难?2.为什么AlF3的熔点高达1290℃,而AlCl3却只有190℃?3. 欲初步鉴别:MnO2、Fe3O4、Co2O3、NiO2、CuO五种棕黑色的氧化物,应加下列试剂中的哪一种较妥? 写出反应现象。
A. 浓H2SO4B. 稀H2SO4C. 浓HClD. 稀HCl 4.氟的电子亲合能比氯小,但F2却比Cl2活泼,请解释原因。
5.讨论Cl2,Br2,I2与NaOH溶液作用的产物及条件。
6.工业有哪几种制造氯酸钾的方法?说明反应原理。
并比较它们的优缺点。
7.四支试管分别盛有HCl, HBr, HI, H2SO4溶液。
如何鉴别?8.试解释Fe与盐酸作用产物和Fe与氯气作用产物不同的原因。
9.白粉长期暴露于空气中为什么会失效?10.为什么NH4F一般盛在塑料瓶中?11.说明卤素的含氧酸及其盐的性质递变规律。
12.说明卤化氢热稳定性、还原性及酸性的递变规律。
13.怎样鉴别Cl―、Br―、I―?14. 叙述由自然界的卤化物制备卤素的方法。
五、完全并配平反应方程式1.将氟通入溴酸钠碱性溶液中。
2.氯酸钾受热分解。
3.次氯酸钠溶液与硫酸锰反应。
4.氯气通入碳酸钠热溶液中。
5.浓硫酸与溴化钾反应。
6.浓硫酸与碘化钾反应。
7.向碘化亚铁溶液中滴加过量氯水。
8.向碘化铬溶液中加入次氯酸纳溶液。
9.用氢碘酸溶液处理氧化铜。
10.氯气通入碘酸钾的碱性溶液中。
11.Cl2 + (冷)OH-……→12、Cl2 + NaOH→∆13、氯水滴加到碘化钾溶液中直至过量14、Na2S2O 3溶液中分别滴加碘液、氯水15、用漂白粉漂白物料时,常采用以下步骤:(1) 将物料浸入漂白粉溶液,然后暴露在空气中;(2) 将物料浸在稀盐酸中;(3) 将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
16、I2和Cl2在碱性介质中17、I2和H2O218、红磷与H2O混合,滴加Br219、红磷和碘混合,滴加H2O20.用反应方程式表示由氯化钾制备氧气。
四、简答题六、计算题I2在水中的溶解度很小,试根据下列两个半反应:I2(s) + 2e- ←→ 2I-φo= 0.535VI2(aq) + 2e- ←→ 2I-φo= 0.621VA.写出原电池符号B.计算I2饱和溶液的溶解度。
答案: A:(-)Pt、I2(s)│I-‖I-、I2(aq) │Pt (+) B:C(I2(aq))=1.24×10-3七、综合题:1、有一种白色固体A,加入油状无色液体B,可得紫黑色固体C,C微溶于水,加入A后C的溶解度增大,成棕色溶液D。
将D分成两份,一份中加一种无色溶液E,另一份通入气体F,都褪色成无色透明溶液,E溶液遇酸有淡黄色沉淀,将气体F通入溶液E,在所得的溶液中加入BaCl2溶液有白色沉淀,后者难溶于HNO3,问A至F各代表何物质?用反应式表示以上过程。
2.今有白色的钠盐晶体A和B。
A和B都溶于水,A的水溶液呈中性,B的水溶液呈碱性。
A溶液与FeCl3溶液作用,溶液呈棕色。
A溶液与AgNO3溶液作用,有黄色沉淀析出。
晶体B与浓盐酸反应,有黄绿色气体产生,此气体同冷NaOH溶液作用,可得到含B的溶液。
向A溶液中开始滴加B 溶液时,溶液呈红棕色;若继续滴加过量的B溶液,则溶液的红棕色消失。
试判断白色晶体A和B各为何物?写出有关的反应方程式。
参考答案一、是非题:1×2× 3 ×4√5×6×7 √二、选择题:1 [D]2 [A]3 [C]4 [A]5 [A]6 [D]7 [A] 8[B] 9[A] 10[B] 11[B] 12[C] 13[C] 14[B] 15[C] 16[C] 17[C]四、简答题1 因为氧气的离解能比氯气的要大得多,并且氧的第一二电子亲和能之和为较大正值(吸热)而氯的电子亲和能为负值,因此,很多金属同氧作用较困难而比较容易和氯气作用,另外又因为同种金属的卤化物的挥发性比氧化物更强,所以容易形成卤化物.2 氟的电负性较氯大,氟的离子半径比氯小,故其变形性也小,氟与铝以离子键相结合,AlF3属离子型化合物,而AlCl3是共价型化合物,分子间借助弱的范德华力结合,所以AlF3的熔点要比AlCl3高得多。
3用稀HCl因为MnO2Fe3O4Co2O3NiO2CuO└───────────┬─────────────┘↓稀HCl┌─────────────────────────┐不反应Fe3+黄棕Co2+浅红色Ni2+绿色Cu2+蓝色溶液溶液,Cl2↑ 溶液,Cl2↑ 绿色溶液六、计算题A:(-)Pt、I2(s)│I-‖I-、I2(aq) │Pt (+) B:C(I2(aq))=1.24×10-3七、综合题:1、A:KI B:浓H2SO4C:I2D:KI3E:Na2S2O3F:Cl22、A:NaBr B: NaClO。
