电导法测定弱电解质的电离常数
基础化学实验实验6 电导法测定弱电解质(HAC)的电离常数

电解质溶液的电导与溶液中溶解的电解质总量及其
电离度有关。如果将含1 mol电解质的溶液放在相距1 m 的两个平行电极间,此时测得的电导,称为该电解质的 摩尔电导,用λ表示,则
k ( 1) 1000c 式中k为溶液的电导率;c为溶液的浓度。
3
实验步骤
1、恒温槽恒温至25±0.1 ℃
2、0.1 mol· L-1醋酸标准溶液的配制、标定及电导
率的测定移取1.4 mL冰醋酸于250 mL高纯水中,装入试 剂瓶、摇匀,用氢氧化钠标准溶液标定其准确浓度。 按表1,在3个50 mL烧杯中加入不同体积的醋酸 标准溶液和高纯水,将烧杯放入恒温槽中恒温5 min后,
实验 电导法测定弱电解质的 电离常数及难溶盐的溶解度
• 1 实验目的
• (1)学习电导法测定弱电解质电离常数的原理和
方法。
• • (2)学习电导法测定难溶盐溶解度的原理和方法。 (3)掌握电导率仪的使用方法。
2 实验原理
在外加电场作用下,电解质溶液中的阴、阳离子会
在两电极间定向移动,形成电流。其电流、电压和电阻
(2)能否用万用表来测电解质溶液的电导? 答:不能用万用表来测量电解质溶液的电导。因为 万用表内的电池(直流电源)会与溶液形成回路,导致 电极产生电解作用,使电极表面附近的溶液组成发生变
化,从而使溶液的电阻发生改变,给电导的测量带来严
重的误差。只能用电导仪或电导率仪(采用交流电桥) 进行测量。
测定其电导率。
表1
烧杯 号 1 加入醋酸 标准溶液 体积/mL 6.00
醋酸溶液电导率的测定及电离常数的计算
醋酸溶液浓 加入纯 度 水 c / 体积/mL (mol·L-1) 18.00 电导率
实验一 电导法测定弱电解质的电离平衡常数

实验一电导法测定弱电解质的电离平衡常数实验目的:通过电导法测定弱电解质的电离平衡常数,探究电导法测定电离平衡常数的原理和操作方法。
实验原理:弱电解质的电离平衡常数K为:K=α²C/(1-α) (其中,α表示电离度,C表示弱电解质的浓度)。
由于弱电解质的电离度很小,可以近似认为它的电离度是常数。
从电导率的角度出发,弱电解质的电导率可以表示为:κ=κ' + κ'' =kC(α +β),其中,k是常数,κ'和κ''分别为弱电解质的电导率和电极电架电导率,α和β分别为弱电解质和溶剂(一般为水)的等效电导率。
通常实验中只能测量到总电导率,但是可以通过电导率对浓度和电离度的关系进行分析,进而计算出弱电解质的K值。
实验步骤:1.将所需量的KCl、NaCl和HCl等指定量的不同浓度的溶液加入电导池中。
在每次测量前,用去离子水清洗电导池。
2.打开电导计电源开关,选择对应的测量范围,将电导池放入电导计的电极架内。
3.读取电导计显示的电导率值,将其记到实验记录表中。
4.根据所加入的某一种量浓度的水溶液电离平衡常数的已知值,计算α和K值。
将计算结果记录到实验记录表中。
5.重复以上步骤,测定其他浓度水溶液的电导率和计算α和K值。
6.将α和K值以绘制α和C的曲线等形式呈现。
通过分析α和C的曲线,确定弱电解质的电离平衡常数K。
实验注意事项:1.电导池在使用前需清洗,以保证测量结果的准确性。
2.一定要记录所有测量数据,保证测量结果的可重复性。
3.将实验结果以图表等形式呈现,进行分析和论证。
实验结果:所得结果表明,电导法测定弱电解质的电离平衡常数是可靠准确的。
通过实验,还可以得到弱电解质电离度与浓度的变化规律,进一步了解了电解质溶液中的离子平衡关系。
电导法测定弱电解质的电离常数1

电导法测定弱电解质的电离常数1 电导法测定弱电解质的电离常数姓名:侯芳利班级:化学2班学号:20105051243一、实验目的1.掌握电桥法测量电导的原理和方法;2.测定电解质溶液的当量电导,并计算弱电解质的电离常数。
二、实验原理θAB型(HAc)弱电解质在溶液中电离达到平衡时,电离常数K与浓度c、电离度α有如下关系:θθ2 K= (c/c )* α/(1-α) ( 1)θ在一定温度下K是一个常数,因此可以通过测定醋酸在不同浓度下的电离θ度,代入(1)式计算得到K值。
醋酸溶液的电离度可用电导法来测定。
电导的物理意义是:当导体两端的电势差为1伏特时所通过的电流强度。
亦即电导,电流强度/电势差。
因此电导是电阻的倒数,在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成比。
A kG=(,) l2k称为电导率或比电导,即l为1m,A为1m时溶液的电导,因此电导这个值与电导池的结构无关。
电解质溶液的电导率不仅与温度有关,而且还与溶液的浓度有关,因此通常用摩尔电导率这个量值来衡量电解质溶液的导电本领。
摩尔电导率的定义如下:含有1摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率,摩尔电导率与电导率之间有如下的关系:Λm=k/c-3式中c为溶液中物质的量浓度,单位为mol?m。
c,*m,11c,,,,,2,,K(,)mmm1电桥法是测定电阻的常用方法。
它的原理如图所示。
,是高频(1000Hz)交流电源,,,是均匀且带有刻度的滑线变阻(全长1000)。
G为示波器,R为可,变电阻。
调节电阻R或移动触电D,可使,D两点间点位等于零,因此,,间没, 有电流。
R、R、R均可直接由仪器上读出,由此可计算出R。
12,,RRSX, RR12RRS1R, XR2三、仪器和药品电桥装置、电导电极(1支)、移液管(5 ml 2支)、移液管(10 ml 2支)、移液管(25 ml 2支)、恒温槽(1套)、容量瓶(50ml 5支)、试管(2.2cm*15cm 2支)KCl(化学纯);KCl 0.0100M溶液;HAc(化学纯);HAc 0.01000M溶液;NaCl (化学纯);NaCl 0.0100M溶液;电导水。
电导法测定弱电解质的电离常数实验数据处理
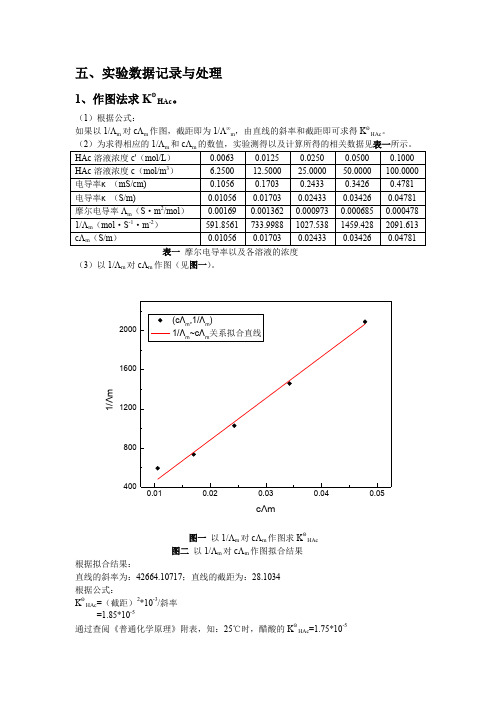
五、实验数据记录与处理1、作图法求K ΘHAc 。
(1)根据公式:如果以1/Λm 对cΛm 作图,截距即为1/Λ∞m ,由直线的斜率和截距即可求得K ΘHAc 。
表一 摩尔电导率以及各溶液的浓度 (3)以1/Λm 对cΛm 作图(见图一)。
1/ΛmcΛm图一 以1/Λm 对cΛm 作图求K ΘHAc 图二 以1/Λm 对cΛm 作图拟合结果 根据拟合结果:直线的斜率为:42664.10717;直线的截距为:28.1034 根据公式: K ΘHAc =(截距)2*10-3/斜率 =1.85*10-5通过查阅《普通化学原理》附表,知:25℃时,醋酸的K ΘHAc =1.75*10-5相对误差:5.71%2、求醋酸的电离度α。
根据弱电解质的电离度与摩尔电导率的关系: 求出五组不同浓度的醋酸溶液的电离度,见表二。
其中25℃下的Λ∞由表三得到。
表二 醋酸溶液的电离度 表三 不同温度下无限稀释的醋酸溶液的摩尔电导率(10S ·m /mol )3、计算法求K ΘHAc根据公式:通过计算的方法求得K Θ,与作图法以及标准值比较,相关数据见表四。
表四 计算的方法求得K HAc根据计算的结果,只有c/16的K ΘHAc 与其他数据相差较大,这与通过作图拟合时的数据一致,通过图一中对无根数据的拟合,可以看出也是c/16的数据点偏离拟合直线比较多,应该是实验误差所致。
4、对第一次实验数据的处理以及处理结果。
注:本次实验我们小组测量了两次,原因是第一次实验测量的数据通过拟合直线虽然斜率是可靠的,但是其截距是负值,这与直线方程的截距物理意义不符合,通过询问前面几组的数据,我们发现用右侧仪器的小组数据都出现了这样一个问题,因此我们决定用另外一个仪器第二次测量。
表五 第一次测量的实验数据及相关计算数值(2)作图法求KΘHAc1/ΛmcΛm图三 第一次实验数据以1/Λm 对cΛm 作图求K ΘHAc 图四 第一次实验数据以1/Λm 对cΛm 作图拟合结果 根据拟合结果:直线的斜率为:36293.42452;直线的截距为:-266.69365 根据公式:因为截距为负值无法加入计算,因此用表三中25℃时的摩尔电导率代入计算:求得K ΘHAc =(1/0.03908)2/斜率=1.80*10-5通过查阅《普通化学原理》附表,知:25℃时,醋酸的K ΘHAc =1.75*10-5 相对误差:2.86%。
电导法测定弱电解质的电离常数

1. 了解溶液电导、电导率、摩尔电导率等基 本概念。 2. 掌握用电桥法测量溶液电导的原理和电导 率仪的使用及溶液电导测定方法。
3. 了解浓度对弱电解质电导的 影响,用电 导法测定醋酸的电离平衡常数。
实验原理
• 一定温度下,醋酸在水中发生电离,设电离前醋酸的浓度
为C( mol· L-1),达到电离平衡时,电离度为α,则:
3.
4. 5.
6.
测定完毕就让电极浸泡在二次水中。关闭各仪器电源、自来水开关, 结束实验。
数据记录与数据处理
• 1. 数据记录 • 实验温度:25±0.1℃ ,当天大气压: • 0.01000 mol· L-1标准KCl的 k=1.413mS· cm-1 • 其他原始数据记入表1中。 •
测试液
HAc(1) HAc(2) HAc(3) HAc(4) HAc(5) 二次水
图1. 测定电导率装置图 1.DDS-303A电导率仪;2.恒温瓶;3.铂黑电导电极; 4.待测溶液;5.恒温循环水;6.磁力搅拌器
实验步骤
1. 2. 调节恒温槽温度为25±0.2℃.打开电导率仪预热10min以上。 校准电导池常数:用标准KCl溶液分别润洗恒温瓶和铂黑电导电极, 然后用50ml量筒量取大概50ml的标准KCl溶液,倒入恒温瓶中, 打开磁力搅拌器,调节温度补偿,将电导率仪调节到测量档,测量 标准KCl溶液的电导率,等电导率仪读数稳定后,将读数调节到 1413μS/cm。 然后倒掉KCl溶液,用最小浓度的醋酸溶液润洗恒温瓶和电导电极, 然后倒50ml待测溶液入恒温瓶,待电导率仪读数稳定后,记下来 读数,即为此溶液的电导率。 重复3步,测量其他待测溶液的电导率值。 最后测量二次水的电导率。
kPa
表1 醋酸系列溶液的测定值及计算值
电导法测定弱电解质的电离常数.ppt

一、实验目的与要求 1、用电导法测量电解质溶液的电离平衡常数。 2、了解溶液的电导、电导率、摩尔电导率的基 本概念。 二、实验原理 电导是电阻的倒数,其物理意义是:当导体 两端的电位差为1伏特时所通过的电流强度。 在电导池的情况下,电导(G)的大小与两 电极之间的距离(L)成反比,与电极的面积 (A)成正比:
恒温10分钟进行测量其电导率。用同样方法 测定另两种浓度醋酸溶液的电导率。 4、测量完毕后,倒去醋酸液,洗净电导池及 铂黑电极,电导池中注入电导水,测其电导 率。 五、注意事项 温度对电导有很大的影响,所以整个实验必 须在同一温度下进行。 六、数据处理 1、计算各浓度醋酸溶液的摩尔电导率Λm, 电离度α,电离常数Kc。
2、298K时,无限稀释溶液中离子的无限稀 释离子摩尔电导率 Λm ∞ =349.8×10-4S· m2· mol-1, Λm ∞ =40.9×10- 4S· m2· mol-1。 七、思考题: 1、能否用电桥测电导? 2、实验中为何用镀铂黑电极?使用时应注意 哪些事项?
开关
电导率仪的结构
量程
显示屏
醋酸在溶液中电离达到平衡时,其电离平衡常数 (Kc)与浓度(C)和电离度(α)有如下关系:
c 2 Kc 1
(10-3)
在一定温度下Kc是一常数,因此可通过测定醋酸 在不同浓度下的电离度来计算Kc值。 根据电离学说,弱电解质的电离度α随溶液的稀释 而增大,当溶液无限稀释时,则弱电解质全部电离, 在一定温度下,溶液的摩尔电导与离子的真实浓度 成正比,因而也与电离度(α)成正比,所以弱电 解质的电离度(α)应等于溶液在浓度为C时的摩 尔电导率Λm 和溶液在无限稀释时的摩尔电导率Λm ∞ 之比,即:
G=A/L (10-1) Λ称为电导率,即L为1米2时溶液的电导,其值与电 导池的结构无关。 电解质溶液的电导不仅与温度有关,而且还与 溶液的浓度有关,因此通常用摩尔电导这个量值来 衡量电解质溶液的导电本领。 摩尔电导的定义如下:含有1摩尔电解质的溶 液全部置于相距为1米的两个电极之间,此时两电 极之间的电导率称为摩尔电导率( Λm )。摩尔电 导率与电导率之间有如下关系: Λm =Λ/C (10-2) 式中C为溶液的摩尔浓度。
实验2 电导法测定弱电解质的电离常数

实验二 电导法测定弱电解质的电离常数一、实验目的1. 掌握电导测量的原理和方法。
2. 学会使用 DDS-11A 型电导率仪,测定弱电解质电离平衡常数的方法。
二、实验原理AB 型(如HAc )弱电解质在溶液中的电离达到平衡时,HAc= H + + Ac - c(1-αc )cαccαc其电离平衡常数(K c )与浓度(c )、电离度(αc )之间有如下的关系:cc cc K αα-=12(1)在一定温度下K c 是常数,因此可以通过测定AB 型弱电解质在不同浓度时的αc ,代入上式就可以求出K c 。
醋酸溶液的电离度可用电导法测定,溶液的电导用电导率仪测定。
测定溶液的电导,要将被测溶液注入电导池中,如图1所示。
图1 浸入式电导池若两电极间距离为l ,电极的面积为A ,则溶液电导G 为:G=КA/1式中:К为电导率。
电解质溶液的电导率不仅与温度有关,还与溶液的浓度有关。
因此常用摩尔电导m λ来衡量电解质溶液的导电能力。
m λ与К之间的关系为:m λ=10-3К/c式中m λ的单位是S·m 2·mol -1,К的单位为S·m -1,c 的单位为mol·dm -3。
对于弱电解质,电离度αc 等于浓度为c 时的摩尔电导(m λ)和溶液在无限稀释时的摩尔电导(∞m λ )之比,即:∞=mmc λλα (2)将式(2)代入式(1):)(2m m m m cc c K λλλλ-=∞∞ cm κλ=∞∞-⋅=m c m c K cK λκλκ2)(以κ对κc 作图应为一直线,其斜率为2)(∞m c K λ ,截距为)(∞m c K λ ,根据斜率和截距可算出 K c 和∞m λ 。
三、仪器及试剂仪器:恒温装置 1套,DDS-11A 型电导率仪,电导电极,移液管(25 ml 、5 ml 和 1 ml 各 1支),容量瓶(50 ml 5只),250 ml 烧杯1只,洗耳球1只。
物化实验指导-电导法测定弱电解质的电离常数

实验二 电导法测定弱电解质的电离常数一、目的要求1.了解溶液的电导,电导率和摩尔电导率的基本概念。
2.学时用电导法测定醋酸的电离平衡常数。
3.掌握电导率仪的使用方法。
二、实验关键1.浓度和温度是影响电导的主要因素,故移液管和容量瓶必须清洗干净,浓度配制要准确;测定电导时电极必须与待测溶液同时一起恒温。
2.测电导水的电导时,铂黑电极要用电导水(去离子水)充分冲洗干净,测定中电极不可互换。
三.实验原理电解质溶液是靠正,负离子的迁移来传递电流。
而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。
在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为∞Λm ,而且可用离子极限摩尔电导率相加而得:∞-∞+∞Λ+Λ=Λ , , m m m∞+Λ , m 和∞-Λ , m 分别为无限稀释时的离子电导。
对乙酸在25℃时,∞Λm =349.82+409=390.8 S ·cm 2·mol -1。
一定浓度下的摩尔电导率m Λ与无限稀释的溶液中的摩尔电导率∞Λm 是有差别的。
这是由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。
所以m Λ通常称为表观摩尔电导率。
根据电离学说,弱电解质的电离度α随溶液的稀释而增大,当浓度c →0时,电离度α→1。
因此在一定温度下,随着溶液浓度的降低,电离度增加,离子数目增加,摩尔电导增加。
在无限稀释的溶液中α→1,m Λ→∞Λm ,故α=∞ΛΛmm 根据电离平衡理论,当醋酸在溶液中达到电离平衡时,其电离常数K 与初始浓度C 及电离度α在电离达到平衡时有如下关系:αα-=12C K 将α=∞ΛΛmm 代入上式,得到 )(2m m m m C K Λ-ΛΛΛ=∞∞ 在一定温度下,由实验测得不同浓度下的m Λ值,由上式可得C m Λ=K ∞Λm 2mΛ1-K ∞Λm 以C m Λ对mΛ1作图得一直线,其斜率为K ∞Λm 2 ,截距为K ∞Λm 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
斜率: 截距:
l • 实验时,先测已知电导率的标准KCl溶液的电导,由式 κ = G 实验时,先测已知电导率的标准 溶液的电导, 溶液的电导 A
• 求出电导池常数 仍由 Λm、
l 的电导, 。再依浓度顺序测出系列未知溶液 C 的电导, i A κ l 式求出未知溶液的电导率。再通过 式求出未知溶液的电导率。 Λm = 式求出 κ = G C A
测定装置示意图
图1. 测定电导率装置图 1.DDS-303A电导率仪;2.恒温瓶;3.铂黑电导电极; 电导率仪; 恒温瓶 恒温瓶; 铂黑电导电极 铂黑电导电极; 电导率仪 4.待测溶液;5.恒温循环水;6.磁力搅拌器 待测溶液; 恒温循环水 恒温循环水; 磁力搅拌器 待测溶液
实验步骤
1. 2. 调节恒温槽温度为25± ℃ 打开电导率仪预热 打开电导率仪预热10min以上。 以上。 调节恒温槽温度为 ±0.2℃.打开电导率仪预热 以上 校准电导池常数:用标准 溶液分别润洗恒温瓶和铂黑电导电极, 校准电导池常数:用标准KCl溶液分别润洗恒温瓶和铂黑电导电极, 溶液分别润洗恒温瓶和铂黑电导电极 然后用50ml量筒量取大概 量筒量取大概50ml的标准 的标准KCl溶液,倒入恒温瓶中, 溶液, 然后用 量筒量取大概 的标准 溶液 倒入恒温瓶中, 打开磁力搅拌器,调节温度补偿,将电导率仪调节到测量档, 打开磁力搅拌器,调节温度补偿,将电导率仪调节到测量档,测量 标准KCl溶液的电导率,等电导率仪读数稳定后,将读数调节到 溶液的电导率, 标准 溶液的电导率 等电导率仪读数稳定后, 1413µS/cm。 。 然后倒掉KCl溶液,用最小浓度的醋酸溶液润洗恒温瓶和电导电极, 溶液,用最小浓度的醋酸溶液润洗恒温瓶和电导电极, 然后倒掉 溶液 然后倒50ml待测溶液入恒温瓶,待电导率仪读数稳定后,记下来 待测溶液入恒温瓶, 然后倒 待测溶液入恒温瓶 待电导率仪读数稳定后, 读数,即为此溶液的电导率。 读数,即为此溶液的电导率。 重复3步 测量其他待测溶液的电导率值。 重复 步,测量其他待测溶液的电导率值。 最后测量二次水的电导率。 最后测量二次水的电导率。 测定完毕就让电极浸泡在二次水中。关闭各仪器电源、自来水开关, 测定完毕就让电极浸泡在二次水中。关闭各仪器电源、自来水开关, 结束实验。 结束实验。
由此可算出不同浓度的醋酸溶液的相关物理量,如表 由此可算出不同浓度的醋酸溶液的相关物理量,如表2 所示。 所示。
表2 醋酸系列溶液的理论计算值
测试液 HAc(1) HAc(2) HAc(3) HAc(4) HAc(5) Ci (mol·m-3) 1×10-2 × 1×10-1 × 1 1×101 × 1×102 ×
κi
(S·m-1)
Λm(i)(S·m2·mol-1) ( 2.782×10-2 × 1.331×10-2 × 4.851×10-3 × 1.605×10-3 × 5.149×10-4 ×
CΛm2(i) 7.740×10-6 × 1.772×10-5 × 2.353×10-5 × 2.576×10-5 × 2.651×10-5 ×
κi
κi
Λi
减小, 增加。 减小, 2 增加。当我们通 CΛ i
计算
Λi
,进而计算
CΛ2i
0.0002782 0.001331 0.004851 0.01605 0.05149
由表2可以看出,随着醋酸浓度的增加, 增加, 由表 可以看出,随着醋酸浓度的增加, 增加, 可以看出 过
时,由于数据一直在放大,故测定误差也在放大。 由于数据一直在放大,故测定误差也在放大。 CΛ2i Λi 因而,若不能把测定误差控制在一定范围, 因而,若不能把测定误差控制在一定范围, 就有可能不随 的减小而单 调增加。根据这一特性,我们完全有理由把那些反常实验点去掉。 调增加。根据这一特性,我们完全有理由把那些反常实验点去掉。
3.
4. 5. 6.
数据记录与数据处理
• 1. 数据记录 • 实验温度:25±0.1℃ ,当天大气压: 实验温度: ± ℃ 当天大气压: • 0.01000 mol·L-1标准 标准KCl的 k=1.413mS·cm-1 的 • 其他原始数据记入表 中。 其他原始数据记入表1中 •
测试液 HAc(1) HAc(2) HAc(3) HAc(4) HAc(5) 二次水
2
θ Λ∞ 和K c m
θ (3) 查阅相关文献,找出醋酸的 Λ∞ 、K c 及纯水的电导率,计算测 查阅相关文献, 及纯水的电导率, m
献值的百分误差。 定值与文 献值的百分误差。
注意事项
• 铂黑电导电极使用前要放在蒸馏水中活化 铂黑电导电极使用前要放在蒸馏水中活化24h • 磁力搅拌器的搅拌速度不能太快,以免打碎铂电 磁力搅拌器的搅拌速度不能太快, 极。 • 测量前电导率仪要预热 测量前电导率仪要预热10min以上 以上 • 换溶液时要先用待测溶液洗恒温瓶和铂黑电导电 极3次。 次 • 待电导率仪读数稳定后,再记读数 。 待电导率仪读数稳定后,
2 数据处理方法的理论分析
θ • 由文献知: Λ∞ = 3.907 ×10−2 (S ⋅ m2 ⋅ mol −1 ), Kc = 1.76 ×10−5 由文献知: m
故,截距 : b = Λ∞ = 3.907 ×10−2 (S ⋅ m2 ⋅ mol −1 ) m 斜率: 斜率:
1 k =− = −0.14543 ∞ θ KC ΛmC
物理化学实验讲义Βιβλιοθήκη 化学化工学院物理化学教研室
目的要求
1. 了解溶液电导、电导率、摩尔电导率等基 了解溶液电导、电导率、 本概念。 本概念。 2. 掌握用电桥法测量溶液电导的原理和电导 率仪的使用及溶液电导测定方法。 率仪的使用及溶液电导测定方法。 3. 了解浓度对弱电解质电导的 影响,用电 影响, 导法测定醋酸的电离平衡常数。 导法测定醋酸的电离平衡常数。
(
)
适用条件是什么? 适用条件是什么?
5. 实验过程中,为什么要恒温? 实验过程中,为什么要恒温? 6. 电极在 不使用时,应把它浸在蒸馏水中,为什 不使用时,应把它浸在蒸馏水中, 么?
实验参考
1 影响电导率测定值的因素分析 • 温度、浓度、仪器稳定性等因素都影响测定结果。 温度、浓度、仪器稳定性等因素都影响测定结果。 特别是在浓度很稀时,更为敏感,例如, 特别是在浓度很稀时,更为敏感,例如,新试剂 瓶若未经测试液长时间浸泡,也会引入误差。 瓶若未经测试液长时间浸泡,也会引入误差。因 此,实验中应确保被测溶液与试剂瓶的溶液浓度 一致;建议读数时尽量保持恒温槽温度一致, 一致;建议读数时尽量保持恒温槽温度一致,因 为恒温槽的温度常有0.1℃左右的波动。 为恒温槽的温度常有 ℃左右的波动。
kPa
表1 醋酸系列溶液的测定值及计算值
C(mol·L-1) ( 1×10-3 × 1×10-2 × 0.025 0.050 0.10 / / / (S·m-1) Λm(S·m2·mol-1) CΛm2 Kc
数据处理方法
(1) 运用式(3)计算 m后,再计算 m2。 运用式( )计算Λ 再计算CΛ 数据,弃去明显不合理的数据, (2) 分析 m、CΛm2数据,弃去明显不合理的数据,以Λm对 分析Λ 条直线,求出直线的斜率 和截距 和截距b,根据式( ) 条直线,求出直线的斜率k和截距 ,根据式(3)求出 作出一 CΛ m
思考题
1. 实验过程中,搅拌时应该注意什么问题? 实验过程中,搅拌时应该注意什么问题? 2. 简述电导率仪的使用方法,为什么测定溶液电导 简述电导率仪的使用方法, 要用交流电? 要用交流电 。 3. 为何要测电导池常数?如何测定? 为何要测电导池常数?如何测定? 4. 公式
c 2 Λm θ cθ Kc = ∞ ∞ Λm Λm − Λm
C 2 Λm θ θ 将其代入( ) 将其代入(1)式,得: Kc = ∞ C ∞ Λm Λm − Λm
(
)
即:
Λm = −
1 2 CΛm + Λ∞ m KC Λ∞ Cθ m
1 θ Kc Λ∞ Cθ (2) m b = Λ∞ m k =−
以Λm 对
CΛ m 作图,可得一条直线,其 作图,可得一条直线,
C 2 α θ θ Kc = C (cθ = 1mol ⋅ dm−3 ) (1) 1−α
• 醋酸的电离度可用电导法来测定。 醋酸的电离度可用电导法来测定。 • 一定温度下,摩尔电导与电离产生的离子浓度成正比,因而也与α成 一定温度下,摩尔电导与电离产生的离子浓度成正比,因而也与 成 正比, 正比,即: α = Λ Λ∞ m
实验原理
• 一定温度下,醋酸在水中发生电离,设电离前醋酸的浓度 一定温度下,醋酸在水中发生电离, 为C( mol·L-1),达到电离平衡时,电离度为 ,则: ,达到电离平衡时,电离度为α,
HAc
t=0 t=t 平 C C(1-α)
H+
0
+
Ac0 Cα
Cα
依标准电离平衡常数K 依标准电离平衡常数 θC 的定义 因此,只要测出 ,即可求出K 因此,只要测出α,即可求出 θC。
2 可由式( ) ,则KθC、Λm∞可由式(2)求得 CΛ m
Λ∞ = b m θ 1 Kc = − kbCθ
(3)
仪器和试剂
• DDS-303A型数字电导率仪 型数字电导率仪 • 恒温瓶 • 磁力搅拌器 • 恒温槽 • 滴管 • 铁架台 • 铂黑电导电极 • 量筒。 量筒。 醋酸系列溶液 (50ml) 二次水 标准KCl溶液(0.01000mol·L-1) 溶液( 标准 溶液
