高三化学电解质溶液电解后的ph变化规律
电化学中溶液酸碱性的变化规律

电化学中溶液酸碱性的变化规律【题记】电化学学习过程中,一些学生对两极区和溶液的酸碱性判断不清,现总结如下,仅供参考:溶液酸碱性的产生无非是三种情况:①H+的产生或消耗②OH-的产生或消耗③H2O的产生或消耗:一、H+的产生或消耗:产生H+,溶液酸性增强,PH降低;消耗H+,溶液酸性减弱,PH升高。
二、OH-的产生或消耗:产生OH-,溶液酸性减弱,PH升高;消耗OH-,溶液酸性增强,PH降低。
三、H2O的产生或消耗:产生H2O,则使溶液浓度降低,原溶液如果是酸,则酸性降低,PH升高;原溶液如果是碱,则碱性降低,PH降低。
消耗H2O,则使溶液浓度升高,原溶液如果是酸,则酸性增强,PH降低;原溶液如果是碱,则碱性增强,PH升高。
【例1】:氢氧燃料电池(1)如果电解质是H2SO4,正极:O2+ 4e-+ 4H+= 2H2O,消耗H+,则正极区酸性减弱,PH升高;负极:2H2- 4e-= 4H+,产生H+,则负极区酸性增强,PH降低;反应产物是水,则原电池中H2SO4浓度降低,总溶液酸性减弱,PH升高。
(2)如果电解质是KOH,正极:O2+ 4e-+ 2H2O = 4OH-,产生OH-,则正极区碱性增强,PH升高;负极:2H2- 4e-+4OH-= 4H2O ,消耗OH-,则负极区碱性减弱,PH降低;反应产物是水,则原电池中KOH 浓度降低,总溶液碱性减弱,PH降低。
【例2】:电解H2O(1)如果电解质是H2SO4,阳极:4OH-- 4e-= 2H2O + O2,消耗OH-,则阳极区酸性增强,PH降低;阴极:4H++ 4e- = 2H2,消耗H+,则阴极区酸性减弱,PH升高;反应中消耗水,则电解池中H2SO4浓度增大,总溶液酸性增强,PH降低。
(2)如果电解质是KOH,阳极:4OH-- 4e-= 2H2O + O2,消耗OH-,则阳极区碱性减弱,PH降低;阴极:4H++ 4e- = 2H2,消耗H+,则阴极区碱性增强,PH升高;反应中消耗水,则电解池中KOH浓度增大,总溶液碱性增强,PH升高。
2025届高三化学一轮复习,电解质溶液中的三大守恒

c X
2−
的H2A、HA 、A 的物质的量分数 (X)随pH的变化如图所示[已知 (X) = c H A + c HA− + c A2−
2
下列叙述错误的是( D )
A.pH=1.2时,c(HA-)=c(H2A)
B.常温下,H2A的电离平衡常数Ka2=10−4.2
C.pH=2.7时,c(HA−)>c(H
两式联立消去K+
质子守恒:2c(H+)+c(HC2O4-)+3c(H2C2O4)=c(C2O42-)+2c(OH-)
质子守恒
在电解质溶液中由于电离、水解等过程的发生,往往存在质子(H+)的
转移,溶液中分子或离子得到质子(H+)的总数 = 失去质子(H+)的总数
溶液中水电离出的H+个数与水电离出的OH-个数相等
③ KHC2O4溶液
④ KHC2O4:K2C2O4=1:1混合溶液
⑤ K2C2O4溶液
物料守恒
特点及适用
物料守恒书写方法
③KHC2O4溶液
K+ :C2O42-=1:1
H2C2O4 HC2O4-
C2O42-
整理得:c(K+)= c(H2C2O4) +c(HC2O4-) +c(C2O42-)
④KHC2O4:K2C2O4=1:1混合溶液
②多元弱酸根分步水解,主要是第一步水解
电荷守恒
1、什么是电荷守恒?
2、如何才能正确书写电荷守恒?
电解质溶液呈电中性
阳离子所带正电荷总数 = 阴离子所带负电荷总数
根据电离和水解找出溶液中所有离子
n(电荷) = n(离子) x 离子所带电荷数
高中化学知识点-化学反应原理-电解质溶液-溶液pH的定义

pH的含义pH是表示水溶液的酸碱度大小的数值,它是以水溶液中氢离子浓度的数量级作为标度的。
pH的应用范围在0——14之间。
水是最常用的溶剂,用精密仪器测定,纯水也有极其微弱的导电能力。
这是由于水发生了自偶电离H2O+H2OH3O++OH-可以简写成H2OH++OH-在纯水中,H+和OH-的数目相等,所以纯水不显酸性或碱性而呈中性。
但不能说中性的纯水中并不含有H+和OH-。
按质量作用定律,水中的H+和OH-在浓度之间存在下列关系:由于水的电离极其微弱,可把达到平衡时的[H2O]看作常数[H+][OH-]=[H2O]K=K wK w称为水的离子积常数,它表明在一定温度下水中H+和OH-的浓度关系。
经测定,在22℃时,K w=×10-14;50℃时,K w=×10-14;100℃时,K w=×10-13。
可以看出K w值随温度的升高而增大。
这是因为水在电离时要吸收一定的能量,温度高时比较容易电离的缘故。
一般为了便于计算,在常温下可以认为K w=1×10-14。
如果在水中加入了其它电解质,有时会引起水的电离平衡的移动,H+和OH-的浓度发生改变,即一个增大另一个减小,但达到新的平衡时,仍保持[H+][OH-] =10-14。
根据水的离子积,就可以定量地说明水溶液的酸碱性:在纯水或中性溶液中[H+]=[OH-]=10-7mol·L-1在酸性溶液中[H+]>[OH-] [H+]>10-7mol·L-1在碱性溶液中[H+]<[OH-] [H+]<10-7mol·L-1总之,水的离子积说明,无论是纯水还是水溶液,无论是酸性溶液还是碱性溶液,只要有水存在就同时存在着H+和OH-,[H+]及[OH-]两者的乘积始终保持常数。
因此,知道了H+浓度就可以知道OH-浓度。
为统一起见,一般常用H+的浓度来表示溶液的酸碱度,H+浓度越大,溶液的酸性越强,而OH-浓度越小。
高三化学电解原理及用

质对市爱慕阳光实验学校高三化学电解原理及用【本讲信息】一. 教学内容:电解原理及用二. 教学目标理解电解原理,掌握电极反式的书写及电解原理的用三. 教学、难点电解原理[教学过程]一、电解原理:电解是电流通过电解质溶液而在阴、阳两极发生氧化复原反的过程;电解池是将电能转化为化学能的装置;构成条件为:必须连接有直流电源,要有电极〔阴、阳极〕,以及电解质溶液或熔融电解质。
在电解过程中与电源正极相连的极称为阳极,在阳极上发生氧化反;与电源负极相连的极称为阴极,在阴极上发生复原反;电解质溶液中的阴离子移向阳极,阳离子移向阴极。
说明:1、电解质溶液的导电过程实质上就是其电解过程。
在电解池中电子流向:电子由电源的负极→电解池的阴极,再由电解质溶液→电解池的阳极→电源正极。
溶液中离子的移动方向:溶液离子向阴极移动,阴离子向阳极移动。
2、电解与电离的比拟:3有外加电源的装置一是电解池,无外加电源的装置一是原电池, 多池组合时, 一般是含有活泼金属的池为原电池,其余都是在原电池带动下工作的电解池;假设最活泼的电极相同时,那么两极间活泼性差异较大的是原电池,其余为电解池。
4、电解池的反原理:放电:阳离子得到电子或阴离子失去电子。
离子放电的顺序取决于离子的本性,也与离子浓度和电极材料有关。
〔1〕阳极产物的判断先看电极,假设是活泼电极〔金属活动顺序表Ag以前,包含Ag〕,电极放电,溶液中的阴离子不放电;假设是惰性电极〔如铂、石墨〕,那么看溶液中阴离子的失电子能力。
在惰性电极上,阴离子放电顺序为:〔2〕阴极产物的判断:直接根据阳离子放电顺序进行判断,阳离子放电顺序为:注意:高价含氧酸根离子一般不放电5、分析电解问题的根本思路:通电前:电解质溶液中含有哪些阴、阳离子〔包括水电离出的H+和OH-〕。
通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先放电。
写电极反式,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的变化、pH变化。
电解质溶液的pH值实验研究

电解质溶液的pH值实验研究一、引言电解质溶液的pH值是描述其酸碱性质的重要指标之一。
通过实验研究电解质溶液的pH值,可以深入了解溶液中离子浓度和酸碱平衡的相关特性。
本文将进行电解质溶液的pH值实验研究,探究不同条件下溶液pH值的变化规律。
二、实验目的本实验旨在研究不同电解质溶液的pH值,并通过调节浓度、温度等条件,探究其对pH值的影响。
三、实验原理1. pH值的定义:pH值是用来表示溶液酸碱性的指标,其数值范围从0到14,数值越小表示酸性越强,越大表示碱性越强,7表示中性。
2. pH值的计算公式:pH = -log[H+],其中[H+]代表溶液中的氢离子浓度。
四、实验步骤1. 准备工作:a. 清洗实验仪器,确保无任何杂质;b. 准备所需的电解质溶液和浓度计量器具。
2. 实验一:不同浓度溶液的pH值测定a. 分别取一定量的电解质溶液,并分别稀释成不同浓度的溶液,如0.1 mol/L、0.05 mol/L、0.01 mol/L等;b. 使用pH计测定每个溶液的pH值,并记录数据;c. 绘制浓度与pH值的关系曲线。
3. 实验二:温度对溶液pH值的影响a. 取一种电解质溶液,如NaCl溶液;b. 在不同温度下,测定该溶液的pH值,并记录数据;c. 分析温度变化对pH值的影响规律。
五、实验结果与分析1. 实验一的结果:根据实验数据绘制的浓度与pH值的关系曲线,我们可以看出溶液浓度越低,pH值越接近中性,表明溶液的酸性或碱性较弱。
随着溶液浓度的增加,pH值逐渐偏向酸性或碱性方向。
2. 实验二的结果:实验结果显示,随着温度的升高,溶液的pH值呈现出不同的变化规律。
具体而言,一些电解质溶液的pH值随着温度的升高而减小,而另一些电解质溶液则呈相反趋势。
这是因为在不同溶剂和温度下,电解质溶液的酸碱性质可能发生改变。
六、实验结论通过本次实验研究,我们得出以下结论:1. 电解质溶液的pH值与溶液浓度呈正相关关系,浓度越高,pH值越偏离中性。
高中化学电离平衡九大知识点

高中化学电离平衡九大知识点一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中或熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
2、电解质与非电解质本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4 为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程就达到了平衡状态,这叫电离平衡。
4、影响电离平衡的因素:A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
5、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主)6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。
)表示方法:ABA++B- Ki=[ A+][B-]/[AB]7、影响因素:a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。
如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO二、水的电离和溶液的酸碱性1、水电离平衡:水的离子积:KW= c[H+]·c[OH-]25℃时,[H+]=[OH-] =10-7 mol/L ; KW= [H+]·[OH-] = 1*10-14注意:KW只与温度有关,温度一定,则KW值一定KW不仅适用于纯水,适用于任何溶液(酸、碱、盐)2、水电离特点:(1)可逆(2)吸热(3)极弱3、影响水电离平衡的外界因素:①酸、碱:抑制水的电离 KW〈1*10-14②温度:促进水的电离(水的电离是吸热的)③易水解的盐:促进水的电离 KW 〉1*10-144、溶液的酸碱性和pH:(1)pH=-lgc[H+](2)pH的测定方法:酸碱指示剂——甲基橙、石蕊、酚酞。
高中化学复习知识点:电解过程中溶液pH的变化
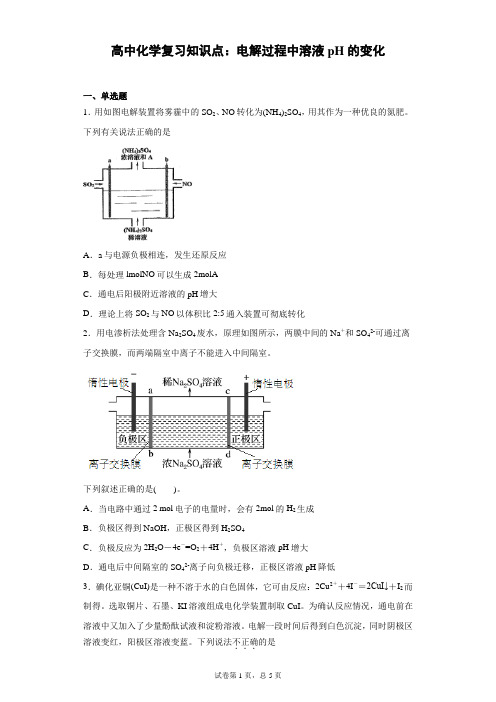
一、单选题
1.用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
A.a与电源负极相连,发生还原反应
B.每处理lmolNO可以生成2molA
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2:5通入装置可彻底转化
A.废水处理过程中,Y电极上发生氧化反应
B.废水处理过程中,X电极附近溶液酸性减弱
C.废水处理过程中,W电极反应式为O2+4e-+4H+=2H2O
D.若消耗7gLi则质子交换膜左侧电解质溶液减少 g
二、多选题
9.我国科研工作者研发了电解熔融甲硫醇钠(CH3SNa)制备杀虫剂CH3-S-S-CH3的方法,克服了常规合成法造成的污染,并大幅度提高了原料转化率。基本原理如图所示,A、B为惰性电极,CH3-S-S-CH3在A电极产生,下列说法错误的是()
A.铜片做阳极,石墨做阴极
B.白色沉淀在靠近阳极处产生
C.阴极区溶液变红的原因:2H++2e-=H2↑,促进H2O电离,c(OH-)升高
D.阳极区溶液变蓝的原因:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2,I2遇淀粉变蓝
4.用惰性电极电解浓度均为0.1mol/L的下列溶液。电解一段时间后停止通电并搅拌混匀,电解前后溶液pH保持不变的是
【详解】
A.电极a为阳极,与电源正极相连,发生氧化反应,故A错误;
B.电解池的总反应为5SO2+2NO+8H2O (NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4,即A为硫酸,根据方程式,消耗1mol的NO生成2mol的硫酸,故B正确;
化学反应中的电解质酸碱度

化学反应中的电解质酸碱度酸碱度是化学反应中一个重要的性质,它决定了反应的进行和速率。
在化学反应过程中,电解质的存在和酸碱性质的改变会对反应的平衡和速率产生显著的影响。
本文将探讨化学反应中电解质的酸碱度,并讨论其在不同反应中的应用。
一、电解质的酸碱性质电解质是能在溶液中析出离子的化合物,可以分为酸性电解质和碱性电解质两类。
酸性电解质在水中溶解时会释放出H+离子,而碱性电解质则会释放出OH-离子。
电解质的酸碱性质主要取决于其中的离子种类及其浓度。
酸性电解质的酸碱度通常由酸度(酸解离常数)来衡量,酸度越大,其产生的H+离子浓度越高,酸性也就越强。
例如,HCl是一种强酸,其酸度非常大,水中的HCl几乎完全解离成H+和Cl-离子。
而弱酸如乙酸在水中只发生少量解离,其酸度相对较小。
碱性电解质的碱度(碱解离常数)表示其产生OH-离子的能力,碱度越大,产生的OH-离子浓度越高,碱性也就越强。
例如,NaOH是强碱,完全溶解后能够产生大量的OH-离子。
二、电解质酸碱度在酸碱反应中的应用1. 酸中和反应酸中和反应是一种重要的化学反应,其涉及酸性物质和碱性物质的反应。
在酸中和反应中,酸和碱发生中和反应产生盐和水。
酸中和反应的进行与反应物的酸碱度有关。
当酸的酸度与碱的碱度相等时,称为等克分子中和。
此时,酸和碱中的H+和OH-离子完全中和,产生水。
例如,HCl(酸)与NaOH (碱)的中和反应为HCl + NaOH → NaCl + H2O。
2. 酸碱指示剂酸碱指示剂是一类能够根据溶液的酸碱度发生颜色变化的物质。
它们常用于酸碱滴定中的终点检测。
不同酸碱指示剂的变色范围与不同的pH值相关。
常见的酸碱指示剂如酚酞、溴酚蓝和甲基橙等具有不同的变色范围。
例如,酚酞在pH值为8.2-10之间呈现红色,而在pH值低于7时呈现无色。
通过选择适当的酸碱指示剂,可以准确地确定滴定终点,从而实现对物质酸碱度的测定。
3. 酸碱催化剂酸碱催化剂是一种能够促进化学反应进行的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解质溶液电解后的pH变化规律
(1)电解电解质本身(水不参与反应)
①电解无氧酸:电解无氧酸溶液,只是电解电解质本身,电解质溶液中的水不参与反应。
如电解盐酸,就是电解HCl
由于电解质不断减少,溶剂不发生变化,则浓度变小,所以[H+]比原酸溶液小,pH 升高
②电解不活泼金属无氧酸盐:只是电解电解质本身,水不参与。
如电解CuCl2溶液,就是电解CuCl2本身
CuCl2为强酸弱碱盐,Cu2+水解,使溶液[H+]>[OH-],在电解时由于Cu2+转化成Cu,[Cu2+]不断减少,pH增大。
(2)电解电解质和水
①电解活泼金属无氧酸盐:电解质和水均参与反应。
如电解NaCl溶液
由于生成物中生成强碱,故溶液的pH升高。
②电解不活泼金属含氧酸盐:电解质和水均参与了反应。
如电解CuSO4溶液
由于生成物中生成强酸,故溶液的pH减小。
(3)电解水
①电解含氧酸:只是电解水。
如电解稀H2SO4
由于溶质不发生变化,而水(溶剂)不断减少,则[H+]不断增大,pH减小。
②电解可溶性强碱:只是电解水。
如电解NaOH溶液
(溶剂)不断减少,则[OH-]不断增大,pH升高。
③电解强碱含氧强酸盐:只是电解水。
如电解Na2SO4溶液
由于溶质不发生变化,水(溶剂)不断减少,溶液浓度增大,但由于该物为强酸强碱盐不发生水解,无论反应前或反应后,pH均为7,不会发生变化。
