高中化学 竞赛培训讲义 电解质溶液和电离平衡
5电解质溶液和电离平衡[131页]
![5电解质溶液和电离平衡[131页]](https://img.taocdn.com/s3/m/47a01da1551810a6f52486fc.png)
第五章 电解质溶液和电离平衡
酸碱溶剂理论中,酸和碱并不是绝对的,在一种溶剂中 的酸,在另一种溶剂中可能是一种碱。
成功之处:把以水为溶剂的个别现象,推广到适用更多 溶剂的一般情况,因此大大扩展了酸和碱的范围。
局限性:酸碱溶剂理论对于一些不电离的溶剂以及无溶 剂的酸碱体系,则无法说明。
电解质
在水溶液中或熔融状态时能够导电的化合物, 如酸、碱、盐、水、活泼金属氧化物。
非电解质 在水溶液中和熔融状态都不能导电的化合物, 如非金属氧化物(CO2、SO2)、某些非金属 氢化物(NH3)、绝大多数有机物(如酒精、 蔗糖)等。
武汉理工大学出版社
第五章 电解质溶液和电离平衡
注意
1.单质
既不是电解质也不是非电解质。
酸:凡是能给出质子(H+)的物质。 碱:凡是能接受质子的物质。 按照酸碱质子理论,酸和碱不是孤立存在的,酸给出质 子后剩下的部分就是碱,碱接受质子后就成为酸,因此当酸 失去一个质子而形成的碱称为该酸的共轭碱,而碱获得一个 质子后就生成了该碱的共轭酸。由得失一个质子而发生共轭 关系的一对酸和碱称为共轭酸碱对,也可直接称为酸碱对。
武汉理工大学出版社
本章教学目标
1.了解电解质的基本概念; 2.掌握缓冲溶液的概念及作用原理; 3.理解同离子效应和盐效应对电离平衡的影 响; 4.掌握弱酸、弱碱、缓冲溶液以及盐类溶液 pH的计算方法; 5.掌握溶度积原则在判断难溶电解质在沉淀 -溶解平衡中的应用; 6.熟悉分步沉淀的原理及应用。
武汉理工大学出版社
例如:在液氨中,氨基化钾KNH2使酚酞变红而显碱性, 水溶液中NaCO3、NH3·H2O显碱性,HSO4-是酸是碱等,酸 碱电离理论都无法解释。
武汉理工大学出版社
强弱电解质及电离平衡ppt课件

变:条件改变时,电离平衡发生移动 —勒夏特列原理
强电解质和弱电解质
弱电解质电离的特点
1.电离过程是吸热的。
2.弱电解质的电离属于可逆过程,分子、离子共存。
3.弱电解质在溶液中的电离都是微弱的。
如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。
【结论】
• HCl 分子在水中完全电离;
• CH3COOH 分子在水中部分电离,且非常微弱。
强电解质和弱电解质
强电解质
电解质
在水溶液里全部电离成离子
①强酸:HCl、H2SO4等;②强碱:NaOH、Ca(OH)2等
③绝大多数盐:如NaCl、BaSO4等
④活泼金属氧化物:Na2O、CaO等
弱电解质
在水溶液里只有部分分子电离成离子
选项
强电解质
弱电解质
非电解质
A
NaCl
HF
Cl2
B
NaHSO4
NaHCO3
CCl4
C
Ba(OH)2
HCl
Cu
D
AgCl
H2 S
C2H5OH
随堂训练
2.将1 mol冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项
中,表明已达到电离平衡状态的是( D
)
A.CH3COOH的浓度达到1 mol·L-1
NH3、SO2、CO2 ;
3.电解质的导电:导电的条件是溶于水或熔融状态;
4.导电的本质是自由离子的定向移动;
5.导电能力与离子浓度和离子所带电荷有关。
强电解质和弱电解质
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,
高中化学 竞赛培训讲义 电解质溶液和电离平衡

电解质溶液和电离平衡【竞赛要求】酸碱质子理论。
弱酸、弱碱的电离常数。
缓冲溶液。
利用酸碱平衡常数的计算。
溶度积原理及有关计算。
离子方程式的正确书写。
【知识梳理】一、酸碱质子理论(Bronsted 理论)最初阶段人们从性质上认识酸碱。
酸:使石蕊变红,有酸味; 碱:使石蕊变蓝,有涩味。
当酸碱相混合时,性质消失。
当氧元素发现后,人们开始从组成上认识酸碱,以为酸中一定含有氧元素;盐酸等无氧酸的发现,又使人们认识到酸中一定含有氢元素。
阿仑尼乌斯(Arrhenius )的电离学说,使人们对酸碱的认识发生了一个飞跃。
HA = H ++ A - 电离出的正离子全部是 H + ;MOH = M + + OH - 电离出的负离子全部是 OH -。
进一步从平衡角度找到了比较酸碱强弱的标准,即a K 、b K 。
阿仑尼乌斯理论在水溶液中是成功的,但其在非水体系中的适用性,却受到了挑战。
例如:溶剂自身的电离和液氨中进行的中和反应,都无法用阿仑尼乌斯的理论去讨论,因为根本找不到符合定义的酸和碱。
为了弥补阿仑尼乌斯理论的不足,丹麦化学家布仑斯惕(Bronsted )和英国化学家劳里(Lowry )于1923年分别提出了酸碱质子理论。
1、酸碱的定义质子理论认为:凡能给出质子(H +)的物质都是酸;凡能接受质子的物质都是碱。
如HCl ,NH +4,HSO -4,H 2PO -4等都是酸,因为它们能给出质子;CN -,NH 3,HSO -4,SO -24都是碱,因为它们都能接受质子。
为区别于阿仑尼乌斯酸碱,也可专称质子理论的酸碱为布仑斯惕酸碱。
由如上的例子可见,质子酸碱理论中的酸碱不限于电中性的分子,也可以是带电的阴阳离子。
若某物质既能给出质子,又能接受质子,就既是酸又是碱,可称为酸碱两性物质,如HCO -3等,通常称为酸式酸根离子。
2、酸碱的共轭关系质子酸碱不是孤立的,它们通过质子相互联系,质子酸释放质子转化为它的共轭碱,质子碱得到质子转化为它的共轭酸。
第三章电解质溶液和电离平衡优秀课件

K a2
[H ][CO32 ] [HCO3 ]
5.6 1011
∵H2CO3 的 K a1 » K a2 ,[HCO3-]≈[H+]
∴[CO32 ] Ka2 5.61011
答:[H+]=[HCO3-]=1.3×10-4mol/L,[CO32-]=5.6×10-11mol/L。
结论:
[例 3-2]室温时,碳酸饱和溶液的物质的量的浓度约为 0.04mol/L,求此
溶液中 H+、HCO3-和 CO32-离子的浓度。(已知 K a1 =4.3×10-7, K a2 =5.6×10-11)
解:由于 H2CO3 的 K a1 » K a2 ,可忽略二级离解,当一元酸处理。
设溶液中[H+]=xmol/L,则[HCO3-]≈[H+]=xmol/L
H2CO3≒H++HCO3-
C 起始
0.04 0
0
C 平衡 0.04-x x
x
K a1
[H ][HCO3 ] [H 2CO3 ]
x2 0.04 x
4.3 107
∵c/ K a >500,可以用近似值计算 ∴0.04-x≈0.04mol/L。
x [H ] 4.3107 0.04 1.3104 mol/L
Kwθ水的离子积常数,在一定的温度下是一个常数 。
2.溶液的酸碱性和pH值
pH值的概念: 氢离子浓度的负对数叫做pH值
pHlgH [ ]
pOH值的概念: 氢氧根离子浓度的负对数叫pOH值。
pOHlgO [ H ]
pH pOH 14
25℃时,pH + pOH = pKw =14(25℃)
[H+] ≤ 1mol/L,[OH-] ≤ 1mol/L时 : [H+] = [OH-]时, 中性, [H+] = 10-7 ,pH = 7 [H+] ﹥ [OH-]时,酸性, [H+]﹥10-7 ,pH ﹤7 [H+] ﹤ [OH-]时,碱性, [H+]﹤10-7,
高三化学 电解质溶液(一)——电离平衡 知识精讲 通用版
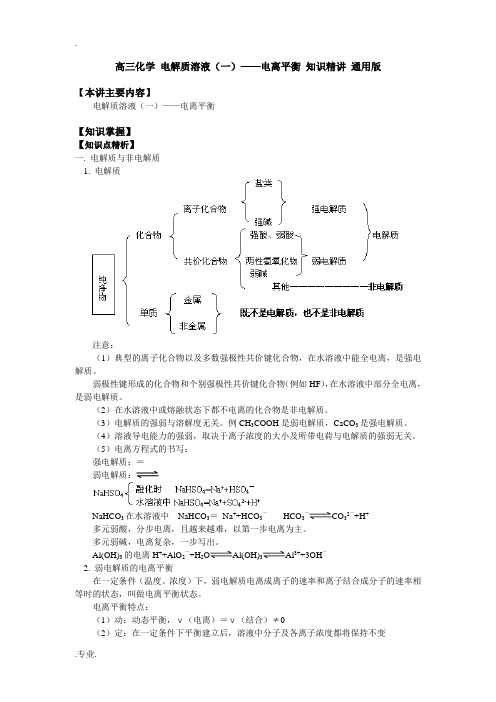
高三化学电解质溶液(一)——电离平衡知识精讲通用版【本讲主要内容】电解质溶液(一)——电离平衡【知识掌握】【知识点精析】一. 电解质与非电解质1. 电解质注意:(1)典型的离子化合物以及多数强极性共价键化合物,在水溶液中能全电离,是强电解质。
弱极性键形成的化合物和个别强极性共价键化合物(例如HF),在水溶液中部分全电离,是弱电解质。
(2)在水溶液中或熔融状态下都不电离的化合物是非电解质。
(3)电解质的强弱与溶解度无关。
例CH3COOH是弱电解质,CaCO3是强电解质。
(4)溶液导电能力的强弱,取决于离子浓度的大小及所带电荷与电解质的强弱无关。
(5)电离方程式的书写:强电解质:=弱电解质:NaHCO3在水溶液中NaHCO3=Na++HCO3-HCO3-CO32-+H+多元弱酸,分步电离,且越来越难,以第一步电离为主。
多元弱碱,电离复杂,一步写出。
Al(OH)3的电离H++AlO2-+H2O Al(OH)3Al3++3OH-2. 弱电解质的电离平衡在一定条件(温度、浓度)下,弱电解质电离成离子的速率和离子结合成分子的速率相等时的状态,叫做电离平衡状态。
电离平衡特点:(1)动:动态平衡,ν(电离)=ν(结合)≠0(2)定:在一定条件下平衡建立后,溶液中分子及各离子浓度都将保持不变(3)变:平衡建立在特定条件下,当条件发生改变时,平衡发生相应的移动影响电离平衡的因素:电离平衡是化学平衡的一种,化学平衡的所有原理都适合于电离平衡。
电离平衡的移动,符合勒夏特列原理。
(1)温度的影响:弱电解质的电离是吸热过程,升高温度,会促进电离(2)浓度的影响:溶液浓度越小,越有利于电离。
如加水稀释,会促进电离(3)同离子效应:加入与弱电解质具有相同离子的强电解质,会抑制弱电解质的电离(4)能反应的离子:加入与弱电解质电离出的离子能反应的离子,会促进弱电解质的电离3. 水的电离和溶液的pH(1)水的电离水是极弱的电解质H2O H++OH-或2H2O H3O++OH-25℃时纯水中c(H+)=c(OH-)=10-7mol/L(2)水的离子积常数25℃时,K W=c(H+)·c(OH-)=10-14K W叫做水的离子积常数,简称水的离子积。
电解质溶液和电离平衡

多元弱酸、弱碱的解离平衡 多元弱酸弱碱分步解离,每一步都有相应的解离平衡。
以H3PO4为例: Ka1 = [c(H+)/c][c(H2PO4-)/c]/ [c(H3PO4)/c] = 7.52×10-3、 Ka2 = [c(H+)/c][c(HPO42-)/c]/[c(H2PO4-)/c] = 6.23×10-8、 Ka3 = [c(H+)/c][c(PO43-)/c]/[c(HPO42-)/c] = 2.2×10-13; 一般地:Ka1:Ka2:Ka3 = 1:10-5:10-10。
[Cu(H2O)4]2+-[Cu(H2O)3(OH)]+
[Cu(H2O)3(OH)]+ =H+ + [Cu(H2O)2(OH)2]+
[Cu(H2O)3(OH)]+
[Cu(H2O)3(OH)]+
[Cu(H2O)3(OH)]+-[Cu(H2O)2(OH)2]+
酸、碱可以是分子、阳离子或阴离子。
活度(表示组分的有效浓度)a = γ·c, γ表示溶液中离子活动的有效程度称为活度系数 “离子氛”概念 当溶液无限稀释时,γ = 1,离子活动的自由度接近于100%;不过,一般将强电解质在稀溶液中的离子浓度以100%解离计算。
3.2、弱电解质的解离平衡
1、一元弱酸、弱碱的解离平衡:
AB = A+ + B- KAB = [c(A+)/c][c(B-)/c]/[c(AB)/c], KAB称为解离常数,与其它平衡常数一样也不随浓度而变,仅是温度的函数。对于一元弱酸或弱碱,则分别称为Ka和Kb,它们不仅可以通过实验来测定,还可以应用热力学数据计算得到。
高中化学竞赛-电离平衡

KaC=[H+]2
[H+] =KaC
Ka ——— C
此式表明,在一定温度下, 浓度越稀,电离度越大。
上述电离度和浓度的关系式称稀释定律
3-2 多元弱酸的电离
一、多元弱酸的电离是分步进行的
<1> H2S <2> HS<1>+<2>: H2S 溶液的酸度主 要来自弱酸的 第一步电离 第二步电离远 比第一步小 水电离的H+ 浓度是 H+ + HSH+ + S22H+ + S2K1 = 5.7×10-8 K2 = 1.2×10-15 K = K1×K2 = 6.8×10-23 饱和H2S的浓度约 为0.1 mol·L-1)
多层平 衡规则
Kw=Ka×Kb
在共轭酸碱对中,Ka越大,Kb越小。不同一元弱酸, Ka越大,电离度越大,酸性越强。
二.解离度(电离度,α )
1.弱电解质的解离度, α = ——————————×100% 电离前的浓度 又称电离度, 用α 表示 例1.(P85) 298K时,HAc的电离常数为1.76×10-5。计 算0.10 mol·L-1 HAc溶液的H+离子浓度和解离度。 解: HAc H+ + Ac电离前浓度/mol· -1 L 0.10 0 0 电离后浓度/mol· -1 0.10 - [H+] [H+] [Ac-] = [H+] L [H+]2 [H+] = Ka×(0.10 - [H+]) Ka = —— [HAc] [H+] = 1.76×10-5×0.10 因为Ka很小, 0.10 - [H+]≈0.10 =1.33×10-3 mol· -1 L +] -3 [H 1.33×10 α = ——×100% = ———— = ×100% = 1.33% CHAc 0.1 被电离的浓度
电解质溶液及电离平衡课件修订稿

电解质溶液及电离平衡课件集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]电解质溶液及电离平衡一、强电解质和弱电解质1.强、弱电解质强电解质:溶液和熔融状态下,完全电离的物质:如NaCl、Al(OH)3。
弱电解质:溶液和熔融状态下,不完全电离的物质:如H2S、H2CO3。
一般而言,强酸强碱和所有的盐都是强电解质,弱酸弱碱都弱电解质。
2.弱电解质的电离平衡⑴电离平衡:类似化学平衡反应,弱电解质的电离反应是可逆的。
当达到反应物和生成物的浓度不变时,达到平衡。
这个平衡是动态平衡的。
⑵电离平衡的特征:1、是一个可逆反应,在一定条件下,达到一个平衡点,有一个K值。
2、平衡受反应物和生成物的量的影响,当改变生成物和反应物的浓度时,平衡值也会改变。
3、电离反应是吸热反应,因此改变温度对平衡也有影响。
二、水的离子积和溶液的PH写出水的电离方程式。
在纯水及任何稀溶液中, 2H2O——H3O++OH- 可简写为:H2O—— H+ + OH-1、水的离子积常数25℃Kw = c(H+)·c(OH-)=10-14(常数)其中,25℃时,c(H+)=c(OH-)=10-7mol·L-1讨论:1、在纯水中加入酸(或碱)时,对水的电离有怎样的影响2、给纯水加热,其中c(H+)、c(OH-)如何变化3、在c(H+)=10-2的盐酸中,OH-浓度是多少其中水电离出来的H+浓度是多少2.溶液的酸碱性和PHPH = - lgc(H+)当C(H+)10—7mol/L PH 7 溶液呈酸性当C(H+)10—7mol/L PH 7 溶液呈中性当C(H+)10—7mol/L PH 7 溶液呈碱性讨论:1、常温下,稀溶液中,pH+pOH=2、你认c(H+)在什么范围内,用pH来表示溶液的酸碱性比较方便3、pH的测定方法:(1)广范pH试纸、精密pH试纸(2)酸碱指示剂 3)pH计石蕊5 ~ 8、酚酞8 ~10、甲基橙~红.紫.蓝无.粉红.红红.橙.黄4、PH相关计算例1:pH=12的NaOH溶液1mL加水稀释至100mL,pH ;pH=5的HCl 溶液1mL加水稀释至1000mL,pH 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解质溶液和电离平衡【竞赛要求】酸碱质子理论。
弱酸、弱碱的电离常数。
缓冲溶液。
利用酸碱平衡常数的计算。
溶度积原理及有关计算。
离子方程式的正确书写。
【知识梳理】一、酸碱质子理论(Bronsted 理论)最初阶段人们从性质上认识酸碱。
酸:使石蕊变红,有酸味; 碱:使石蕊变蓝,有涩味。
当酸碱相混合时,性质消失。
当氧元素发现后,人们开始从组成上认识酸碱,以为酸中一定含有氧元素;盐酸等无氧酸的发现,又使人们认识到酸中一定含有氢元素。
阿仑尼乌斯(Arrhenius )的电离学说,使人们对酸碱的认识发生了一个飞跃。
HA = H + + A - 电离出的正离子全部是 H + ;MOH = M + + OH - 电离出的负离子全部是 OH -。
进一步从平衡角度找到了比较酸碱强弱的标准,即a K 、b K 。
阿仑尼乌斯理论在水溶液中是成功的,但其在非水体系中的适用性,却受到了挑战。
例如:溶剂自身的电离和液氨中进行的中和反应,都无法用阿仑尼乌斯的理论去讨论,因为根本找不到符合定义的酸和碱。
为了弥补阿仑尼乌斯理论的不足,丹麦化学家布仑斯惕(Bronsted )和英国化学家劳里(Lowry )于1923年分别提出了酸碱质子理论。
1、酸碱的定义质子理论认为:凡能给出质子(H +)的物质都是酸;凡能接受质子的物质都是碱。
如HCl ,NH +4,HSO -4,H 2PO -4等都是酸,因为它们能给出质子;CN -,NH 3,HSO -4,SO -24都是碱,因为它们都能接受质子。
为区别于阿仑尼乌斯酸碱,也可专称质子理论的酸碱为布仑斯惕酸碱。
由如上的例子可见,质子酸碱理论中的酸碱不限于电中性的分子,也可以是带电的阴阳离子。
若某物质既能给出质子,又能接受质子,就既是酸又是碱,可称为酸碱两性物质,如HCO-3等,通常称为酸式酸根离子。
2、酸碱的共轭关系质子酸碱不是孤立的,它们通过质子相互联系,质子酸释放质子转化为它的共轭碱,质子碱得到质子转化为它的共轭酸。
这种关系称为酸碱共轭关系。
可用通式表示为:酸碱+质子,此式中的酸碱称为共轭酸碱对。
例如NH3是NH+4的共轭碱,反之,NH+4是NH3的共轭酸。
又例如,对于酸碱两性物质,HCO-3的共轭酸是H2CO3,HCO-3的共轭碱是CO-23。
换言之,H2CO3和HCO-3是一对共轭酸碱,HCO-3和CO-23是另一对共轭酸碱。
3、酸和碱的反应跟阿仑尼乌斯酸碱反应不同,布仑斯惕酸碱的酸碱反应是两对共轭酸碱对之间传递质子的反应,通式为:酸1 + 碱2 碱1 + 酸2例如:HCl + NH 3Cl-+ NH+4H 2O + NH3OH-+ NH+4HAc + H 2O Ac-+ H3O+H 2S + H2O HS-+ H3O+H 2O + S 2-OH-+ HS-H 2O + HS-OH-+ H2S这就是说,单独一对共轭酸碱本身是不能发生酸碱反应的,因而我们也可以把通式:酸碱+ H+称为酸碱半反应,酸碱质子反应是两对共轭酸碱对交换质子的反应;此外,上面一些例子也告诉我们,酸碱质子反应的产物不必定是盐和水,在酸碱质子理论看来,阿仑尼乌斯酸碱反应(中和反应、强酸置换弱酸、强碱置换弱碱)、阿仑尼乌斯酸碱的电离、阿仑尼乌斯酸碱理论的“盐的水解”以及没有水参与的气态氯化氢和气态氨反应等等,都是酸碱反应。
在酸碱质子理论中根本没有“盐”的内涵。
例1.下列各种物质中,既是路易斯酸又是路易斯酸碱的是( )A.B2H6 B.CCl4 C.H2O D.SO2Cl2例2.不是共轭酸碱对的一组物质是( )A.NH3,NH2-B.NaOH ,Na+C.HS-,S2-D.H2O ,OH-例3.(CH3)2N—PF2有两个碱性原子P 和N,与BH3 形成配合物时,原子与B 结合。
与BF3 形成配合物时,原子与B 相结合。
例4.根据阿仑尼乌斯和(或)布朗斯特理论,下列物质中哪些可用作酸?哪些可用作碱?哪些可用作酸又可用作碱?(1)HCl;(2)H2PO3 ;(3)H2CaO2;(4)ClO3(OH);(5)Sb(OH)3。
解答酸:(1),(2),(4),(5);碱:(2),(3),(5);两者:(2),(5)。
例5.指出下列反应中的布朗斯特酸、碱及其共轭物:(1)HSO4-+OH-===SO42- + H2O;(2)PO43-+ H2O===HPO42-+ OH-;(3)H2Fe(CO)4+ CH3OH===[FeH(CO)4]- + CH3OH2+;(4)HNO3 + H2O===H3O++ NO3-;(5)CO32-+ H2O===HCO3-+ OH-;(6)NH3 + H2S===NH4++ HS-;(7)NH4I + KNH2===KI +2NH3(液氨为溶剂);(8)Zn(H2O)42+(aq) + H2O(l)===Zn(H2O)3(OH)+(aq) + H3O+(aq)。
例6.1994年10月12日,瑞典皇家科学院宣布授予美国加利福尼亚大学有机化学家乔治安德鲁欧拉教授1994年度诺贝尔化学奖,以表彰他在碳正离子化学研究方面所做的贡献。
1962年,欧拉和他的同事们把(CH3)3CF溶于过量的SbF5介质中,获得理想的结果,它们之间反应的化学方程式是,SbF5属于类化合物,其理由是。
例7.参照水溶液化学反应的知识回答下列问题:在液态BrF3中用KBrF4滴定Br2PbF10,过程中出现电导最低点,写出有关反应式。
二、弱电解质的电离平衡1、水的电离平衡(1)水的离子积常数H 2O(l) H+(aq) + OH-(aq)K= [H+] + [OH-] (8-1)w式中的K称为水的离子积常数。
wK是标准平衡常数,式中的浓度都是相对浓度。
由于本讲中使用标准浓度极其频繁,故省w略除以0c的写法。
要注意它的实际意义。
由于水的电离是吸热反应,所以,温度升高时,K值变大。
w表-1 不同温度下水的离子积常数Kw温度/ K273295373K0.13×10–14 1.0×10–1474×10–14 w在溶液中,只要有H2O, H+, OH-三者共存,之间就存在如下的数量关系:[ H+ ] [ OH-] =K不论溶液是酸性,碱性,还是中性。
w常温下,[ H+ ] = 1×10–7,表示中性,因为这时K= 1.0×10–14;非常温时,溶液的中性w只能是指[ H+ ] = [ OH-]。
(2)pH 值和pOH 值pH = – lg [ H+] (8-2)pOH = – lg [ OH-] (8-3)因为[ H+ ] [ OH-] = 1.0×10–14所以pH + pOH = 14 (8-4)pH 和pOH 一般的取值范围是1~14 ,但也有时超出,如:[ H+ ] = 10 ,则pH = –1。
2、弱酸和弱减的电离平衡(1)一元弱酸和弱减的电离平衡将醋酸的分子式简写成 HAc ,用 Ac - 代表醋酸根,则醋酸的电离平衡可以表示成: HAcH + + Ac -用0a K 表示酸式电离的电离平衡常数,经常简写作a K 。
且:氨水 NH 3·H 2O 是典型的弱碱,用0b K (简写成b K )表示碱式电离的电离平衡常数,则有:NH 3·H 2O NH 4+ + OH -b K =][]][[234O H NH OH NH ⋅-+=1.8×10–5(2)多元弱酸的电离平衡多元弱酸的电离是分步进行的,对应每一步电离,各有其电离常数。
以 H 2S 为例: 第一步 H 2SH + + HS -721103.1][]][[--+⨯==S H HS H K 第二步 HS - H + + S 2-1522101.7][]][[---+⨯==HS S H K显然,1K 2K 。
说明多元弱酸的电离以第一步电离为主。
将第一步和第二步的两个方程式相加,得: H 2S2H + + S 2- 22212221102.9][][][--+⨯=⋅==K K S H S H K 平衡常数表示处于平衡状态的几种物质的浓度关系,确切地说是活度的关系。
但是在我们的计算中,近似地认为活度系数 f = 1,即用浓度代替活度。
a K 、b K 的大小可以表示弱酸和弱碱的离解程度,K 的值越大,则弱酸和弱碱的电离程度越大。
例1.计算下列各浓度的HAc 溶液的[H]+ 和电离度 (1)0.1 mol dm -3 (2) 1.0 ×10-5 mol dm -3 [已知:K θa (HAc)=1.8×10-5].例2.将2.45 g固体NaCN配成500 ml水溶液,计算溶液的pH值?(已知HCN的K a r =4.9 ´ 10-10)例3.浓度为0.010 mol·dm-3 的某一元弱碱(Kθb =1.0×10-8)溶液,其pH = ,此碱的溶液与等体积的水混和后,pH = 。
例4.在0.10mol·dm-3HAc 溶液中加入固体HAc 后,HAc的浓度,电离度,pH值。
例5.计算0.1 mol dm-3的H2S水溶液(饱和水溶液)的[H+] 、[HS-]、[S2-]及pOH。
3、缓冲溶液(1)同离子效应HAc H+ + Ac-达到平衡时,向溶液中加入固体NaAc(强电解质完全电离:NaAc = Na+ + Ac-),由于Ac-的引入,破坏了已建立的弱电解质的电离平衡:HAc H+ + Ac-Ac-增多,使平衡左移,使HAc 的电离度减小。
定义:在弱电解质的溶液中,加入与其具有相同离子的强电解质,从而使电离平衡左移,降低弱电解质的电离度。
这种现象称为同离子效应。
例6.在0.1 mol dm-3的HAc溶液中加入固体NaAc,使NaAc的浓度达到0.2 mol dm-3,求该溶液中[H+]和电离度例7.求把0.10 dm-3,0.20 mol·dm-3HAc 与0.050 dm-3, 0.20 mol·dm-3NaOH 溶液混后的值[已知:Kθa (HAc)=1.8×10-5].例8.已知Kθa (HCN)=7.2×10-10,计算0.20 mol·dm-3NACN 溶液的C(OH-)和水解度αh。
(2)缓冲溶液①概念能够抵抗外来少量酸碱的影响和较多水的稀释的影响,保持体系pH 值变化不大的溶液,我们称之为缓冲溶液。
如向1L 0.10 mol·L-1的HCN 和0.10 mol·L-1 NaCN的混合溶液中(pH = 9.40),加入0.010 mol HCl 时,pH 变为9.31;加入0.010 mol NaOH 时,pH 变为9.49;用水稀释,体积扩大10 倍时,pH 基本不变。
