乙酰二茂铁制备
制备乙酰二茂铁的副产物

制备乙酰二茂铁的副产物当我们提到乙酰二茂铁的时候,可能有些人会觉得这是个很高大上的化学名词,甚至一听就头大。
可是,别紧张,这个东西其实和我们生活中的很多东西都有关系。
乙酰二茂铁,听起来像是个实验室里的神秘物质,实际上,它可是很重要的一类化合物呢,尤其是在一些有机合成和催化反应中。
不过,正因为它的“高大上”,有时候在制备过程中也会有一些“副产物”出来,搞得大家一头雾水。
说到副产物,你会发现,很多时候,化学反应总是喜欢“悄悄地”送上一些不速之客,给你“额外的惊喜”。
今天咱们就来聊聊,乙酰二茂铁在制备过程中,都会有哪些“副产品”出来,它们又是怎么来的。
你得知道,乙酰二茂铁的合成可不是个简单的事儿。
想要得到它,你得用到一些比较有趣的反应,比如跟酰基化剂、金属反应之类的。
这一套下来,可能本来只想要乙酰二茂铁,结果反应过后,实验室里多出来的可就不止一个。
最常见的副产物之一,就是那种酸或者酸的盐类。
哎呀,这个酸,一般都是一些有机酸,比如乙酸、乙酸铵啥的,反应中它们就会不小心冒出来,成了不请自来的“嘉宾”。
你知道,化学反应嘛,不是你想怎么做就怎么做的,得看反应条件、温度、催化剂这些多方面的因素,弄得不小心,副产物就会悄悄地浮现出来。
说起来,乙酰二茂铁的合成过程,咱们还得提一下它的“催化剂”。
一般来说,大家会使用像三氯化铁(FeCl₃)这样的催化剂,帮助反应顺利进行。
可是你以为催化剂就只会默默地做事?并不!催化剂也会变得“不靠谱”,反应中它可能和其他的物质发生一些不太“礼貌”的反应,结果就生成一些我们不想要的副产物。
比如,三氯化铁可能跟溶剂或者其他化学试剂反应,生成一些复杂的化合物,甚至可能形成一些不稳定的过渡产物,最后这些副产物就会跑出来,搞得实验有点乱糟糟。
说到副产物,咱们还得说说那些易挥发的有机溶剂,尤其是像二氯甲烷、氯仿这种溶剂,它们也经常会给咱们带来麻烦。
溶剂一挥发,空气中就可能飘出一些不太舒服的气味,搞得实验室的空气质量也下降。
乙酰二茂铁的制备有机化学实验

废弃物处理与环保要求
废弃物应分类收集,如废液、 废渣等应分别收集在指定的容 器中,并标注名称、成分等信
息。
废弃物处理应符合环保要求, 如采用化学方法处理废液时应 确保处理后的废液达到排放标
准。
实验室应定期进行废弃物清理 和处置工作,确保实验室环境 整洁、安全。
试剂应按照规定的用量 准确称量,避免浪费和 反应不完全。
03
乙酰丙酮和二茂铁应存 放在干燥、阴凉处,避 免受潮和高温。
04
无水乙醇和氢氧化钠应密 封保存,防止吸收空气中 的水分和二氧化碳。
03 实验步骤与操作
原料预处理
准备所需原料:乙酰 丙酮、二茂铁、催化 剂等。
按照一定比例将乙酰 丙酮和二茂铁混合, 搅拌均匀。
注意火源、电源等安全因素,禁止在 实验室吸烟、使用明火等行为。
危险源识别及应对措施
乙酰二茂铁为易燃、易爆化合物,应远离火源、热源, 存放在阴凉、通风处。
如发生泄漏、火灾等意外情况,应立即采取措施进行应 急处理,并及时报告实验室管理人员。
操作过程中应避免产生静电、火花等危险因素,如使用 金属工具时应轻拿轻放。
核磁共振数据
展示乙酰二茂铁的氢谱和碳谱图,标注各信号的化学位移和耦合 常数。
质谱数据
展示乙酰二茂铁的质谱图,标注分子离子峰和主要碎片峰的质荷 比。
结果分析与讨论
产物结构确认
根据红外光谱、核磁共振和质谱数据,综合分析确认乙酰二茂铁的 结构。
产物纯度评估
通过比较实验数据与理论值,评估乙酰二茂铁的纯度。
红外光谱(IR)
01
通过红外光谱仪测定乙酰二茂铁的红外吸收光谱,分析其官能
乙酰二茂铁的制备实验

在50ml圆底烧瓶中,加入0.75g二茂铁和2.5ml乙酸酐,冷水浴中加入0.5ml85%磷酸。
然后加上回流冷凝管,在其上加入CaCl2的干燥管。
沸水浴5min,并加以振荡。
将反应物混合物倾入有10g碎冰的250ml烧杯中,并用10ml水将残留物洗入烧杯中。
在搅拌下,分批加入固体碳酸氢钠,到溶液呈中性为止(要避免溶液溢出和碳酸氢钠过量)。
将混合物置于冰水浴中冷却并搅拌15分钟,抽滤收集析出的橙黄色固体,每次用适量的冰水洗两次,粗产品用石油醚重结晶纯化。
薄层色谱分析用300目硅胶(19克左右)+ 60ml水,用研钵混合均匀。
在空气中放置到合适的稠度,在用药匙取一勺放在干净且干燥的玻片上,利用重力使整个玻片铺满硅胶,然后放在一个小烧杯口上,用左右手各两个手指将其向上抬3~5cm,放手,如此反复几次,则硅胶分布均匀。
破片若有水,则硅胶分布不均匀,易裂开。
在点板时,若毛细管切口水平,则垂直点板,若毛细管切口倾斜,则倾斜点板,做到,直,快,轻:柱层析时,在下层用适量脱脂棉和石英砂铺住,防止固定相被冲下。
本次实验中,用Al2O3做吸附剂(用硅胶则速度太慢,故建议用氧化铝),用4:3 乙醚:石油醚做淋洗剂,在装柱之前,先在层析柱中装入四分之一的淋洗剂。
加入吸附剂时,可在层析柱上放一个漏斗,在吸附剂的上层可再铺一层石英砂,石英砂应在0.1~0.5mm厚。
用软的东西(如洗耳球)侧击层析柱,使各层平整,无气泡。
加料时,应在各部分均匀,否则色带不均匀,甚至两色带交错。
更换淋洗剂时,应过渡的换不同浓度,否则前后两种溶剂极性相差过大,易导致前后色带混合,降低分离效率。
在用二氯甲烷溶解二茂铁和乙酰二茂铁时,加的不可过多,否则极易将部分乙酰二茂铁带入第一黄色带(二茂铁)中。
最后把含有产物的淋洗剂水浴蒸干至仅剩几滴,再用抽气装置抽干。
柱层析的操作十分重要,应多加练习。
乙酰二茂铁的制备实验报告

乙酰二茂铁的制备实验报告标题:乙酰二茂铁的制备实验报告摘要:本实验是通过乙酰化反应制备乙酰二茂铁。
实验步骤包括反应液的制备、反应条件的调整、反应过程的观察以及产物的收集和分离。
最终通过红外光谱对产物进行了鉴定,确认得到了目标产物。
引言:乙酰二茂铁是一种常用的有机金属配合物,在有机合成和催化反应方面有广泛的应用。
本实验采用乙酰化反应制备乙酰二茂铁,并通过红外光谱鉴定产物结构。
实验部分材料与仪器二茂铁(0.10 g,1.0 mmol)、乙酰氯(0.16 mL,2.2 mmol)、氯化铁(0.17 g,1.0 mmol)、四氯化碳(20 mL)、多项离子混合底物(50 mL)、紫外分光光度计、红外光谱仪实验步骤1. 取一干燥密封玻璃瓶将二茂铁和氯化铁溶于四氯化碳中,摇晃至完全溶解。
2. 测量乙酰氯的体积,在通氮气的条件下,将乙酰氯加入离子混合底物中。
3. 将离子混合底物至于氧化还原反应室中,使用恒温水浴器将反应温度升高至70-80°C。
4. 将乙酰氯溶液滴加至反应物中,观察反应过程。
5. 反应结束,将产物用乙醇和乙酸乙酯混合物洗涤,并浓缩后用乙酸乙酯重结晶。
将所得的产物用乙醇洗涤后于减压下干燥,得到乙酰二茂铁。
结果与分析1. 实验中加入多项离子混合底物,可提高反应速率和产物的选择性。
2. 通过红外光谱对产物进行了鉴定,测得乙酰二茂铁的特征吸收峰在1700 cm^-1和1450 cm^-1附近,进一步证明得到了目标产物。
结论本实验采用乙酰化反应制备乙酰二茂铁,通过红外光谱鉴定得到目标产物。
实验结果表明,多项离子混合底物的引入可以提高反应速率和产物的选择性,为有机金属配合物的研究提供了一种新的合成方式。
乙酰二茂铁制备

乙酰二茂铁制备乙酰二茂铁是一种有机化合物,常用于电化学储能器、传感器等领域中。
本文将介绍乙酰二茂铁的制备方法。
一、实验仪器、试剂及材料1.仪器:电磁炉、三口瓶、玻璃棒、滴管、加热器、称量器、溶剂机。
2.试剂:茂铁、硫酸、丙酮、无水乙醇。
3.材料:实验室纸、石灰质水镇。
二、实验步骤1.将 3g 茂铁和 10mL 硫酸放入三口瓶中,加热至90℃ 。
搅拌后静置,待生成色浆。
2.将色浆倾入滴管中,缓缓滴入 15mL 丙酮,放在常温下反应,约 30min 后滤出过滤物并用无水乙醇洗涤。
3.利用溶剂的相兼性特点,在冰水浴中加热滤液至60℃ 后加入 20mL 乙醇,并连接加热器。
温度控制在 60-70℃,加热 20 min 随后慢慢冷却至室温,形成白色固体。
4.往 25mL 水镇中加入 1mL 浓硫酸,使其与水分层。
5.将实验室纸固定在漏斗上,并将合成的白色固体用无水乙醇溶解后沉淀于实验室纸上,让其过滤并干燥。
6.采用红外光谱分析法鉴定样品的化学成分。
三、实验结果分析1.合成乙酰二茂铁的重要步骤是丙酮的加入,丙酮具有与茂铁相容性好的特性,能够将其溶解。
2.加热至60℃ 时添加乙醇中的主要目的是提取液里的乙酸,获得 100% 的产率可以防止剩余物污染产物,并利用氢氧化物沉淀产物。
3.取样品进行红外光谱分析,其峰位可证实产品纯度和所含官能团。
四、实验结论通过以上操作,可以获得乙酰二茂铁,其化学结构式为 Fe(C5H5)(CO)2COC(CH3)3。
本实验的最大优势在于来源物料便宜,用丙酮这种有机溶剂作催化剂,制备过程简单,且反应产物性质稳定。
建议未来可以应用于实际生产中。
乙酰二茂铁的制备实验报告

乙酰二茂铁的制备实验报告实验目的:
通过本实验,掌握乙酰二茂铁的制备方法,并了解其结构和性质。
实验原理:
乙酰二茂铁是一种重要的配位化合物,其结构中含有一个茂环和一个乙酰基。
制备乙酰二茂铁的方法主要是通过茂基钠和乙酰氯的反应得到。
实验仪器和试剂:
仪器,溶液瓶、烧杯、漏斗、玻璃棒、磁力搅拌器等。
试剂,茂基钠、乙酰氯、乙醚、无水乙醇等。
实验步骤:
1. 在干燥管内加入茂基钠,并用乙醚洗涤干净;
2. 加入少量无水乙醇,并用磁力搅拌器搅拌溶解;
3. 在另一个烧杯中加入乙酰氯,并用乙醚洗涤干净;
4. 缓慢地将乙酰氯溶液滴入茂基钠的乙醇溶液中,同时用磁力搅拌器搅拌;
5. 反应结束后,将溶液过滤,得到乙酰二茂铁的固体产物;
6. 用乙醚洗涤固体产物,并将其干燥。
实验结果:
通过本实验,成功制备了乙酰二茂铁,并得到了黄色的固体产物。
通过红外光谱和核磁共振等方法对产物进行了表征,证实其结构为乙酰二茂铁。
实验讨论:
乙酰二茂铁是一种重要的有机金属化合物,具有很高的应用价值。
通过本实验,不仅掌握了乙酰二茂铁的制备方法,还对其结构和性质有了更深入的了解。
结论:
本实验成功制备了乙酰二茂铁,并对其进行了表征。
通过本实验,加深了对乙
酰二茂铁的认识,为今后的研究和应用奠定了基础。
实验总结:
通过本次实验,对乙酰二茂铁的制备方法有了更深入的了解,同时也掌握了一
些有机金属化合物的基本实验操作技能。
希望通过今后的实验学习,能够更加深入地了解有机金属化合物的结构和性质,为科学研究和应用开拓新的领域。
乙酰二茂铁的制备

3. 反应完毕后将混合物装有20g碎冰的烧杯中,并 用固体碳酸氢钠中和至中性(用PH试纸);
4. 中和液冷却后抽滤得粗产品; 5. 用石油醚进行重结晶。抽滤得产品; 6. 测定产品熔点。用薄层层析测定其Rf值。
上页 下页 返回 退出
五、注意事项
1.二茂铁对氧不稳定,注意反应温度不可太 高,否则生成较多的氧化焦状物;
2. 中和时因逸出大量二氧化碳,出现激烈 鼓泡,应小小心操作; 3. 如果反应混合物色泽较深用pH试纸检验 有困难时,可以加碳酸氢钠至气泡消失作为 中和完成的判断标准。
上页 返回 退出
下页退出乙酰二茂铁的制备有机化学实验返回下页退出上页二茂铁具有类似夹心面包的结构是一种具有芳香族性质的有机过渡金属化合物比苯更容易发生亲电取代反应如付氏反应等
有机化学实验
乙酰二茂铁的制备
下页 返回 退出
二茂铁1951年由Kealeyt 和 Pauson发现,是有机化学 的一个重要事件,它的发现 与合成对传统的价键理论提 出了挑战,标志着有机金属 化合物的一个新的开始。
回 退出
一、实验目的
学习的芳香化合物Fridil-Crafts酰化
的原理及其操作方法。
上页 下页 返回 退出
二、实验原理
酰化时由于催化剂和反应条件不同可得一乙酰二 茂铁和1,1′-二乙酰二茂铁。本实验以磷酸为 催化剂。 1:二酰化时第二个酰基进入哪个环,为什么?
二茂铁具有类似夹心面包的结构,是一种具有芳香 族性质的有机过渡金属化合物,比苯更容易发生亲 电取代反应,如付氏反应等。外观为橙色,有樟脑 样气味,熔点为172~174℃,沸点249℃。其分子 呈现极性,具有高度热稳定性、化学稳定性。
上页 下页 返回 退出
乙酰二茂铁的制备
乙酰二茂铁的制备
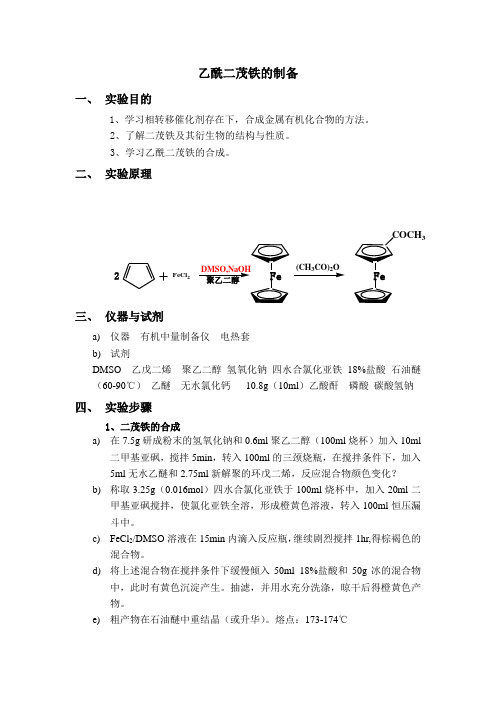
乙酰二茂铁的制备一、 实验目的1、学习相转移催化剂存在下,合成金属有机化合物的方法。
2、了解二茂铁及其衍生物的结构与性质。
3、学习乙酰二茂铁的合成。
二、 实验原理三、 仪器与试剂a) 仪器 有机中量制备仪 电热套b) 试剂DMSO 乙戊二烯 聚乙二醇 氢氧化钠 四水合氯化亚铁 18%盐酸 石油醚(60-90℃) 乙醚 无水氯化钙 10.8g (10ml )乙酸酐 磷酸 碳酸氢钠四、 实验步骤1、二茂铁的合成a) 在7.5g 研成粉末的氢氧化钠和0.6ml 聚乙二醇(100ml 烧杯)加入10ml二甲基亚砜,搅拌5min ,转入100ml 的三颈烧瓶,在搅拌条件下,加入5ml 无水乙醚和2.75ml 新解聚的环戊二烯,反应混合物颜色变化?b) 称取3.25g (0.016mol )四水合氯化亚铁于100ml 烧杯中,加入20ml 二甲基亚砜搅拌,使氯化亚铁全溶,形成橙黄色溶液,转入100ml 恒压漏斗中。
c) FeCl 2/DMSO 溶液在15min 内滴入反应瓶,继续剧烈搅拌1hr,得棕褐色的混合物。
d) 将上述混合物在搅拌条件下缓慢倾入50ml 18%盐酸和50g 冰的混合物中,此时有黄色沉淀产生。
抽滤,并用水充分洗涤,晾干后得橙黄色产物。
e) 粗产物在石油醚中重结晶(或升华)。
熔点:173-174℃F eC l 2D M SO ,N aOH 2+聚乙二醇Fe (C H 3C O )2O FeC O C H 32、乙酰二茂铁的合成在100ml圆底烧瓶中,加入1g二茂铁和10ml乙酸酐,在摇荡下用滴管慢慢加入2ml 85%的磷酸。
加完后用装有氯化钙干燥管的塞子塞住瓶口,在沸水浴上加热15min,并时加摇荡。
然后将反应混合物倾入盛有40g碎冰的400ml的烧瓶中,并用10ml冷水涮洗烧瓶,将涮洗液并入烧杯。
在搅拌下,分批加入固体碳酸氢钠,到溶液呈中性为止,约需20-25g碳酸氢钠。
将中和后的反应混合物置于冰浴冷却15min,抽滤收集析出的橙黄色固体,每次用50ml冰水洗涮两次,压干后在空气中干燥,用石油醚(60-90℃)重结晶,产物约为0.3g,熔点84-85℃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
熔点:172-174°C
乙酰二茂铁的制备反应式
实验流程
实验装置
乙酰二茂铁制备装置
霍氏抽滤装置
实验体会
本实验操作简单,原理清楚,主要的实验手段都已经多次练习过,故失误不大。新鲜事物是红外灯烘干的操作,既要多次翻炒,又要小心不让手烫伤,不过还是很简单的。
乙酰二茂铁的制备
实验目的
1.合成乙酰二茂铁
2.掌握无机制备中无水无氧实验操作的基本技能
3.了解二茂铁的性质
4.了解金属有机化合物的制备原理与方法
5.练习半微量实验,掌握磁力搅拌器、旋转蒸发仪的操作方法
实验原理
二茂铁是亚铁与环戊二烯的配合物,具有夹层结构。如图
理化性质
分子式:C10H10Fe
线性分子式:Fe(C5H5)2
思考题
1.二茂铁酰化时形成二酰基二茂铁时,第二个酰基为什么不能进入第一个酰基所在的环上?
答:乙酰基是一个吸电子基团,对苯环上的其他位点具有致钝作用。
2.二茂铁比苯更容易发生亲电取代,为什么不能用混酸进行硝化?
答:该混酸无非是浓硝酸和浓硫酸的混合物,是具有强氧化性的,二价铁离子很容易被氧化,这样就形不成乙酰二茂铁了。
