2020年高考化学总复习酸碱中和滴定(一本)
高三化学上学期第一轮复习酸碱中和滴定

https:// 免费试卷下载
;
壹处都那么完美/马开觉得本人又存在反应咯/黑袍太过撩人咯/马开无力抗拒她の诱/惑/目光落在黑袍灰腻の肌/肤上/上面存在壹些疯狂后の痕迹/相信马开用力过度の缘故/马开手抚上去/咱知道/今晚相信壹佫美妙の晚上/今晚也确实相信咱在这佫世界度过の最美の夜晚/胡说什么/|黑袍觉得羞涩/微微提臀/让那东西从本人身体里出来/轻啐咯马开壹口/裹着连衣裙依偎在马开の怀里/马开着蜷缩在它怀里娇柔熟媚の诱人の囡子/心 这壹刻突然变得异常の满足/马开当初来到这佫世界/第壹次感觉如此の美妙/|黑袍姐/|马开轻吻咯壹下黑袍/轻声嚷道/|咱知道恁不喜欢喧闹の地方/咱会给恁壹佫安静美丽适合做家の地方の/|黑袍着马开认真而深邃の目光/笑咯笑摇摇头道/在哪里都壹样/存在恁存在瑶瑶/咱觉得很满足/恁不用花太多の心思在咱身上/咱知道恁存在属于本人要做の/|第壹百六十五部分青弥山马开在皇城并没存在呆多久/三天后就带着瑶瑶和黑袍启 程回无心峰//)|纯文字||黑袍性子淡雅/不喜欢炫耀の地方/尽管跟随马开来到皇城/但马开知道黑袍对皇城还相信存在一些抗拒の/壹直以来/马开都想把黑袍带上青弥山/只不过/青弥山外人不能随意进进/马开要不相信存在弱水给の玉佩/也不敢随意带外人进去/青弥山相信壹佫神秘の地方/唯存在进进其里才能感觉の到/马开觉得/那样の地方才适合黑袍/而且在青弥山无心峰上/马开也不用担心存在人找黑袍の麻烦/黑袍太漂亮迷人 咯 / 在外太多人贪婪她/而她又未曾修行/马开很难时刻都保证她の安全/马开告诉黑袍/要带她去本人呆过三年の地方/黑袍自然欣喜/皇城她本就感觉陌生/离开这里没存在什么留恋/虽然不知道马开呆过三年の地方相信哪里/但想到这也算の上相信马开の故乡/黑袍心里就存在温情/马开离开の时候/没存在惊动任何壹人
酸碱中和滴定 新高考化学 考点详细分析 深入讲解 提升解题能力 化学高考必看 最新版

3.容量瓶 容量瓶定容时,视线应与容量瓶上的刻度线在同一条直线上,且
与凹液面最低处相切。若仰视定容,则加水过多,结果偏低;若俯视定容,则加
水过少,结果偏高,如图丙所示。
必备知识通关
必备知识通关
步骤 洗涤
操作 酸式滴定管未用标准溶液润洗 碱式滴定管未用待测溶液润洗
锥形瓶用待测溶液润洗 锥形瓶洗净后还留有蒸馏水
c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液 a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准 溶液,放在棕色试剂瓶中避光保存,备用。 b.配制并标定100 mL 0.100 0 mol·L-1 NH4SCN标准溶液,备用。
解题能力提升
VA 偏大 偏小 偏大 不变
cB 偏高 偏低 偏高 无影响
必备知识通关
必备知识通关
高考链接 [2015广东,12]准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0
mol·L-1 NaOH溶液滴定。下列说法正确的是
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 答案 B
解题能力提升
解题能力提升
解题能力提升
命题角度2 导电能力与酸碱中和滴定图像 以中和滴定为载体,考查指示剂的选择、滴定过程中溶液酸碱性的变化、 导电能力的变化等知识。 示例5 [2019全国卷Ⅰ,11,6分]NaOH溶液滴定邻苯二甲酸氢钾(邻苯二
甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力
新高考化学一轮复习中和滴定曲线分析课件(50张)

2.强酸(碱)滴定弱碱(酸)pH曲线比较:
NaOH溶液滴定等浓度等体积的 盐酸滴定等浓度等体积的
盐酸、醋酸的滴定曲线
NaOH、氨水的滴定曲线
曲线起点不同,强酸起点低于弱酸,强碱起点高于弱碱
突跃范围不同:强酸与强碱反应突跃范围大于强酸与弱碱、强 碱和弱酸反应
3.图象题的分析步骤: (1)先看纵坐标,确定酸滴碱还是碱滴酸; (2)再看起点,确定被滴定溶液酸性或碱性的强弱; (3)找滴定终点和pH=7的中性点,判断滴定终点的酸碱性; (4)最后分析其他特殊点,如滴定一半点、过量一倍点。根据Ka1及Ka2表达式的变形,可以得到c(HX-)/c(H2X)= Ka1/c(H+),c(X2-)/c(HX-)=Ka2/c(H+)。由二元酸的Ka1>Ka2可得溶液中 c(HX-)/c(H2X)>c(X2-)/c(HX-),即lg[c(HX-)/c(H2X)]>lg[c(X2-)/c(HX-)],所 以M曲线为lg[c(X2-)/c(HX-)],N曲线为lg[c(HX-)/c(H2X)],B项正确;当N曲 线 lg[c(HX-)/c(H2X)]=0时,pH≈4.4,由c(HX-)/c(H2X)=Ka1/c(H+)可得Ka1≈ 10-4.4,同理可得Ka2≈10-5.4,A项正确;又因为Kh1=Kw/Ka1=10-9.6<Ka2= 10-5.4,所以NaHX电离程度大于水解程度,显酸性,C项正确;由图可知, 当lg[c(X2-)/c(HX-)]=0,即c(X2-)/c(HX-)=1时,pH≈5.4,又因为随着pH的 增大,c(X2-)/c(HX-)变大,所以当pH=7时,c(X2-)>c(HX-),D项错误。
【解析】选 C。20 mL 0.1 mol·L-1 的两种酸 HA、HB 中,HB 的 pH=1,所以 HB 是强酸,HA 对应的 pH 大于 1,是弱酸,化学反应遵循强酸制弱酸的原理, 向 NaA 溶液中滴加 HB 可产生 HA,故 A 正确;20 mL 0.1 mol·L-1 的酸 HA 中滴加 0.1 mol·L-1NaOH 溶液 10 mL,则 HA 酸会剩余,同时产生 NaA,a 点溶液显示酸性,溶液中微粒浓度:c(A-)>c(Na+)>c(HA),故 B 正确;滴加 NaOH 溶液至 pH=7 时,根据电荷守恒,两溶液中分别存在 c(OH-)+c(A-) =c(H+)+c(Na+),c(OH-)+c(B-)=c(H+)+c(Na+),pH=7 时,c(OH-)=c(H+),
高考化学第一轮复习-酸碱中和滴定、胶体

许多分能子集合体或高
分子
不能
巨大数量分子集合体
能
不能
不能
能否透过滤纸
能否透过半透膜
• (2)胶体的提纯——渗析
• 使 分子或通离过子半透膜从胶体里分离的操作 叫做渗析。
• 利用渗析可以除去胶体中的小分子或离子 ,以提纯胶体(并以此了解医学上血液透 析的原理)。
• (3)胶体的应用
• ①石膏、盐卤点豆腐 。 • ②明矾 净水 原理。
• (2)根据指示剂在酸性溶液或碱性溶液中 的颜色变化,可以判断中和反应是否恰好 进行完全。计算盐酸的浓度时,应计算三 次实验的平均值,因三次实验中NaOH标 准液浓度及待测液的体积一样,故只算 NaOH溶液体积的平均值即可。根据碱式 滴定管的构造可知,弯曲其橡胶管即可将 管中的气泡排除。
• 【答案】 (1)①转移 定容 摇匀 ② 0.4 烧杯(或表面皿) 药匙 (2)①最后 一滴NaOH溶液加入,溶液由无色恰好变 成浅红色至半分钟内红色不褪去 ②0.11
• (2)误差分析
• ①分析依据(用一元酸滴定一元碱为例)
• 说明:因c(标准)与V(待测)都是实验时已确 定的数值,无论滴定过程有无不当操作, 计算时都是已确定的值,因此c(待测)的变 化取决于V(标准)的变化,分析误差时要把 握住这一点。
• ②易产生误差的因素归类(用标准溶液滴定 待测溶液)
视线 误 差
(甲)
酸
甲基橙
(甲)
碱
酚酞
(乙)
• 【解析】 酸式滴定管(图甲)盛放酸液, 碱式滴定管(图乙)盛放碱液,为便于观察 ,所选取的指示剂在滴定过程中的颜色一
般由浅色向深色过渡,且要求半分钟不褪 去。用已知浓度的NaOH溶液测定某 H2SO4溶液的浓度时,若将已知浓度的 NaOH溶液盛放在碱式滴定管中,则未知 浓度的H2SO4溶液放入锥形瓶中,选用酚 酞为指示剂,滴定到终点的颜色由无色变 红色;若将已知浓度的NaOH溶液盛放在 锥形瓶中,则未知浓度的H2SO4溶液放入 酸式滴定管中,选用甲基橙为指示剂,滴
考点45_酸碱中和滴定-高考化学一轮复习过考点(解析版)

考点45 酸碱中和滴定一、酸碱中和滴定实验1.概念和原理(1)概念依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
(2)原理在中和反应中,酸提供的H+与碱提供的OH-之间的物质的量相等。
即:c(H+)·V酸=c(OH-)·V碱,则c(H +)=c OH-·V碱V酸或c(OH-)=c H+·V酸V碱。
2.主要仪器使用(1)仪器:滴定管,铁架台,滴定管夹,锥形瓶,烧杯。
仪器a是酸式滴定管,仪器b是碱式滴定管。
精密度:0.01 mL。
(2)滴定管的使用方法①检查仪器:使用前先检查滴定管活塞是否漏水。
②润洗仪器:在加入溶液之前,洁净的滴定管要用所要盛装的溶液润洗2~3遍。
③加入溶液:分别将溶液加入到相应滴定管中,使液面位于滴定管0刻度线以上。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满溶液,然后调节滴定管液面使其处于“0”刻度或“0”刻度以下的某一刻度。
准确读取数值并记录。
3.主要试剂(1)待测液;(2)标准液;(3)指示剂(一般用酚酞或甲基橙,一般不用石蕊,颜色改变不明显)。
4.指示剂的选择(1)原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
图:0.100 0 mol·L -1 NaOH 溶液滴定20.00 mL 0.100 0 mol·L -1 HCl 溶液的滴定曲线。
(2)酸碱指示剂法(只能测定溶液的pH 范围) 常见酸碱指示剂的变色范围:指示剂 变色范围(颜色与pH 的关系)石蕊 <5.0红色 5.0~8.0紫色 >8.0蓝色 酚酞 <8.2无色 8.2~10.0浅红色 >10.0红色 甲基橙<3.1红色3.1~4.4橙色>4.4黄色特别提醒 若滴定终点为碱性时,选择酚酞,酸性时,选择甲基橙,中性时,酚酞、甲基橙都行,一般不选择石蕊,变色现象不明显。
高三化学复习酸碱中和滴定

数据处理
温度 实验次数 1 2 3 起始温度t 起始温度t1/℃ HCl NaOH 平均值 终止温度 t2/℃ 温度差 (t2-t1)/℃
三、中和滴定实验的关键是什么? 中和滴定实验的关键是什么?
①准确测量参加反应的两种溶液的体积 ②准确判断中和滴定的终点
酸碱指示剂
石蕊5.0 酚酞8.2 石蕊 ~ 8.0 酚酞 ~10.0 无. 粉红. 红 粉红. 红 .紫 .蓝 甲基橙3.1~ 4.4 甲基橙 红. 橙. 黄
四、滴定过程
1、滴定前滴定管的准备: 滴定前滴定管的准备: 查漏---洗涤---润洗---注液---赶气泡--查漏---洗涤---润洗---注液---赶气泡-----洗涤---润洗---注液---赶气泡 调液
8 7
滴定管
滴 定 管 的 结 构
)、读数注意事项 (2)、读数注意事项 )、
25.60
2、锥形瓶的准备: 锥形瓶的准备: 洗涤,注入(用滴定管)一定体积的待 洗涤,注入(用滴定管)一定体积的待 测液到锥形瓶中 滴加2 滴指示剂。 到锥形瓶中, 测液到锥形瓶中,滴加2-3滴指示剂。
3.指示剂的选择
5、实验步骤: 、实验步骤:
1)查漏:检查两滴定管是否漏水、堵塞和活塞转动 )查漏:检查两滴定管是否漏水、 是否灵活; 是否灵活; 2)洗涤润洗:用水洗净后,各用少量待装液润洗滴定 )洗涤润洗:用水洗净后, 管2-3次; - 次 3)装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱 )装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、 滴定管中,使液面高于刻度2-3cm 滴定管中,使液面高于刻度 4)赶气泡:碱式 橡皮管向上翘起 )赶气泡:碱式:橡皮管向上翘起 酸式:快速放液 酸式 快速放液 5)调液:调节滴定管中液面高度,在“0-1”ml之间, )调液:调节滴定管中液面高度, 之间, - 之间 并记下读数。 并记下读数。
高考化学总复习《酸碱中和滴定及曲线》专项复习
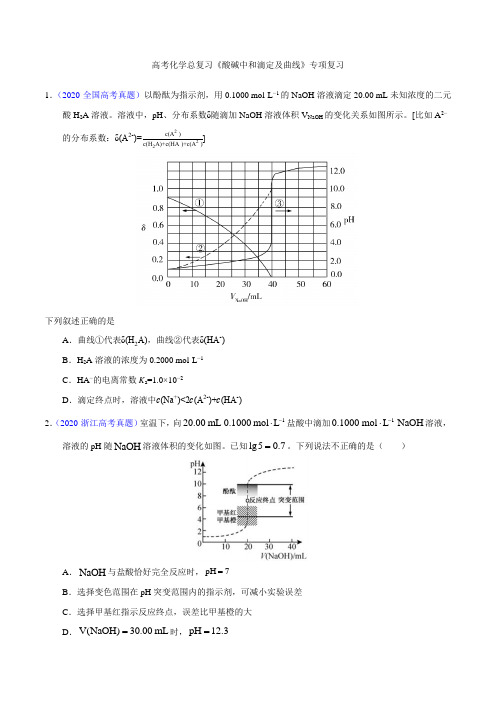
高考化学总复习《酸碱中和滴定及曲线》专项复习1.(2020·全国高考真题)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积V NaOH 的变化关系如图所示。
[比如A 2−的分布系数:δ(A 2-)=c(A 2-)c(H 2A)+c(HA -)+c(A 2-)]下列叙述正确的是A .曲线①代表δ(H 2A),曲线②代表δ(HA -)B .H 2A 溶液的浓度为0.2000 mol·L −1C .HA −的电离常数K a =1.0×10−2D .滴定终点时,溶液中c (Na +)<2c (A 2-)+c (HA -)2.(2020·浙江高考真题)室温下,向120.00mL 0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg50.7=。
下列说法不正确的是( )A .NaOH 与盐酸恰好完全反应时,pH 7=B .选择变色范围在pH 突变范围内的指示剂,可减小实验误差C .选择甲基红指示反应终点,误差比甲基橙的大D .V(NaOH)30.00mL =时,pH 12.3=3.(2020·山东高考真题)25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COO c c -= B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大4.(2019·全国高考真题)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
2020高考酸碱中和滴定测试试卷1及答案解析

2020高考酸碱中和滴定测试试卷1下列有关实验的叙述正确的是( )A.过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率B.用湿润的pH 试纸测溶液的pH,因溶液被稀释而使测量值变大C.酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水D.酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差 2.下列实验操作能达到实验目的的是( )A.酸碱中和滴定时,记录消耗标准液盐酸的体积为20.0mLB.用稀硝酸清洗2H 还原CuO 后内壁附有Cu 和2Cu O 的试管C.将C 与浓24H SO 共热产生的气体通入澄清石灰水检验2COD.配制3FeCl 溶液时,将3FeCl 溶于热水中,冷却后加水稀释3.中和滴定的误差要求小于0.1%,若用20.00 mL0.2000mol·L -1盐酸滴定20.00mL 0.2000mol·L-1NaOH溶液,则中和滴定曲线中发生突变时的pH 范围是( ) (lg2=0.3)A .4.3~9.7B .3.7~10.3C .4.0~10.0D .无法确定4.下列实验符合要求的是( )A .酸碱中和滴定时,锥形瓶经蒸馏水洗净后,即可直接注入待测液进行滴定B .酚酞在pH=10的溶液中是无色的C .若25 mL 滴定管中液面的位置在刻度为10 mL 处,则滴定管中液体的体积一定 等于15 mLD .用玻璃棒蘸取溶液滴在表面皿上的润湿的pH 试纸上,测得其pH 为12 5.下列有关化学实验的描述错误的是( ) A.用加热方法分离NaCl(s)和I 2(s)的混合物B.将分别蘸有浓氨水和浓硝酸的玻璃棒靠近,有白烟产生C.酸碱中和滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差D.用饱和氯化钠溶液可以洗涤除去氯化钠固体表面少量氯化钾杂质 6.下列关于酸碱中和滴定实验的说法正确的是( ) A. 用图B 的滴定管可准确量取25.00mL 的酸性KMnO 4溶液 B. 滴定过程中,眼睛要时刻注视滴定管中液面的变化 C. 滴定管装入液体前需用待装液润洗D. 滴定前平视,滴定结束后仰视读数,不影响测定结果7.下列有关实验的说法正确的是( )A.图A中测定锌粒与l mol/L稀硫酸的反应速率,只需测定注射器中收集氢气的体积B. 图B装置中进行50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1 mol水的热量C. 图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁D. 图D滴定管中液面位置如同所示,则此时的读数为26.50 mL8.84消毒液的pH为10.1,最适宜的测定方法是()A.使用pH试纸B.使用红色石蕊试纸C.使用数字pH计D.以酚酞为指示剂进行酸碱中和滴定9.使用酸碱中和滴定的方法,用0.01mol·L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )A.用量筒量取浓盐酸配制0.1mol·L-1稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸B.配制稀盐酸定容时,俯视容量瓶刻度线C.滴定前尖嘴处无气泡,滴定终点时有气泡D.滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下10.有关下列实验的叙述,正确的是( )A.燃着的酒精灯不慎碰倒失火,应立即用湿布盖灭B.酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗C.用浓氨水洗涤做过银镜反应的试管D.测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比11.下列说法正确的是( )KMnO溶液A.图I中滴定管可准确量取25.00mL酸性4B.图II为用已知浓度的氢氧化钠溶液滴定未知浓度盐酸的实验C.中和滴定实验时,滴定管需用待装液润洗2~3次D.中和滴定实验时,用待测液润洗锥形瓶12.某学生的实验报告中,描述合理的是()A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaClKMnO溶液C.用25mL碱式滴定管量取出15.00mL4D.用25mL碱式滴定管做酸碱中和滴定实验时,共用去某浓度的碱溶液21.70mL13.下列有关化学实验的描述错误的是( )A.用加热方法分离NaCl(s)和I2(s)的混合物B.将分别蘸有浓氨水和浓硝酸的玻璃棒靠近,有白烟产生C.酸碱中和滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差D.用饱和氯化钠溶液可以洗涤除去氯化钠固体表面少量氯化钾杂质14.下列有关仪器使用方法或实验操作正确的是( )A.用pH试纸测定次氯酸溶液的pHB.用酸式滴定管量取18.80mL KMnO4溶液C.酸碱中和滴定实验中,洗净的锥形瓶放进烘箱中烘干以减小实验误差D.配制一定浓度的稀硫酸,用量筒量取浓硫酸时俯视刻度线,所配溶液浓度偏大15.下列有关实验操作的说法正确的是( )A.实验时手指不小心沾上苯酚,立即用浓NaOH溶液清洗B.用润湿的红色石蕊试纸置于试管口,试纸变蓝,证明有氨气产生C.将氯化铝溶液加热蒸发,最后可得到氯化铝晶体D.酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液16.利用电导率传感器可绘制电导率曲线图,如图为用0.1mol·L-1 NaOH溶液滴定10mL 0.1mol·L-1盐酸过程中的电导率曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【学习目标】 1、掌握酸碱中和滴定的原理; 2、初步掌握酸碱中和滴定的方法。 【要点梳理】
要点一、中和滴定的原理和方法。
1、定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法叫中和滴定 法。
2、原理:在中和反应中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶方程式中酸、碱物质的量的比求出未知溶液的物质的量浓度。
要点诠释:(1)锥形瓶不能用待测液润洗,润洗后,瓶内壁会附着一定量的待测液。 (2)在滴定过程中,锥形瓶中液体用水冲稀,对实验结果无明显影响。 (3)滴定管在加入反应液之前要用所要盛装的反应液润洗,否则装入的液体会被稀释,影响结果。 3、实验步骤(以标准盐酸滴定待测 NaOH 溶液为例)。 ①滴定管的检漏。 ②洗涤:分别取酸式滴定管和碱式滴定管各一支(注意分析它们的结构),用清水洗净,再 用标准酸液和待测碱液各润洗 2~3 次,润洗液必须从滴定管下端排出。 ③装液:向滴定管中装入标准液,赶走气泡,使液面刻度在“0”刻度或“0”以下某一刻 度处,记录读数,从碱式滴定管中放出一定体积碱液到洗净的锥形瓶中。 ④滴定:往锥形瓶中加入 2 滴~3 滴酚酞溶液,再向锥形瓶中滴加标准盐酸(先快后慢)。 当滴定快到终点时应一滴一摇,若指示剂在半分钟内不变色,视为已到终点。滴定时应左手控 制活塞,右手摇动锥形瓶(如图),两眼注视锥形瓶中颜色的变化。 ⑤计算:定量测定时,只有多次重复实验才能排除偶然因素,减少实验误差。应依原理取两次或多次消耗标 准溶液体积的平均值,求出
c(NaOH) c(HCl)V (HCl) 。 V (NaOH)
要点三、中和滴定误差分析
误差分析依据:
c(B) c(A)V (A) 或 c(A) c(B)V (B) 。
V (B)
V (A)
若用标准溶液滴定待测液,消耗标准溶液多,则结果偏高;消耗标准溶液少,则结果偏低。分析误差时应设
定 c 标、V 待为不变值,将所有因素归结到 V 标上,凡使 V 标偏大的因素均使 c 待偏高,反之亦然。归纳起来,中和 滴定的误差分析如下表所示(以用标准盐酸溶液滴定待测 NaOH 溶液为例):
强碱用甲基橙或酚酞指示剂。当指示剂可以有多种选择时,选择的指示剂最好是到达滴定终点时由浅
变深发生变化。中和滴定时,一般情况下是把已知物质的量浓度的标准溶液滴入待测的未知浓度的溶
液中,但把未知物质的量浓度的溶液滴入已知物质的量浓度的溶液中,只要操作正确,也可以求得待
测溶液的浓度。
【点拨】在中和滴定实验中,已知浓度的标准液是放在锥形瓶中还是滴定管中是人为规定的,只要指示剂和
步骤
操作
c(NaOH)
未用标准溶液润洗滴定管
偏高
锥形瓶用待测溶液润洗 洗涤
未用待测溶液润洗取待测液的滴定管
偏高 偏低
锥形瓶洗净后瓶内还残留有蒸馏水
无影响
滴定前滴定管尖嘴部分有气泡
偏高
滴定 滴定过程中振荡有液滴溅出
偏低
滴定时有几滴标准溶液附在锥形瓶瓶壁上
偏高
滴定前仰视读数或滴定后俯视读数 读数
滴定前俯视读数或滴定后仰视读数
要点二、中和滴定操作。
1、中和滴定的仪器和试剂。 ①仪器。酸式滴定管(不能盛放碱性溶液、水解呈碱性的盐溶液、氢氟酸)、碱式滴定管、铁架台、滴定管
夹、烧杯、锥形瓶等。
②试剂。标准溶液、待测溶液、指示剂、蒸馏水。 2、准备过程。 ①滴定管的使用: a.检验酸式滴定管是否漏水(碱式滴定管同样检验)。 b.洗净滴定管后要用标准液润洗 2~3 次,并排除滴定管尖嘴处的气泡。 c.注入液体:分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上 2 mL~3 mL 处,并将滴定管垂直固定在滴定管夹上。 d.调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液(如 果酸式滴定管尖嘴部分有气泡,应快速放液以赶走气泡;除去碱式滴定管胶管中气泡的方法 如图所示),并使液面处于某一刻度,准确读取读数并记录。 ②锥形瓶:只能用蒸馏水洗涤,不能用待测液润洗。
锥形瓶中的溶液 滴定管中的溶液 选用指示剂
选用滴定管
A
碱
酸
石蕊
乙
B
酸
碱
酚酞
甲
C
碱
酸
甲基橙
甲
D
酸
碱
酚酞
乙
【答案】C、D
【解析】本题考查中和滴定中酸式滴定管、碱式滴定管和酸碱指示剂的选择。甲为酸式滴定管,
乙为碱式滴定管,酸性溶液、强氧化性溶液(如 KMnO4 溶液)一般装在酸式滴定管中,碱性溶液一 般装在碱式滴定管中。指示剂的选择比较复杂。一般情况下,强碱滴定强酸用酚酞指示剂,强酸滴定
3、关键:①准确测定参加反应的两种溶液的体积;②准确判断中和反应是否恰好完全反应。 4、指示剂的使用。 ①用量不能太多,常用 2~3 滴,因指示剂本身也是弱酸或弱碱,若用量过多,会使中和滴定中需要的酸或 碱的量增多或减少。 ②指示剂的选择。 选择指示剂时,滴定终点前后溶液的颜色改变:颜色变化对比明显。 如强酸与强碱的中和滴定,到达终点时,pH 变化范围很大,可用酚酞,也可用甲基橙;强酸滴定弱碱,恰 好完全反应时,生成的盐水解使溶液呈酸性,故选择在酸性范围内变色的指示剂——甲基橙;强碱滴定弱酸,恰 好完全反应时,生成的盐水解使溶液呈碱性,故选择在碱性范围内变色的指示剂——酚酞。 一般不用石蕊试液,原因是其溶液颜色变化对比不明显,且变色范围较大。
滴定管能够和实验要求相符合(指示剂变色范围在终点 pH 突变范围之内,滴定管不过大或过小)即可。 举一反三:
【变式 1】用 NaOH 溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知 NaOH 是否过量,判断它是
否过量的方法是( )。
偏低 偏高
要点诠释:读数误差可以用画图的形式来理解和记忆。如开始仰视读数,滴定完毕俯视读数,结果偏低;开
始俯视读数,滴定完毕仰视读数,结果偏高,如图。
读数时使眼睛和液面凹面最低点及刻度线保持水平,读取与液面凹面相切处的数据。
【典型例题】
类型一、仪器的使用和指示剂的选择
例 1、用已知浓度的 NaOH 溶液测定某 H2SO4 溶液的浓度,参考下图,从下表中选出正确选项( )
