完成下列化学反应方程式
完成下列化学方程式

完成下列化学方程式镁+氧气点燃氧化镁碳+氧气点燃二氧化碳硫+氧气点燃二氧化硫磷+氧气点燃五氧化二磷铁+氧气点燃四氧化三铁氢气+氧气点燃水铜+氧气加热氧化铜水+二氧化碳—-碳酸碱式碳酸铜△氧化铜+二氧化碳+水高锰酸钾加热锰酸钾+二氧化锰+氧气过氧化氢二氧化锰水+ 氧气水通电氢气+氧气碳酸氢铵加热氨气+ 二氧化碳+ 水碳酸加热二氧化碳+ 水碳酸钙+ 盐酸——氯化钙+ 二氧化碳+ 水二氧化碳+ 氢氧化钙—碳酸钙+ 水碳酸钠+盐酸—氯化钠+二氧化碳+水碳酸钙+稀硫酸—硫酸钙+二氧化碳+水硫酸铜+ 氢氧化钠—氢氧化铜+ 硫酸钠化学反应中的质量关系1. 现将10gA 和足量的B 混合加热,A 和B 发生化学反应。
10gA 完全反应后生成8gC 和4gD ,则参加反应的A 与B 的质量比是 ( )A .1:1 B. 2:1 C. 5:1 D. 4:12. 现有化学反应A+B=C ,若将a 克A 与b 克B 在适当条件下充分反应后,分析得知,剩余为一混合物,则生成C 的质量为 ( )A.等于(a+b)克B.大于(a+b)克C.小于(a+b)克D.不大于(a+b)克 3. 蜡烛燃烧前的质量为a g ,燃烧后的质量为b g ,生产的CO 2为c g ,水蒸气为d g ,则产物共 g ,参加反应的氧气的质量为 g 。
4. 在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反映后。
测得反应前后各物质的质量如下表:下列说法错误的是 ( )A.该反应是分解反应 B.甲可能是该反应的催化剂 C.乙、丙变化的质量比为9:8 D.反应后甲的质量为0g5. 在一密闭容器中,盛放A 、B 、D 三种物质各30克,经电火花引燃,充分反应后,各物质的质量变化如下:关于此反应,下列认识不正确的是 ( )A. C 物质中所含有的元素种类是A 、B 、D 三种物质中所有元素种类之和B. 变化后待测的A 质量为5克C. 该变化的基本反应类型是分解反应D. A 物质有可能是单质6.联肼(N2H4)和一氧化氮(NO)反应产生的能量可以作为火箭发射的动力,反应后生成两种物质,其中一种是空气中含量最高的气体,另一种是植物光合作用的原料之一,这两种物质是 ( ) A.N2和CO 2 B.N2和H2O C.N2和O 2D.O2和H2O7. 某物质在空气中完全燃烧生成8.8克二氧化碳和5.4克水,则关于这种物质的组成描述正确的是()A.该物质只含有碳元素和氢元素B.该物质中碳元素与氢元素的质量比为12:1C.该物质一定含有碳元素和氢元素,可能含有氧元素D.该物质的分子中碳原子和氢原子的个数比为1:28、常用燃烧法测定有机物的组成,现取3.2克某有机物在足量氧气中充分燃烧,生成 4.4克二氧化碳和 3.6克水,则该有机物中()A、一定含有C、H两种元素,可能含有氧元素B、.一定含有C、H、O三种元素C、一定含有C、O两种元素, 可能含有H元素D、只含有C、H两种元素9.A、B、C三种物质各15克,它们化合时只能生成30克新物质D。
大学有机化学试题1..
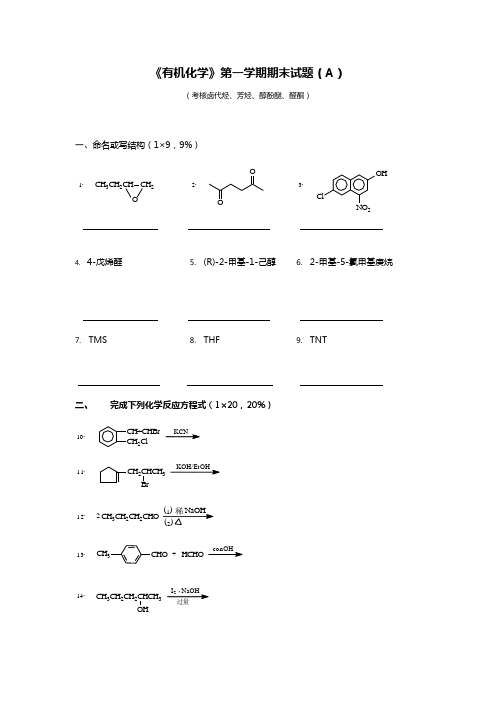
《有机化学》第一学期期末试题(A )(考核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构(1×9,9%)CH 3CH 2CH CH 2O1.OO2.ClNO 2OH3.4. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2-甲基-5-氯甲基庚烷7. TMS8. THF9. TNT二、完成下列化学反应方程式(1×20,20%)CH=CHBr CH 2ClKCN10.CH 2CHCH 3BrKOH/EtOH11.CH 3CH 2CH 2CHO212.CHOCH 3HCHOconOH-+13.CH 3CH 2CH 2CHCH 3OHI 2 NaOH 过量14.(CH 3)2CHOHPBr 315.CH 3(CH 2)3Cl+16.AlCl 3OH OHH+17.CH 3MgBr18.HCHO 乙醚,H 3O+OPh 3P=CH 2+20.CH 3CH 2CH 2CHO21.+NaHSO 3(饱和O CO22.(CH 3)2CHMgBr23.O(1)醚(2)2+OCH 2CH=CHREt Me200C。
24.OHH 2SO 4HNO 325.HCHOHCl26.++ZnCl 2无水CH 3CH=CHCH 2CH 2CHOAg(NH 3)2+OH-27.C CH 3H 3C OHCHON H++H+28.2C 2H 5OH Odry HCl29.+三、有机理论部分(5×5,25%)30按沸点从大到小排列成序,并简要说明理由。
CH 2CH CH 2OH OH OHCH 3CH 2CH 2OH CH 3CH 2CH 2OCH 3CH 2CH CH 2OH OH OCH 3(a)(b)(c)(d)31.按羰基的活性从大到小排列成序,并简要说明理由。
CH 3CH O CH 3CCHOO CH 3CCH 2CH 3O (CH 3)3CCC(CH 3)3O(a)(b)(c)(d)32.解释:为什么化合物无论是进行S N 1还是进行S N 2反应都十分困难?33.写出反应机理CH 2CH 2ClClCH CH 3+(过量)AlCl 3无水34.写出反应机理OO四、有机结构分析部分(4×4,16%)35.用化学方法鉴别化合物C2H5Br CH3O CH2Br C2H5OHA B C36.用化学方法鉴别化合物O OH OHOHA B C D37.根据所给化学式、IR、NMR主要数据,推测化合物的结构C4H8O IR/cm-1: 2970, 2878, 2825, 2718, 1724; NMR: δH: 9.5(三重峰,1H)38.化合物A的分子式为C8H14O。
宋天佑无机(二)习题答案

12-2 完成并配平下列反应的化学方程式。
(1) H2+Ca=CaH2(2) Fe2O3+3Na2O2=2Na2FeO4+Na2O(3) BaO2+H2SO4=BaSO4+H2O2(4) Li2CO3=Li2O+CO2(5) 5Na2O2+2MnO4-+16H+=5O2+2Mn2++10Na++8H2O(6) 2Na2O2+2H2O=4NaOH+O2(7) 2Na2O2+2CO2=2Na2CO3+O2(8) 4KO3+2H2O=4KOH+5O2(9) Mg3N2+6H2O=3Mg(OH)2+2NH3(10) TiCl4+4Na=4NaCl+Ti12-6 拟除掉BaCl2溶液中的少量FeCl3杂质,试分析加入Ba(OH)2和BaCO3哪种试剂更好。
解:加入Ba(OH)2更好。
Ba(OH)2和BaCO3与FeCl3发生的反应分别为:2FeCl3+3BaCO3+3H2O=2Fe(OH)3+3BaCl2+3CO22FeCl3+3Ba(OH)2=2Fe(OH)3+3BaCl2由反应方程式可知,BaCO3与FeCl3反应产物中有CO2,CO2不能完全脱离体系,有杂质存在。
而Ba(OH)2与FeCl3反应没有杂质生成,若Ba(OH)2过量可以定量加入HCl转化为BaCl2。
12-16 在温度高于1020 K条件下,BeCl2气体以单分子形态存在,其中Be为杂化;当BeCl2气体温度低于该温度时,以二聚体形式存在,其中Be为sp2杂化;无水固态BeCl2具有链状结构,其中Be为sp3杂化。
试分析上述各种BeCl2的成键形式与空间构型。
解:单分子中Be以sp方式杂化,形成两个有单电子的杂化轨道,在空间呈直线型分布。
每个含有单电子的sp杂化轨道与Cl原子的单电子轨道重叠形成σ键,故BeCl2单分子呈直线型。
ClBe Cl二聚体中,Be 以sp 2方式杂化,形成两个有单电子的杂化轨道和一个空的杂化轨道,杂化轨道为平面三角形。
陈金珠编有机化学全部答案

第1章 饱和烃(一)思考题部分思考题1-1写出分子式为C 6H 14烷烃的所有构造异构体。
CH 3CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 3CH 3CH 3CH 2CHCH 2CH 33CH 3CHCHCH 3CH 3CH 3CH 3CCH 2CH 33CH 3思考题1-2下列化合物哪些是同一化合物?哪些是构造异构体?同一化合物:(2)和(6);(3)、(4)和(5) 构造异构体:(1)、(2)和(3)思考题1-3用系统命名法命名下列化合物。
(1)2,2,4-三甲基戊烷 (2) 3,6-二甲基-4-乙基-5-丙基辛烷 (3)2,3,4-三甲基-5-乙基辛烷 思考题1-4写出下列化合物的构造式(1) CH 3CH 22CH 33CH 3 (2) CH 3CCH 3CH 3CH CH 3CH 3(3) CH 3CHCH 2CH 2CH 33思考题1-5写出下列每一个构象式所对应的烷烃的构造式。
(1) CH 3CHCH 33(2)CH 3CHCH 2CH 3CH 3(3) CH 3CH 22CH 3CH 3CH 3思考题1-6写出下列化合物最稳定的构象式,分别用伞形式和Newman 投影式表示。
(1)C HCH 12 (2)C HCH 12思考题1-7比较下列各组化合物的沸点高低,并说明理由。
(1)正丁烷>异丁烷 (2) 正辛烷>2,2,3,3-四甲基丁烷(3) 庚烷>2-甲基己烷>3,3-二甲基戊烷理由:烷烃异构体中,直链烷烃的沸点比支链烷烃沸点高。
思考题1-8已知烷烃分子式为C 5H 12,根据氯代反应产物的不同,试推测各烷烃的结构并写出结构式。
(1)和(4):C 3H 3C CH 3CH 3(2) CH 3CH 2CH 2CH 2CH 3 (3)CH 3CH CH 23CH 3思考题1-9试写出分子式为C 6H 12的环烷烃的所有构造异构体并命名。
有1,2,3-三甲基环丙烷(这个也有一对顺反异构体)、1-甲基-2-乙基环丙烷(注意1号碳和2 号碳都是手性碳原子,所以有4个旋光异构体)、1,1,2-三甲基环丙烷(2号碳为手性碳原子,有一对旋光异构体)、1-正丙基环丙烷、1-异丙基环丙烷、1-甲基-1-乙基环丙烷、1-乙基环丁烷、1,1-二甲基环丁烷、1,2-二甲基环丁烷(注意1号碳和2号碳都是手性碳原子,有3个旋光异构体,其中两个互为对映体,另一个是内消旋体)、1,3-二甲基环丁烷(这个也有一对顺反异构体)、1-甲基环戊烷、环己烷。
大学有机化学试题1

《有机化学》第一学期期末试题(A)(考核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构(1×9,9%)CH3CH2CHCH2O1.OO2.ClNO2OH3.4. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2-甲基-5-氯甲基庚烷7. TMS 8. THF9. TNT二、完成下列化学反应方程式(1×20,20%)CH=CHBrCH2Cl KCN10.CH2CHCH3Br KOH/EtOH11.CH3CH2CH2CHO2(2)NaOH(1)稀12.CHOCH3HCHO conOH-+13.CH 3CH2CH2CHCH3OH I2NaOH,过量14.(CH3)2CHOH PBr315.CH 3(CH2)3Cl+16.AlCl3OHOH H+17.CH 3MgBr18.HCHO乙醚,H3O+OPh 3P=CH2+20.CH3CH2CH2CHO21.+NaHSO3(饱和)OCO22.混酸(CH3)2CHMgBr23.O(1)醚(2)H2O/H+OCH2CH=CHREtMe200C。
24.OH H2SO4HNO325.HCHO HCl26.++ZnCl 2无水CH3CH=CHCH2CH2CHO Ag(NH 3)2+OH-27.CCH3H3C OHCHON H++H +28.2C 2H5OH O dry HCl29.+三、有机理论部分(5×5,25%)30按沸点从大到小排列成序,并简要说明理由。
CH2CHCH2OHOHOHCH3CH2CH2OHCH3CH2CH2OCH3CH2CHCH2OHOHOCH3(a)(b)(c)(d) 31.按羰基的活性从大到小排列成序,并简要说明理由。
CH3CHOCH3CCHOOCH3CCH2CH3O(CH3)3CCC(CH3)3O(a)(b)(c)(d)32.解释:为什么化合物无论是进行S N1还是进行S N2反应都十分困难?33.写出反应机理ClCH2CH2ClCl CHCH3+(过量)AlCl3无水34.写出反应机理O KOH, H2O OO四、有机结构分析部分(4×4,16%)35.用化学方法鉴别化合物C2H5BrCH3OCH2BrC2H5OH ABC36.用化学方法鉴别化合物O H OOHOH ABCD37.根据所给化学式、IR、NMR主要数据,推测化合物的结构C4H8O IR/cm-1: 2970, 2878, 2825, 2718, 1724; NMR: δH: 9.5(三重峰,1H) 38.化合物A的分子式为C8H14O。
写出下列反应的化学方程式:(1)...

(2010?昆明)写出下列反应的化学方程式:
(1)二氧化碳和水反应;
(2)电解水;
(3)一氧化碳高温还原磁铁矿(主要成分Fe3 O4);
(4)乙烯(C2H4)燃烧生成二氧化碳和水;
(5)向空中播撒碘化银(AgI)微粒可进行人工降雨,碘化银在光照条件下可分解为碘单质(I2)和银单质.
【答案】分析:(1)根据二氧化碳和水会发生化合反应生成碳酸进行书写,
(2)根据水在通电的条件下生成氢气和氧气进行书写,
(3)根据一氧化碳还原氧化铁的原理书写方程式,
(4)根据有机物燃烧会生成二氧化碳和水进行书写,
(5)根据碘化银分解的原理进行书写.
根据题中给出的叙述确定反应物、生成物以及反应条件,依据书写方程式的原则进行书写方程式.
解答:解:(1)二氧化碳和水反应生活成碳酸,所以方程式为:CO2+H2O=H2CO3,
(2)水在通电的条件下生成氢气和氧气,所以方程式为:2H2O2H2↑+O2↑,
(3)一氧化碳和四氧化三铁在高温的条件下生成铁和二氧化碳,所以方程式为:4CO+Fe3O43Fe+4CO2,
(4)反应物是乙烯和氧气,生成物是水和二氧化碳,反应条件是点燃,所以方程式为:C2H4+3O22CO2+2H2O,
(5)反应物是碘化银,生成物是银和碘单质,反应条件是光照,所以方程式为:2AgI2Ag+I2.
点评:依据题中所给的条件书写方程式是考试的热点问题,在平时的学习中要加强这方面的记忆.。
高中化学反应方程式

高中化学反应方程式高中化学反应方程式:1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl- =AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH –+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH –+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3- +H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3- +CH3COOH=CO2 ↑+H2O+CH3COO -7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3- +Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH –=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH –=CaCO3↓+H2O10 、澄清石灰水与少量小苏打溶液混合:Ca2++OH –+HCO3- =CaCO3↓+H2O11 、澄清石灰水通入少量CO2:Ca2++2OH –+CO3=CaCO3↓+H2O12 、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13 、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH –+2HCO3- =CaCO3↓+CO32– +2H2O14 、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH –+Ca2+=CaCO3↓+H2O15 、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH –+NH4++HCO3- =BaCO3↓+H2O+NH3?H2O16 、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或 CO32–+2H+=CO2↑+H2O17 、向氢氧化钠溶液中通入少量的CO2?:CO2+2OH–=CO32 –+H2O18 、过量的 CO2 通入氢氧化钠溶液中:CO2+OH–=HCO3-19 、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH –=NH3↑+CO32–+2H2O20 、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21 、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO- +CO2↑+H2O。
方程式总结习题答案

方程式总结习题答案1、完成并配平下列反应方程式:+H2O(1) XeF4+CIO3- XeOF4+CI2+H2O(2) XeF4+Xe ----- 2XeF2(4)6XeF4+12H2O^ 2XeO3+3Xe+24HF+3O2(5)2XeO3+2Ba(OH)2Ba2XeO6+Xe+O2+H 2O(6) 2XeF6+SiO22XeOF4+SiF42、写出过氧化钠和下列物质的反应式:NaCrO2,CO2,H2O,H2SO4 (稀)。
2NaCrO2+3Na2O2+2H2^ 2Na2CrO4+4NaOH2CO2+2Na?O2 = 2Na?CO3+O2 彳2H2O+2Na2O2^= 4NaOH+O2|2H?SO4(稀)+2Na2O2^^^^ ZNa z SO q+ZH g O+O 2^3、以反应式表示下列反应过程并注明反应条件(1)用过量HCIO3处理12:2HCIO3+I2 2HIO3+CI2紫黑色或棕色I2消失,并有CI2气体生成。
(2)氯气长时间通入KI溶液中CI2+2KI ^=2KCI+I25CI2+I2+6H2O 2HIO3+10HCI先有I2生成,溶液由无色变黄、变橙、变棕直至析出紫黑色沉淀,最后紫黑色沉淀消失得无色溶液。
(3)氯水滴水KBr、KI混合液中CI2+2KI ^=2KCI+l25CI2+12+6H 2O 2HIO 3+10HCICS+2KBr ^=2KCI+Br2溶液先变黄或橙,又变浅至近无色,最后又变黄或橙。
4、完成并配平下列反应式:(1) H2S 4H2O2 H2SO4 4H2OH2S4H (^=H2SQ+ 4H O(2)H2S 4Br2 4H 2O H 2SO4 8HBr(3)H2S l2 2HI S,(4)H2S O2 = 2S軌2出0(5)3H2S CIO「^ 3S』W CI 一3H2O(6)2Na2S Na2SO3 6H 3S 3H2O 6Na(7)2Na2S2O3 I Na2S4O6 2NaI(8)Na2S2O3 4CI2 5H2O Na2SO4 H2SO4 8HCI(9)SO2 2H2O Cl2H2SO4 2HCI(10)5H2O2 2KMnO 4 6H 2Mn 2 5O2 8H2O(11)2Na2O2 2CO22Na2CO3 O2(12)2KO2 2H2。
