溶质质量分数计算专题
溶质的质量分数计算专项训练
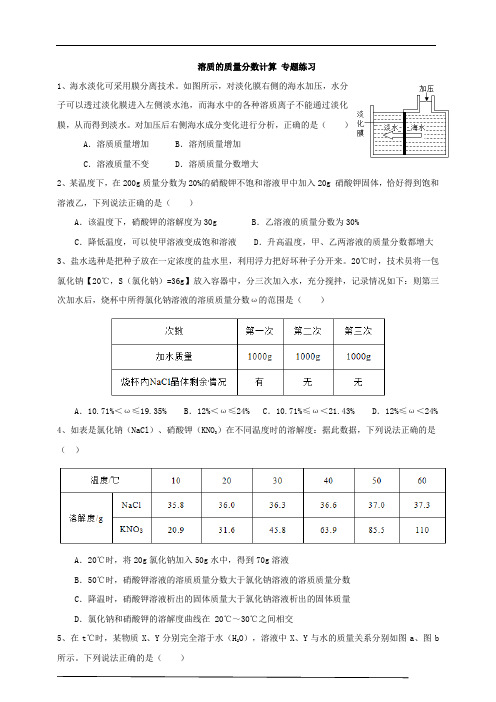
溶质的质量分数计算专题练习1、海水淡化可采用膜分离技术。
如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种溶质离子不能通过淡化膜,从而得到淡水。
对加压后右侧海水成分变化进行分析,正确的是()A.溶质质量增加 B.溶剂质量增加C.溶液质量不变 D.溶质质量分数增大2、某温度下,在200g质量分数为20%的硝酸钾不饱和溶液甲中加入20g 硝酸钾固体,恰好得到饱和溶液乙,下列说法正确的是()A.该温度下,硝酸钾的溶解度为30g B.乙溶液的质量分数为30%C.降低温度,可以使甲溶液变成饱和溶液 D.升高温度,甲、乙两溶液的质量分数都增大3、盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。
20℃时,技术员将一包氯化钠【20℃,S(氯化钠)=36g】放入容器中,分三次加入水,充分搅拌,记录情况如下:则第三次加水后,烧杯中所得氯化钠溶液的溶质质量分数ω的范围是()A.10.71%<ω≤19.35% B.12%<ω≤24% C.10.71%≤ω<21.43% D.12%≤ω<24% 4、如表是氯化钠(NaCl)、硝酸钾(KNO3)在不同温度时的溶解度:据此数据,下列说法正确的是()A.20℃时,将20g氯化钠加入50g水中,得到70g溶液B.50℃时,硝酸钾溶液的溶质质量分数大于氯化钠溶液的溶质质量分数C.降温时,硝酸钾溶液析出的固体质量大于氯化钠溶液析出的固体质量D.氯化钠和硝酸钾的溶解度曲线在 20℃~30℃之间相交5、在t℃时,某物质X、Y分别完全溶于水(H2O),溶液中X、Y与水的质量关系分别如图a、图b 所示。
下列说法正确的是()A.X、Y都只能是固体 B.两种溶液一定是饱和溶液C.图示溶液的浓度:X<Y D.t℃时X、Y的溶解度:X<Y6、下列说法正确的是()A.凡是均一的、稳定的液体一定是溶液B.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液C.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%D.将硝酸铵固体溶于水,溶液的温度升高7、在一定温度下,向一定量的不饱和食盐溶液中逐渐加入食盐固体,并搅拌,在此过程中,溶液里溶质的质量分数(a%)随加入溶质质量(m)的变化关系如图所示,其中正确的是()A.B.C D.8、下列有关溶液的说法中,正确的是()A.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数不一定增大B.均一稳定的液体一定是溶液C.氢氧化钙的饱和溶液一定比其不饱和溶液浓度大D.将5g某物质投入100g水中形成的溶液质量一定为105g9、如图中曲线为KNO3饱和溶液的质量分数(W)随温度(T)变化的曲线。
初三化学 有关溶质质量分数的计算典型五种例题

有关溶质质量分数的计算的五种典型题目第1课时题型一:例题1.每天补充适量的维生素C,有利于提高人体免疫力。
某维生素C泡腾片,每片含1g维生素C,将1片该泡腾片投入适量水中,最终得到250g溶液,计算此溶液中维生素C的质量分数。
练习1.蒸干15克NaCl溶液得到1.2克NaCl,计算原溶液中NaCl的质量分数。
练习2.在一定温度时,NaCl饱和溶液的质量是12g,把它蒸干后,得到3.2gNaCl,计算:(1)该温度时NaCl饱和溶液中溶质的质量分数(2)配制该温度时NaCl饱和溶液1000g,需水和NaCl各多少g?(3)这一温度下NaCl的溶解度?练习3.在80g质量分数为15%NaNO3溶液里加入20g水或20g NaNO3,计算这两种方法制成的两种溶液中溶质的质量分数。
题型二:例题1.某温度时,氯化钾的溶解度为40g,求该温度时,氯化钾饱和溶液中溶质的质量分数。
例题2.10L密度为1.84g/cm3、溶质质量分数为98%的浓硫酸,其中溶液质量为 ,溶质质量为。
练习1.配制500mL质量分数为10%NaOH溶液(密度为1.1g/cm3),需NaOH和H2O 各多少克?练习2.从10L密度为1.84 g/cm3、溶质的质量分数为98%的浓硫酸中取出1L,取出的溶液中溶质的质量分数为,溶质质量为,含纯硫酸的质量为。
练习3.下列四种KCl溶液,溶质的质量分数最大的是()A.15gKCl溶于85g水中B.85g溶液中含有KCl的质量为15gC.20gKCl配成120g溶液D.一定量的KCl加入80g水配成100g溶液第2课时题型三:例题1.把50g质量分数为98%的H2SO4溶液稀释成质量分数为20%的硫酸溶液,需要加水多少克?练习1.需要配制500g质量分数为10%的盐酸,需要质量分数为38%的盐酸(密度为1.19g/cm3)多少毫升?练习2.配制500mL质量分数为20%的H2SO4溶液,需要质量分数为98%H2SO4溶液多少毫升?需要加水多少毫升?查阅资料:密度(g/cm3) 1.07 1.14 1.30 1.5 1.81 1.84% 10 20 40 60 90 98练习3:将100g10%的蔗糖溶液的溶质质量分数为20%,可采用的方法有 ( ) A.加入10g蔗糖 B.蒸发掉50g水C.把溶剂蒸发掉一半D.加入12.5g蔗糖题型四:例题1.50g10%的KNO3溶液与50g30%的KNO3溶液混合后,所得混合溶液的溶质质量分数是多少?练习1.100mL20%的食盐水与200mL20%的食盐水相混合,得到食盐水的溶质质量分数为()A.5% B.10% C.15% D.20%题型五:例题1.含80g碳酸钙的石灰石跟稀盐酸反应来制取二氧化碳,求:(1)制得多少克二氧化碳?(2)若所用盐酸的质量分数为36.5%,密度为1.19g/cm3,需用盐酸多少毫升?例题2.32.5g锌可以与200g某稀硫酸恰好完全反应,计算:(1)这种稀硫酸中溶质的质量分数是多少?(2)反应后所得溶液中溶质的质量分数是多少?(3)若将100g这种稀硫酸稀释成溶质的质量分数为20%的硫酸溶液,需要加水多少克?练习1.139mL密度为1.05g/cm3的盐酸与石灰石25g恰好完全反应,生成8.8g 二氧化碳.计算:(1)盐酸中溶质质量分数;(2)石灰石中碳酸钙的质量分数;(3)生成溶液中溶质的质量分数。
专题12 溶质的质量分数计算-2020年中考化学总复习专题训练精选(解析版)

专题训练十二、溶质的质量分数计算选择题:1、常温下,将2g 的下列物质放入烧杯中,然后向烧杯中加入98g 水,用玻璃棒搅拌后充分溶解后,所得溶液质量分数大于2%的物质是( )A 、生石灰B 、胆矾C 、烧碱D 、二氧化硫 【答案】D【解析】A 选项,氧化钙溶于水生成氢氧化钙,氢氧化钙常温下的溶解度约为0.018,属于微溶物,此时氢氧化钙为饱和溶液,质量分数小于2%;B 选项,胆矾是五水硫酸铜晶体,2g 的胆矾中减去结晶水的质量,硫酸铜的质量小于2g ,溶于水后质量分数小于2%;C 选项,烧碱(NaOH )全部溶解质量分数等于2%;D 选项,二氧化硫溶液水生成亚硫酸,质量大于2g ,所以质量分数大于2%,故选D 。
2、在常温下向100g 、5%的氯化钠溶液中加入10g 氯化钾粉末,完全溶解后,未见固体物质析出,则下列有关质量分数的说法正确的是( ) A 、混合溶液中的氯化钠的质量分数没变 B 、混合溶液中的氯化钠质量分是变大 C 、混合溶液中的氯化钾质量分数为10.0% D 、混合溶液中的氯化钾质量分数为9.1% 【答案】D【解析】氯化钠溶液中溶质氯化钠的质量=100*5%=5g ,加入10g 氯化钾全部溶解,变为混合溶液,此时溶液质量为110g ;混合溶液中:氯化钠的质量分数=%5.4%100101005=+;氯化钾的质量分数=%1.9%1001010010=+故选D 。
3、将80g 、分量分数20%的氢氧化钠溶液加水稀释至100g 后,取出其中10g ,则下列说法正确的是( ) A 、稀释前溶液质量分数小于稀释后取出10g 溶液的质量分数B 、取出的10g 的溶液质量分数为1.6%C 、加水稀释后的溶质质量分数为8.8%D 、稀释前、后溶质质量不变 【答案】D【解析】A 选项,稀释前溶质质量分数大于稀释后溶质质量分数;稀释前质量分数20%;稀释后质量分数=%16%100100%20*80=,B 选项,取出10g 后质量分数不变,还是16%。
溶质的质量分数计算题

溶质的质量分数计算题一、固体物质未完全溶解型1、20℃时,将50g NaCl放入100g水中,充分搅拌后所得NaCl溶液的溶质质量分数是(20℃时NaCl的溶解度为36g)二、结晶水合物溶于水型2、将10g胆矾溶解在90g水中,则所得溶液中溶质的质量分数为三、所加物质与水反应型3、将31g Na2O溶于69g水中,所得溶液中溶质的质量分数是多少?四、多种溶质型4、在常温下向100g 5%的氯化钠溶液中加入5g氯化钾粉末,完全溶解后,氯化钠溶液的溶质质量分数是五、将浓溶液加水稀释型5、把40g 30%的NaOH溶液加水至100g,取出其中的10g,这10g溶液中溶质的质量分数是六、与化学反应有关型6、向400g溶质的质量分数为4.9%的稀硫酸中加入足量的锌粒,充分反应后,求所得溶液中溶质的质量分数为多少?7、8g三氧化硫加入到92g水中完全溶解,求所得溶液的溶质质量分数?8、20℃向71g20%的硫酸钠溶液中加入30。
6g氯化钡和氯化钠的混合物,反应恰好完全,求1、反应后所得溶液的溶质质量分数;2、将反应后的混合物过滤,所得滤渣的质量为多少g?(已知,20℃时,食盐的溶解度为36g)Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl 9、含有杂质的5.5gNa2CO3固体投入36。
5g10%的盐酸溶液中,刚好完全反应,求反应后所得溶液中溶质的质量分数?(假设杂质不参与反应)七、与溶解度有关10、已知氯化铵在30℃时的溶解度为45。
8克。
30℃时将68。
7克氯化铵配制成400克的溶液,通过计算:(1)溶液是否饱和?(2)若不饱和,为了使其饱和,可用下面的方法:①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?12、现有500g20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5gA 析出,若再蒸发掉20g水后,又有7gA 析出,则在20℃时A物质的溶解度是13、20℃时,将一定质量的NH4NO3完全溶解于100g水中,将所得溶液分成两等份,其中一份蒸发18.75g水,可使溶液饱和,另一份加入36g NH4NO3也达饱和,求⑴20℃时, NH4NO3的溶解度。
有关溶质质量分数的计算精选题

有关溶质质量分数的计算精选题一、选择题(本题共计 10 小题,每题 3 分,共计30分,)1. 在Mg食盐溶液中含有食盐mg,则该溶液的质量百分比浓度是()A.mM ×100% B.mM−m×100%C.m M+m ×100%D.MM−m×100%2. 电解水时,常在水中加入少量的硫酸以增强水的导电性.若用8%的硫酸溶液200g,通以直流电进行电解水实验,过一段时间后,溶液中硫酸的质量分数为10%,则已电解的水的质量为()A.10gB.20gC.32gD.40g3. 用60%的酒精溶液a和25%的酒精溶液b配制成45%的酒精溶液,所用a、b溶液的质量比为()A.1:2B.4:3C.2:3D.3:14. 现有100克溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数增加一倍,下列操作中正确的是()A.加入食盐10克B.加入水50克C.蒸发掉溶剂的一半D.加入100克溶质质量分数为30%的食盐溶液5. 传统“陈醋”生产过程中有一步称为“冬捞夏晒”.是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质,假设用醋酸的质最分数为5%的半成醋,生产1000g10%的优级醋,过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为()A.500gB.400gC.2000gD.1000g6. 20∘C时,NaCl的溶解度是36g,在20∘C时将20g食盐放入50g水中得到溶液的溶质质量分数是()A.26.5%B.36%C.28.6%D.40%7. 把40g20%的氯化铵溶液与60g30%的氯化铵溶液混合,混合后的溶液中氯化铵的质量分数应()A.大于30%B.小于20%C.等于25%D.在20%∼30%之间8. 向20%的硝酸钾溶液中再加入1.5克硝酸钾和6.0克水,全部溶解后,所得溶液的溶质质量分数为()A.等于20%B.大于20%C.小于20%D.无法判断 9. ag食盐溶液中含有bg水,则该溶液中溶质的质量分数为()A.ab×100% B.aa+b×100%C.ba×100% D.a−ba×100%10. 一定质量的稀硫酸和氢氧化钠溶液恰好完全反应,所得溶液中溶质质量分数为10%,则溶液中钠离子和水分子的个数比为()A.1﹕71B.2﹕71C.1﹕79D.2﹕79二、填空题(本题共计 10 小题,每题 3 分,共计30分,)11. 配制2000g生理盐水(溶质质量分数为0.9%),需要称取NaCl的质量为________,水的质量为________.12. 氯化钠与人类健康以及生产活动密切相关.医疗上的生理盐水是由氯化钠配制而成的.每100g生理盐水中含有________ g氯化钠.13. 某食品加工厂生产酱油中氯化钠的质量分数为17%,该厂日产酱油15t.试计算该厂每月消耗氯化钠的质量是多少?________.14. 含溶质ag溶剂bg的溶液,溶质的质量分数是________.15. 15.4gNaCl完全溶解在如图甲所示的水中,将完全溶解后所得溶液全部倒入原量筒中,液面位置如图乙,则所得NaCl溶液的密度为________,溶质的质量分数为________.16. 1.8L密度为1.50g⋅mL−1,质量分数为60%的硫酸溶液的质量是________g,其中H2SO4________g,含水________g。
专题复习-溶质的质量分数的计算

课题3 溶质的质量分数1、定义:溶液中溶质的质量分数是与之比。
2、公式:溶质的质量分数= = .(1)溶质质量= ×溶质质量分数。
(2)溶液质量= ÷= 质量+ 质量.【思考】1.从100 g 20%的某溶液中取出l0 ml后,剩余溶液中溶质的质量分数是。
2.下列对“10%的食盐溶液"含义的解释中,正确的是()(多项)A.100g水中溶解了10g食盐B.100g食盐溶液中溶解有l0g食盐C.将10g食盐溶解于90g水中得到的溶液D.将食盐与水按l:10的质量比配成溶液3.某果汁饮料中果蔬汁含量≥20%,其含义是什么? .知识点2:有关溶质质量分数的简单计算例1.把10g氯化钠放入40g水中,完全溶解后,溶液中氯化钠的质量分数是多少?例2.在20℃时,将40g氯化钠放入100g水中,结果有4g固体剩余,求溶液中溶质的质量分数。
例3.将40g10%的氯化钠溶液和60g20%的氢氧化钠溶液混合,所得溶液中溶质的质量分数.例4.现有50g质量分数为5%的氯化钠溶液,通过下列方法后,计算改进后溶液中溶质的质量分数。
(1)向原溶液中加入2。
5g氯化钠晶体,固体完全溶解。
解:(2)向原溶液中加入50g水。
解:(3)把溶剂蒸发掉25g,无晶体析出.解:(4)向原溶液中加入50g溶质质量分数为5%的氯化钠溶液。
解:例5。
20℃时,硝酸钾的溶解度是31.6g,则在该温度下硝酸钾饱和溶液中溶质的质量分数为多少?【思考】对于某温度下的饱和溶液,若已知溶解度(S),则溶液中溶质的质量分数为。
【讨论】一定温度时,某物质的溶解度为αg,形成的饱和溶液中溶质的质量分数为b%,则a与b的大小关系为()A。
a大于b B。
a等于b C。
a小于b D。
无法判断在20℃时,食盐的溶解度是36g。
在20℃时,将25g食盐放入50g水中,所得溶液中溶质的质量分数。
知识点1、溶液稀释问题的计算关键:稀释前溶质的质量稀释后溶质的质量。
溶质的质量分数计算(含答案)

溶质的质量分数计算一、单选题(共7道,每道14分)1.向50 g质量分数为5%的硫酸钠溶液中加入5g硫酸钠,完全溶解后,所得溶液中硫酸钠的质量分数为( )A.5%B.10%C.13.6%D.15%答案:C解题思路:溶质的质量分数等于溶质质量与溶液质量之比。
根据题意,所得溶液中的溶质包含原溶液中的溶质和新加入的溶质,溶液质量为原溶液的质量和新加入的溶质。
故选C。
试题难度:三颗星知识点:溶质质量分数的计算2.现有100g 20%的某物质的溶液,要使其溶质的质量分数减小为原来的一半,可采取的方法正确的有( )①再加入10 g溶质②再加入100 g溶剂③再加入100 g该溶液④与200 g 5%的该物质溶液混合A.1个B.2个C.3个D.4个答案:B解题思路:溶质的质量分数等于溶质质量与溶液质量之比。
题中要求溶质的质量分数减小为原来的一半,即变成10%,判断所采取的方法是否能达到目的即可。
①再加入10 g溶质,增加溶质,溶液浓度会变大,不会减小,①不符合题意。
②再加入100 g溶剂,②符合题意。
③再加入100 g该溶液,溶液具有均一性,质量分数相等的溶液混合,所得溶液中溶质的质量分数不会改变,③不符合题意。
④与150 g 5%的该物质溶液混合,④符合题意。
综上所述,②④符合题意,故选B。
试题难度:三颗星知识点:溶质质量分数的计算3.现有氯化钠溶液140 g,当蒸发掉20 g水或向原溶液中加入4 g氯化钠(假设过程中溶质均不析出),可得到质量分数相同的氯化钠溶液,则原溶液中含氯化钠的质量是( )A.24 gB.30 gC.16 gD.20 g答案:D解题思路:溶质的质量分数等于溶质质量与溶液质量之比。
根据题意,蒸发掉20 g水或向原溶液中加入4 g氯化钠,可得到质量分数相同的氯化钠溶液,分别表示出两个过程中的溶质质量分数,建立等式即可。
设原溶液中含氯化钠的质量为x,则,解得x=20g,故选D。
试题难度:三颗星知识点:溶质质量分数的计算4.20℃时,KNO3的溶解度为31.6g,向100 g KNO3饱和溶液中再加5 g KNO3晶体后,在温度不变的条件下,所得溶液中溶质的质量分数为( )A.27.6%B.24.0%C.31.6%D.34.9%答案:B解题思路:饱和溶液中,溶质质量分数(ω)与溶解度(S)的关系为。
溶质质量分数计算(含答案)

溶质质量分数计算一、单选题(共10道,每道10分)1.把15 g固体硝酸钾放入85 g水中,完全溶解后,溶液中硝酸钾的质量分数为( )A.15%B.17.6%C.21.4%D.85%答案:A解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
把15 g固体硝酸钾放入85g水中,完全溶解后,溶质质量为15g,溶剂质量为85g,则溶液质量为15g+85g=100g。
故选A。
试题难度:三颗星知识点:溶质质量分数的计算2.向50 g溶质质量分数为5%的硫酸钠溶液中加入5g硫酸钠,完全溶解后,溶液中硫酸钠的溶质质量分数为( )A.5%B.10%C.13.6%D.15%答案:C解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
50 g溶质质量分数为5%的硫酸钠溶液中,溶质质量为50g×5%=2.5g,溶液质量为50g。
向原溶液中又加入5g硫酸钠,完全溶解后,溶质质量为 2.5g+5g=7.5g,溶液质量为50g+5g=55g。
故选C。
试题难度:三颗星知识点:溶质质量分数的计算3.现有100g20%的某溶液,要使其溶质质量分数增大一倍,可采取的方法是( )A.加入20g溶质B.蒸发掉一半溶剂C.蒸发掉50g水D.加100g50%的该溶液答案:C解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
要使溶质的质量分数增大,方法有加入溶质、蒸发溶剂、加入浓度较大的同种溶液。
使100 g 20%的某溶液溶质质量分数增大一倍,即增大到40%。
100 g 20%的溶液中,溶质质量为100g×20%=20g,溶液质量为100g,溶剂的质量为100g-20g=80g。
①若采用加入溶质的方法,设需要加入溶质的质量为x,则加入溶质后的溶液中溶质的质量为20g+x,溶液的质量为100g+x,溶质的质量分数为40%,,解得x=33.3g,故需要加入溶质的质量为33.3g,A错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶质质量分数计算练习专题一、学习目标知识目标:1.理解溶质质量分数的定义,清楚公式中各个物理量的含义。
2.熟悉溶质质量分数公式,学会溶质质量分数各种类型的计算。
能力目标:培养学生的发散思维,提高分析问题、解决问题的能力情感目标:了解溶液组成的定量表示在工农业生产和生活中的应用,学会利用溶质质量分数解决生产和生活中的实际问题。
重点:溶质质量分数公式的理解与应用。
难点:涉及溶液体积的计算及溶液配置中的误差分析二、溶质质量分数计算的基本类型1.溶质质量分数定义式及变形计算:溶质的质量×100%解析:溶质质量分数=溶液的质量溶质质量=溶液质量×溶质质量分数溶剂质量=溶液质量—溶质质量此类题重点考察考查对溶液质量分数定义的准确理解及根据定义式进行溶液质量、溶质质量、溶剂质量和溶质质量分数的相互换算。
此类题关键是找准溶液、溶质、溶剂的质量。
例1. 对“10%的蔗糖溶液”含义的解释错误的是()A.100g水中溶解了10g蔗糖B.将10g蔗糖溶解于90g水中所得到的溶液C.100g蔗糖溶液中溶解10g蔗糖D.将蔗糖与水按1:10的质量比配成的溶液答案:BC变式训练11.判断题:(请在题后括号里打“√”或“×”)(1)在100 g水里加入20 g氯化钠,溶液中氯化钠的质量分数为20%()(2)10%的食盐溶液”表示100 g水中溶解了10 g食盐()(3)10 g硝酸钾完全溶解于90 kg水中,得到10%的硝酸钾溶液()(4)40 g 20%的NaCl溶液等分成四份,则每一份溶液中氯化钠的质量分数为5%()2.配制400g20%的氢氧化钠溶液,需要氢氧化钠多少克?应加水多少克?3.常温下,向100g10%的NaCl溶液中加入10g蔗糖充分溶解后,求所得溶液中NaCl的质量分数4.80g15%的硝酸钠溶液中,加入20g硝酸钠全部溶解,求此硝酸钠溶液中溶质的质量分数。
5.80g15%的硝酸钠溶液中,加入20g水,求此硝酸钠溶液中溶质的质量分数2.溶液的稀释:解析:溶液稀释的计算要抓住溶液稀释前后溶质的质量不变这一关键。
即浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数加入水的质量=稀溶液的质量—浓溶液的质量例2:把400g质量分数为20%的食盐水稀释成质量分数为10%的溶液,需加水多少克?解:设加水的质量为X400g×20%=(400g+x) ×10%x=400g答:需加水的质量为400g变式训练21. 从100g5%的食盐溶液中,取出20g溶液后,再向原溶液中加入20 g水,则其质量分数变为多少?2.右图为某试剂公司出品的过氧化氢溶液(俗称双氧水)的标签。
小明想配制100g6%的过氧化氢溶液,需用该过氧化氢溶液多少克?加水多少克?解析:等于混合前两溶液中各自所含溶质的质量之和。
溶质1+溶质2+……混合后溶质质量分数==—————————x100%溶液1+溶液2+……例3. 80g10%的食盐溶液与120g20%的食盐溶液相混合,所得溶液中食盐的质量分数为( ) A .30% B .20% C .16% D .15% 解析:本题是两种溶液混合的计算。
应利用混合溶液质量是混合前浓、稀两溶液的质量和,混合溶液中的溶质质量是混合前浓、稀两溶液中溶质质量的总和的原理,进行计算。
即%16%10012080%20120%1080=⨯+⨯+⨯gg g g 答:所得溶液溶质质量分数为20% 变式训练31.向40g5%的NaOH 溶液中,加入60g10%的NaOH 溶液,求混合后的溶液中NaOH 的质量分数。
2.欲用20%和10%的食盐水来配制200g12%的食盐水,则需要10%的食盐水和20%的食盐水各多少克4.溶液的浓缩解析:溶液的浓缩通常是通过减少溶剂或加溶质实现的。
不管加溶质还是减少溶剂,都找出变化后的溶质和溶液的质量代入质量分数的定义式中即可。
例4 某同学欲将200g10%的食盐溶液浓缩成20%,问该同学需要蒸发多少克水或加多少克食盐?解:设需要蒸发水的质量为x ,加食盐的质量为y%20%100200%10200=⨯-⨯xg g 解得 x=100g%20%100200%10200=⨯++⨯yg y g 解得y=25g答:需蒸发100g 水或加食盐25g 。
变式训练41.200g5%的NaCl 溶液,若将其溶质的质量分数增大一倍,可采取的方法有哪些?2. 实验室需要溶质质量分数8%的氢氧化钠溶液,则小强得向200g 5%的氢氧化钠溶液加入多少克氢氧化钠固体可以完成转化?(精确到0.1g )5.涉及溶液体积的计算:解析:溶液、溶剂质量可以加和,但体积不能加和。
所以涉及溶液、溶剂体积的计算,须由密度换算。
质量(m )=体积(V )× 密度() 例5. 实验室有一瓶未开封的浓盐酸,部分标签如右图所示。
(1)这瓶浓盐酸是多少克?2)若用这瓶浓盐酸来配制200g 溶质质量分数为10%的稀盐酸,需量取浓盐酸多少毫升?(3)需加水多少毫升?解:(1)浓盐酸的质量为500ml ×1.18g/ml=590g ;(2)设需浓盐酸的体积为xx ×1.18g/ml ×37%=200g ×10%解得x=45.8ml(3所需水的质量=稀盐酸的质量-浓盐酸的质量即所需水的质量为:200g-45.8ml ×1.18g/ml=146g所需水的体积为ml ml g g 146/1146 答:(略)变式训练51.右图是病人输液时用的一瓶葡萄糖注射液标签,请根据标签给出的数据计算该溶液中含水多少克?溶液的密度约为多少?2.用98%的浓硫酸(密度为1.84g/cm 3)配制成20%的稀硫酸500ml (密度1.14g/cm 3),需浓硫酸和水各多少毫升?三、课堂达标检测1. 现将20g 硝酸钾加入到80g 水中,全部溶解,求所得到的溶液的溶质质量分数?2. 将60g20%的食盐溶液和30g5%的食盐溶液相混合,求所得混合溶液的溶质的质量分数。
3.过氧乙酸是一种常用的消毒剂。
工业品过氧乙酸原液通常是15%过氧乙酸溶液(密度为1.15g.cm -3)(1)某机场要用4500g 溶质质量分数为2%的过氧乙酸溶液消毒,需要15%的过氧乙酸溶液多少克?多少毫升(结果保留一位小数)?(2)现用20ml原液,加水稀释至1000ml(密度约为1g.cm-3),用于空气喷雾消毒,所得过氧乙酸溶液的质量分数为多少?4. 20℃时,对100g5%的食盐溶液做如下处理,求所得溶液溶质的质量分数(假设每次增加的溶质都完全溶解):(1)蒸发10g水后,溶质的质量分数为_______。
(2)增加10gNaCl后,溶质的质量分数为________。
(3)增加10gNaCl和10g水,则溶质的质量分数为________。
(4)加入100g15%的NaCl溶液后,溶质的质量分数为_______。
四、课后巩固提高一、选择题1.对“20%的食盐溶液”的含义的解释错误的是()A.100g食盐溶液中溶解了20g食盐B.将食盐与水按20:80的质量比配成的溶液C.将40g食盐溶解于160g水中所得到的溶液D.100g水中溶解了20g食盐2.用氯化钠配制lOOg溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。
正确的操作顺序是(A)①②③④ (B)⑤②④①(C)①③⑤②④① (D)①③⑥⑤②④①3.欲配制100kg溶质质量分数为7.1%的KNO3溶液作无土栽培的营养液,需KNO3的质量为()A.7.1kgB.14.2kgC.71kgD.92.9kg 4.溶液在稀释过程中不变的是()A.溶液的质量 B.溶剂的质量 C.溶质的质量 D.溶质的质量分数5 .分析表中的数据,以下看法不可取的是()A. 生理盐水是依据人体血液的特点配制的B. 表中三种溶液的含盐质量分数均为0.9%纯属巧合C. 人类祖先可能是从原始海洋逐渐进化到陆地上的D. 人体血液与原始海水之间可能有某些尚未认识的关系6. 在10%氢氧化钠溶液中,溶质、溶剂、溶液之间的质量关系正确的是()A.溶质:溶剂=1:10B.溶剂:溶液=9:11C.溶质:溶液=1:10D.溶质:溶液=1:117.如要100g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为()A.50g B.90g C.100g D.200g8.使100g10%的NaCl溶液变为12.5%,需蒸发水( )gA. 2.5B. 5C. 20D. 12.59.常温下,向100g10%的NaCl溶液中加入1g蔗糖充分溶解后,所得溶液中NaCl的质量分数为()A.等于10% B.小于10% C.大于10% D.无法确定10.向40g5%的NaOH溶液中,加入60g10%的NaOH溶液,混合后的溶液中NaOH的质量分数为()A.8%B.10%C.16%D.4%11. 从100g5%的食盐溶液中,取出20g溶液后,再向原溶液中加入20 g水,则其质量分数变为()A.5%B.4%C.3%D.2%12.常温下,欲把100g溶质质量分数为10%的NaCl溶液的质量分数变成20%,可采取的措施是()A.蒸发掉一半溶剂 B.加入10gNaClC.蒸发掉50g水 D.加入12.5gNaCl13.要配制100g 溶质质量分数为10%的氯化钠溶液,下列操作中正确是 ( )A.将10g氯化钠固体直接放在天平的托盘上称量B.量取90ml水时,俯视读数C.为加快固体溶解,用温度计搅拌溶液D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签14.在100g20%的硝酸钾溶液中加入100g水后,溶液中()A.溶质质量增加了一倍 B.溶质质量分数减小了一半C.溶剂质量增加了一倍 D.溶质质量分数增大了一倍15.海水淡化可采用膜分离技术,如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进人左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是()A.溶质质量增加 B.溶液质量不变C.溶剂质量减少 D.溶质质量分数不变16. 在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是:①用量筒量取水时俯视读数②配制溶液的烧杯用少量蒸馏水润洗③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数④盛装溶液的试剂瓶用蒸馏水润洗⑤氯化钠晶体不纯()A.①②③④⑤ B.只有①②④⑤C.只有①②③ D.只有②③④⑤二、填空题17.溶液在生产和科研中具有广泛的用途。
