His蛋白纯化原理方法和问题分析
His标签蛋白纯化全攻略

His标签蛋白纯化全攻略作为重组蛋白构建过程中最常用的标签,相信奋战在实验室中的小伙伴对His标签并不陌生。
His标签可通过Ni2+柱进行简单有效的纯化,不过纯化容易想要纯化好却并不那么容易。
爱纯派助力His标签纯化,马上为大家送上His标签纯化全攻略。
His标签蛋白的纯化原理组氨酸(His)的残基上带有1个咪唑基团,可以和Ni2+、Co2+等过渡金属离子形成配位键而选择性的结合在金属离子上,这些金属离子能够用鳌合配体固定在层析介质上,因此带有组氨酸标签的蛋白在经过装配了金属离子的层析介质时可以选择性的结合在介质上,而其他的杂质蛋白则不能结合或仅能微弱结合。
结合在介质上的His标签蛋白可以通过提高缓冲液中的咪唑浓度进行竞争性洗脱,从而得到较高纯度的His标签蛋白。
His标签蛋白纯化说起来简单做起来难。
小编也常常收到小伙伴们类似于“His标签重组蛋白Ni2+柱纯化后纯度不够”、“His标签蛋白挂不到Ni2+柱上”等等之类的抱怨。
其实呢,不怕做不到,就怕没想到。
His标签蛋白纯化是有很大的优化空间哦~His标签纯化优化策略His标签蛋白纯化的所有优化策略都是基于改变标签蛋白和金属离子之间配位结合作用力的强弱,而这种作用力主要和一下因素相关:1)标签长度及暴露程度:最常用的His标签时6个重复的组氨酸,但在实际操作过程中,根据实际情况可控制组氨酸的数目从四到十个不等。
较短的标签与金属离子的结合更弱,较长的标签与金属离子的结合更强;而标签的暴露程度也很容易理解,金属离子只能和蛋白表面的His结合,所以His标签暴露程度越高,结合能力越强。
2)金属离子半径:除最常用的Ni2+以外,但Cu2+、Zn2+、Co2+等金属离子都可用于His标签蛋白的纯化,不同金属离子区别在于离子半径不同,离子半径越小,与His的结合能力也就越强。
几种常用金属离子和His的结合能力为:Cu2+〉Zn2+〉Ni2+〉Co2+。
3)缓冲液条件:His标签蛋白在中性或弱碱性pH值(pH 7到8)环境下显现出比在酸性条件下与金属离子更强的结合能力。
His-Tag 表达蛋白纯化原理

His-Tag 表达蛋白纯化原理组氨酸标签蛋白的纯化His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱去(IMAC)纯化。
2.1 IMAC(Immobilized Metal-ion affinity chromatography)是Porath etal.1975年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smith et al. 发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadexG-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadexG-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。
同年1987年Hochuli etal.发现带有相连组氨酸的多肽和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC纯化变成最常用而且最有效的研究蛋白结构和功能的有力手段。
1986年Porath etal.还发现Fe3+-IDA-sephadexG-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。
市面常见的商品化IMAC用于带六个组氨酸标签蛋白的配基有以下几种:2.2影响IMAC纯化结果的因素:2.2.1填料的种类:不同填料厂家的填料有差别,所以使用过程最好能得到厂家的技术支持,因为不同的厂家填料不同,此外蛋白纯化个性很强,没有哪一个填料是能适合所有带六个组氨酸标签蛋白的纯化,载量高和特异性好本身就是矛盾。
His-GFP蛋白的纯化步骤

以His-GFP为例简述His-tag蛋白的纯化His-tag是重组蛋白中最常用的融合标签之一。
使用镍柱纯化His-tag融合蛋白的原理为:组氨酸的咪唑侧链可亲和结合镍、锌和钴等金属离子,在中性和弱碱性条件下带组氨酸标签的目的蛋白与镍柱结合,在低pH下用咪唑竞争洗脱。
实验中一般选用6个组氨酸(His6-tag)的标签。
His6标签有许多优点:(1)由于只有6个氨基酸,分子量很小,对蛋白结构和活性的影响较小,一般不需要酶切去除;(2)可以在变性条件下纯化蛋白,在高浓度的尿素和胍中仍能保持结合力;(3)His6标签无免疫原性,重组蛋白可直接用来注射动物,也不影响免疫学分析。
His6标签也有一些不足,如目的蛋白易形成包涵体、难以溶解、稳定性差及错误折叠等。
镍柱纯化时金属镍离子容易脱落,混入蛋白溶液,不但会通过氧化破坏目的蛋白的氨基酸侧链,而且柱子也会非特异吸附蛋白质,影响纯化效果。
本实验将以His-GFP(绿色荧光蛋白)为例,阐述His-tag蛋白的纯化过程。
1. E. coli重组菌体破碎表达完成的E. coli重组菌体,经超声或细胞破碎仪进行破碎。
当需要破碎的细胞沉淀较少(<1 g)时,通常在Eppendorf管中,用超声法完成细胞裂解。
而当细胞沉淀较多时,可选用细胞破碎仪进行破碎。
本实验采用细胞破碎仪法。
细胞破碎仪法:称量细胞沉淀的湿重,加入细胞湿重10倍体积的裂解缓冲液。
如,1 g细胞沉淀加入约10 ml的裂解缓冲液,使得细胞在溶液中的终浓度为10-15%,在此范围内细胞破碎的效果较好。
过浓或过稀的细胞浓度均不利于破碎效率。
裂解缓冲液的组成如下:Lysis buffer:20 mM Tris-HCl, pH 7.4100 mM NaCl10 mM imidazole0.1% Triton X-1001 × protease inhibitor将细胞沉淀在裂解buffer中充分搅拌至没有结块后,进行高压破碎。
His蛋白纯化原理、方法和问题分析

组氨酸(His)标签蛋白的纯化His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱(IMAC)纯化。
IMAC(Immobilized Metal-ion affinity chromatography)是Porath et al.1975年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smith et al. 发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadex G-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadex G-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。
同年1987年Hochuli et al.发现带有相连组氨酸的多肽和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC纯化变成最常用而且最有效的研究蛋白结构和功能的有力手段。
1986年Porath et al.还发现Fe3+-IDA-sephadex G-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。
Ni柱中的氯化镍可以与有HIs(组蛋白)标签的蛋白结合,也可以与咪唑结合。
步骤是:过柱子前可以选择Ni柱重生,也就是往柱子里倒氯化镍,一个柱长体积就行了,然后平衡柱子,拿你自己的buffer,给蛋白提供最适的环境,我一般平衡4个柱长,然后蛋白上样,你可以让他自己挂,这样挂柱子的效果好一些,如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差,当然你也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。
His融合蛋白纯化中常见问题解答集锦
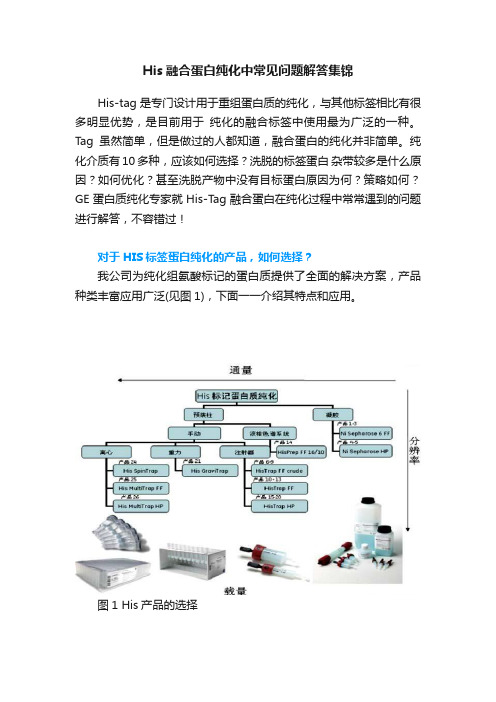
His融合蛋白纯化中常见问题解答集锦His-tag是专门设计用于重组蛋白质的纯化,与其他标签相比有很多明显优势,是目前用于纯化的融合标签中使用最为广泛的一种。
Tag虽然简单,但是做过的人都知道,融合蛋白的纯化并非简单。
纯化介质有10多种,应该如何选择?洗脱的标签蛋白杂带较多是什么原因?如何优化?甚至洗脱产物中没有目标蛋白原因为何?策略如何?GE蛋白质纯化专家就His-Tag融合蛋白在纯化过程中常常遇到的问题进行解答,不容错过!对于HIS标签蛋白纯化的产品,如何选择?我公司为纯化组氨酸标记的蛋白质提供了全面的解决方案,产品种类丰富应用广泛(见图1),下面一一介绍其特点和应用。
图1 His产品的选择Ni Sepharose High Performance用于高分辨率纯化的预带电荷的介质Ni Sepharose High Performance,通过耦联Ni使介质预带电荷,使用非常方便。
和其它厂家的同类产品比较,它具有高载量和低的Ni脱落的特点,低的镍脱落保证的HIS-标记的蛋白质在多次重复的纯化中保持可靠的载量。
同时Ni Sepharose High Performance填料的颗粒大小只有34um,具备最高的分辨率和最低的样品稀释。
Ni Sepharose High Performance除了有散装填料形式,也具有HISTrap1Ml和5Ml的实验室预装柱,可以连接AKTA仪器,蠕动本以及手动注射器操作,使用非常方便。
His MultiTrap HP 96孔过滤板用于高通量筛选和多样品的平行纯化,预装了Ni Sepharose High Performance的填料,未澄清的细胞裂解液可以直接上样,具有高重复性,操作简单方便快捷的特点。
His SpinTrap柱用于少量的蛋白质制备,预装了100ul的HP填料,可以直接上澄清和未澄清的样品,可用于细菌细胞裂解液的筛选和优化纯化条件,与标准离心机使用,一次纯化仅需10分钟。
蛋白纯化常见问题:His标签

蛋白纯化常见问题:His标签1、常用的His标签蛋白纯化填料,Ni Sepharose 6FF和Ni Sepharose HP有什么区别,应该如何选?答:HP:High Performance,高性能,填料平均颗粒大小约34 μm,颗粒细能带来高分辨率的分离纯化。
HP 纯化后峰更窄,样品浓度高,节省了浓缩步骤的时间,但会带来更高的反压,因此流速更慢。
FF:Fast Flow,快流速,填料平均颗粒大小约90 μm,较 HP 颗粒粗,流速快,具有良好的分辨率及轻松实现规模扩大的分离纯化,同样适用于重力流下的蛋白纯化和多孔板筛选。
2、HisTrap FF Crude 和 HisTrap excel 的特点是什么?应该如何选择?答:HisTrap FF Crude 的滤膜孔径更大,裂解液无需离心过滤处理,可以直接上样,适合样品不稳定或者比较粘稠容易造成柱子堵塞的料液。
例如如果纯化包涵体蛋白较多时,可以优先考虑FF Crude (预装柱)或 FF。
HisTrap excel 最大的特点是镍脱落极低,且能耐受100 mM EDTA,特别适合真核外泌蛋白(如培养基中含有螯合剂)。
无需脱镍,即可直接使用 NaOH 清洗,防止交叉污染且有更长的使用寿命。
3、 His 标签蛋白纯化实验中,常用的缓冲液成分是什么?答:建议缓冲溶液成分如下· 结合缓冲溶液:FF、 HP系列: 20mM磷酸钠缓冲溶液, 500mM NaCl(避免非特异电荷吸附),20-50mM 咪唑(提高浓度,可以增加纯度但会降低收率), pH7.4 (可以根据实际情况调节pH)。
Talon 系列:20mM 磷酸钠缓冲溶液,500mM NaCl,10-20mM咪唑, pH7.4。
Excel 系列: 20mM 磷酸钠缓冲溶液, 500mM NaCl, pH7.4 (结合缓冲液中一般不添加咪唑,在wash缓冲液中可根据样品性质加入 0-30 mM 咪唑)· 洗脱缓冲溶液:20mM 磷酸钠缓冲溶液,500mM NaCl,500mM 咪唑,pH 7.44、纯化得到的组分中没有或很少目的 His 标签蛋白,怎么回事?答:若目的His 标签蛋白正常表达(使用抗His 标签的抗体进行WB 检测)且充分释放至上清中,确认蛋白是流穿还是未被洗脱:若 His 标签蛋白流穿:· 样品或结合缓冲液的条件不合适,注意螯合剂或强还原剂以及咪唑的浓度。
His标签融合蛋白纯化常见问题解析

His标签融合蛋白纯化常见问题解析(博进生物)1. 纯化原理His标签融合蛋白的纯化是借助于层析介质上的过渡金属离子(如Cu2+、Zn2+、Ni2+、Co2+等)与His融合蛋白上的His标签的配位作用实现目标蛋白的分离。
组氨酸(His)的残基上带有1个咪唑基团,可以和Ni2+等过渡金属离子形成配位键而选择性的结合在金属离子上,这些金属离子通过螯合配体固定在层析介质上,因此带有His标签的蛋白可以特异性的吸附在螯合了Ni2+等过渡金属离子的层析介质上,而其他不含His标签的杂质蛋白则不能吸附或仅微弱吸附在介质上。
通过提高缓冲液中的咪唑浓度进行竞争性洗脱,可以将His标签融合蛋白从层析介质上解吸附下来,从而得到较高纯度的目标蛋白。
2. His标签蛋白纯化策略His标签蛋白纯化的所有优化策略都是基于改变标签蛋白和过渡金属离子之间配位作用力的强弱,而影响配位作用力强弱的因素如下:2.1 标签长度及暴露程度最常用的His标签是6个重复的组氨酸,但在实际操作过程中,可控制在4-10个组氨酸的标签长度。
标签越长,蛋白与过渡金属离子的结合力越强。
过渡金属离子只能与蛋白表面的组氨酸集合,所以His标签暴露的程度越高,结合能力越强。
2.2 过渡金属离子半径常用于螯合His标签蛋白的过渡金属离子有Cu2+、Zn2+、Ni2+、Co2+等,金属离子的半径越小,与His标签蛋白的结合能力就越强。
上述金属离子与His标签蛋白结合能力的强弱顺序为Cu2+ >Zn2+ >Ni2+ >Co2+2.3 缓冲液条件His标签融合蛋白与过渡金属离子的螯合作用受缓冲液的pH值影响。
在中性或弱碱性(pH 7-8)环境下的螯合作用力要强于酸性环境下的作用力。
His标签融合蛋白与过渡金属离子的螯合作用还受缓冲液种类的影响。
通常磷酸盐缓冲液中的螯合作用力强于Tris-HCl缓冲液中的作用力。
由于咪唑可以和His标签蛋白竞争过渡金属离子,所以缓冲液中咪唑浓度的升高可减弱上述螯合作用力。
his标签蛋白纯化思路总结
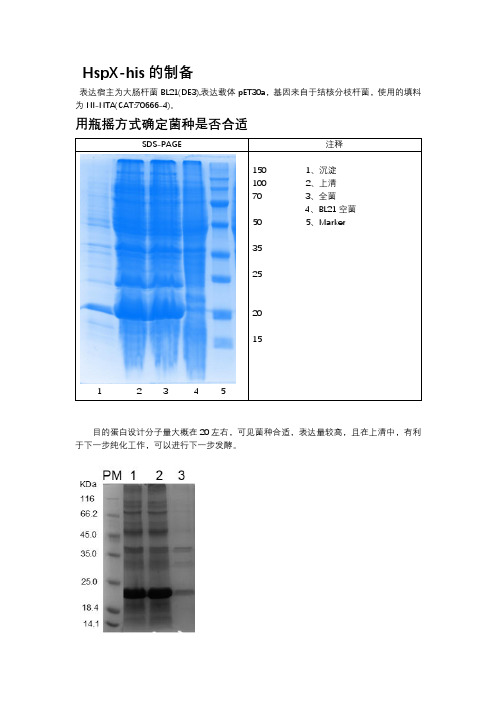
HspX-his的制备表达宿主为大肠杆菌BL21(DE3),表达载体pET30a,基因来自于结核分枝杆菌,使用的填料为NI-NTA(CAT:70666-4)。
用瓶摇方式确定菌种是否合适SDS-PAGE1 2 3 4 5目的蛋白设计分子量大概在20左右,可见菌种合适,表达量较高,且在上清中,有利于下一步纯化工作,可以进行下一步发酵。
进行发酵,发酵流程可参考前文的发酵流程,基础,补料培养基,及补料策略均不变,诱导IPTG:0.5mM。
SDS-PAGE1 2 3 4 5发酵表达和瓶摇表达类似,表达量高,且在上清中。
可以进行下一步纯化工作。
尝试纯化配置缓冲液:A液(结合缓冲液):0.5M NaCl+20mM PB缓冲液(pH8.0)B液(洗脱缓冲液):含20、50、100、150、250、500mM咪唑的结合缓冲液(pH7.0)初步尝试,取介质3ml,上样1g湿菌(10ml样品)1、用30ml ddH2O洗涤介质2、用10ml 500mM洗脱缓冲液洗涤介质3、用30ml 结合缓冲液平衡介质4、加入细菌裂解液10ml(一次上样)5、用30ml 结合缓冲液洗去杂蛋白6、分别用10ml含20、50、100、150mM咪唑的结合缓冲液洗脱蛋白。
7、用30ml ddH2O洗涤介质8、加入10ml 20%乙醇保存介质SDS-PAGE1 2 3 4 5 6 7结果分析:1、蛋白挂柱少,可能需要重复上样,以及上样的pH值需要调整。
2、可见第七号泳道能洗脱下目的蛋白,可能需要使用250及500mM咪唑。
Day4:尝试纯化配置缓冲液:A液(结合缓冲液):0.5M NaCl+20mM PB缓冲液(pH8.0)B液(洗脱缓冲液):含20、50、100、150、250、500mM咪唑的结合缓冲液(pH7.0)初步尝试,取介质5ml,上样5g湿菌(25ml样品)1、用50ml ddH2O洗涤介质2、用10ml 500mM洗脱缓冲液洗涤介质3、用50ml 结合缓冲液平衡介质4、加入细菌裂解液10ml(三次上样)5、用30ml 结合缓冲液洗去杂蛋白6、分别用10ml含20、50、100、150mM咪唑的结合缓冲液洗脱蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
组氨酸(His)标签蛋白的纯化
His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱(IMAC)纯化。
IMAC(Immobilized Metal-ion affinity chromatography)是Porath et 年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smith et al. 发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadex G-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadex G-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。
同年1987年Hochuli et al.发现带有相连组氨酸的多肽和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC 纯化变成最常用而且最有效的研究蛋白结构和功能的有力手段。
1986年Porath et al.还发现Fe3+-IDA-sephadex G-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。
Ni柱中的氯化镍可以与有HIs(组蛋白)标签的蛋白结合,也可以与咪唑结合。
步骤是:过柱子前可以选择Ni柱重生,也就是往柱子里倒氯化镍,一个柱长体积就行了,然后平衡柱子,拿你自己的buffer,给蛋白提供最适的环境,我一般平衡4个柱长,然后蛋白上样,你可以让他自己挂,这样挂柱子的效果好一些,如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差,当然你也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。
挂完之后,按理想来讲,你的蛋白在Ni柱中与Ni就结合了,杂蛋白多数在烧杯里,留下来了,当然肯定有少量杂蛋白也挂上了,这时候你要,拿咪唑和你的buffer配,一般从0 20mM 40mM。
100mM 这样洗脱(当你不知道你的蛋白大概在什么时候出来的时候)我指的是咪唑的终浓度。
咪唑加入之后,会和蛋白争夺与Ni的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来,洗完之后,你可以用400mM咪唑洗柱子,清理一切蛋白,然后平衡几次,是否选择重生你自己定咯~然后放上20%乙醇保存柱子就可以咯~过的蛋白用不同的管子收下,然后SDS-page检测在哪个管子里。
市面常见的商品化IMAC用于带六个组氨酸标签蛋白的配基有以下几种:
一、组氨酸(His)标签蛋白的纯化步骤:
大肠杆菌的破碎方法:
1)收集培养发酵液,4度7000-8000g离心10分钟,收集沉淀的菌体(如果不是马上破碎可以放-70度冷冻,但是最好能保存成小块或者薄片,这样好用。
)
2)取1-2克菌体加10ml破碎缓冲液(的50mM磷酸缓冲液含NaCl,ml溶菌酶,1mM PMSF,1mM MgCl2,ml Benzonase,其中的菌酶,1mM PMSF,ml Benzonase现加)在冰上混合45分钟,如果pH不在7-8,需要用NaOH一边搅拌一边滴加.如果溶菌酶10mg/ml混合时间可以缩短到10分钟.
3)把混合菌体在冰水中用超声探头破碎20秒种,总共四次,中间间隔要保持2分钟冷却破碎液,检测pH,如果不在7-8,还是用NaOH一边搅拌一边滴加去调.如果菌体的为50-500克,可以高压破碎的方法,缓冲液同上,体积为1升,破碎三次,压力为800 bar.
4)破碎的液4度12000g离心10分钟,如果要让溶液更澄清,可以4度50000g 离心30分钟,这时候可以把上清和沉淀分别留样,跑电泳,如果只沉淀中有目标蛋白,那就用变性条件下去提取。
1.大肠杆菌的破碎离心的上清加2M咪唑溶液使终浓度为20mM,样品的总体积为10ml。
2.过柱子的样品最好过μm的滤膜,避免堵柱。
3.可溶性蛋白的纯化:
1)平衡缓冲液:的50mM磷酸缓冲液含NaCl,含20mM咪唑。
2)洗脱缓冲液:的50mM磷酸缓冲液含NaCl,含500mM咪唑。
3)取1ml镍琼脂糖凝胶FF或镍NTA琼脂糖凝胶FF预装柱,用10ml平衡缓冲液平衡,然后取破碎上清10ml样品以min上样,然后2ml/管分管收集。
4)用15ml平衡缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集。
5)用5 ml洗脱缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集。
6)再用5ml平衡缓冲液平衡柱子,灌满20%乙醇,封闭,以备下次使用。
7)此方法是通用的方法,但是未必能得到适合自己蛋白的满意效果,所以优化的办法是洗脱可以用50mM,100mM,300mM,500mM分阶段洗脱,各洗脱5个柱体积,这样配合电泳检测,得到适合自己的蛋白的条件。
8)收集的部分可以用紫外分光光度法、BCA法或用考玛斯亮蓝法测定蛋白的浓度,再取有蛋白的部分电泳检测纯度。
二、常见问题及解决方法
1.不溶解或沉淀在柱子上:要留意缓冲液体的pH,此外在样品中添加一些表面活性剂甚至乙醇等有机溶剂可以增加疏水性蛋白的溶解度,对于带半胱氨酸多的蛋白很容易氧化聚集沉淀,所以需要加2-5mM巯基乙醇避免沉淀。
2.白不吸附:这是最常见的,通常的原因有:1是标签不暴露,被折叠在蛋白的结构内,可以在变性的条件下去纯化,如果用脲变性吸附不好,可以改用盐酸胍,个人经验是这样通常可以使吸附不上的蛋白得到改善,顺利纯化。
2可以选择作用力更强,配基密度更高的填料,通常镍琼脂糖凝胶作用力最强,如果蛋白分子量大可以选择手臂长的填料,如镍NTA琼脂糖凝胶,填料的好坏可以看填料的颜色,颜色越深那配基密度越高,作用力也相应要强。
3样品的pH过低或者沉淀导致不能吸附,所以样品和缓冲液的pH要尽量一致,避免沉淀,通常再偏碱性条件下吸附更好。
3.难洗脱:如果穿透中目标蛋白明显减少,而洗脱又没有,取点填料加电泳缓冲液煮后离心跑电泳还是有目标蛋白,可以用更强的洗脱条件如500mM咪唑,如果还不能洗脱,可以直接用500mM咪唑加到6M盐酸胍去洗脱。
4. 电泳杂带多:因为这种亲和毕竟特异性要差点,原因在蛋白中带组氨酸,色氨酸,半胱氨酸等很常见,特别是蛋白折叠会导致几个这样的氨基酸残基临近,这样也会使它们和镍柱的作用力增加,因此可以用不同浓度的咪唑阶段洗脱,此
外在咪唑洗脱前增加一步pH5的醋酸缓冲液洗脱,在平衡缓冲液中添加%吐温或Triton可以避免因为疏水相互作用导致非特异吸附,这样可以电泳的杂带明显减少,但是如果用这样的方法还是杂带多,那就地回头去看看破碎的条件是不是太剧烈或者温度控制不好导致蛋白短裂或者分解导致一些蛋白片段带标签,或者因为样品长时间保存导致水解等,总之纯化的好坏决定于每一个步骤,不仅仅是纯化的问题。
还有一个不容忽略的问题是有时候因为蛋白相互作用或者因为形成聚合体导致杂带增加,而由于疏水相互作用或者因为离子作用可以通过添加表面活性剂或者增加离子强度得到改善,对于因为形成聚合体的可以在缓冲液和样品中加1-2mM巯基乙醇避免,如果这样的情况下最好是选择镍NTA琼脂糖凝胶,因为它在还原剂下更稳定。
三、影响IMAC纯化结果的因素
1.填料的种类:
不同填料厂家的填料有差别,所以使用过程最好能得到厂家的技术支持,因为不同的厂家填料不同,此外蛋白纯化个性很强,没有哪一个填料是能适合所有带六个组氨酸标签蛋白的纯化,载量高和特异性好本身就是矛盾。
2.填料的配基种类、密度、金属离子种类
填料最简单的判断是螯合好同样的金属离子,哪家产品的颜色越深就意味着和蛋白的作用力越强,适用范围越广,载量也越高,纯化的好坏关键看纯化的条件,仅有填料的特异性是不够的,同样配基密度下IDA填料的亲和力要比NTA的强,所以NTA上不能吸附的样品可以选择IDA为配基的填料。
3.螯合金属离子和蛋白作用强弱为铜和镍离子的强,而锌和钴离子的弱。
因此如果一个蛋白作用力强,想得到好的特异性可以选择螯合钴离子,它还有一个优点是不怕还原剂,特别时候有高浓度的还原剂。
相同金属离子,IDA的强于NTA。
螯合金属离子的价位越低和蛋白的作用力越强。
同时镍离子是最常用的,如果有条件可以换不同金属离子以得到更好的效果,因为不同的金属离子有不同的选择性。
因此要希望填料应用范围广就选择镍琼脂糖凝胶,如果是希望特异性好而且稳定就选择镍NTA琼脂糖凝胶.。
