常见溶剂的凝固点和凝固点降低常数
常用溶剂的性质

常用溶剂的性质常用溶剂的性质常用溶剂的极性顺序:水(最大) >甲酰胺>乙腈>甲醇>乙醇>丙醇>丙酮>二氧六环>四氢呋喃>甲乙酮>正丁醇>乙酸乙酯>乙醚>异丙醚>二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)。
甲酰胺分子式HCONH2,透明油状液体,略有氨臭,具有吸湿性,可燃。
能与水和乙醇混溶,微溶于苯、三氯甲烷和乙醚。
相对密度1.133(20/4℃)。
沸点210℃。
熔点2.55℃。
闪点175℃。
折射率nD(25℃)1.4468。
燃点>500℃。
粘度(20℃)2.926mPa•s。
毒性本品低毒。
对皮肤和粘膜有暂时刺激性。
小鼠经口LD50大于1000mg/kg。
乙腈;甲基氰结构式CH3CN。
分子量41.05。
无色透明液体,有醚的气味。
相对密度(20℃/4℃)1. 7822,凝固点-43.8℃,沸点81.6℃、闪点5.6℃。
折射率1.3441.粘度(20℃)0.35mPa•s,表面张力(20℃)19.10×10-3N/m,临界温度274.7℃,临界压力4.83MPa。
能与水、甲醇、醋酸甲酯、醋酸乙酯、丙酮、乙醚、氯仿、四氯化碳、氯乙烯以及各种不饱和烃相混溶。
与水形成共沸混合物。
易燃,爆炸极限3.0%-16%(vol)。
有毒人LD503800mg/kg。
空气中最高容许浓度3mg/m3。
贮存阴凉、通风、干燥的库房内,远离火种、热源,防止日光直射。
甲醇结构式为CH3OH,分子量32.04。
无色澄清易挥发液体,相对密度(20℃/4℃)0.7914,凝固点-97.49℃,沸点64.5℃.闪点(开口)16℃,燃点470℃,折射率1.3285,表面张力22.55×10-3N/m,蒸气压(20 ℃)12.265kPa,蒸气相对密度1.11,粘度(20℃)0.5945mP a•s,溶解度参数δ=14.8,能与水、乙醇、乙醚、丙酮、苯、氯仿等有机溶剂混溶,甲醇对金属特别是黄铜有轻微的腐蚀性。
常用溶剂物理常数表
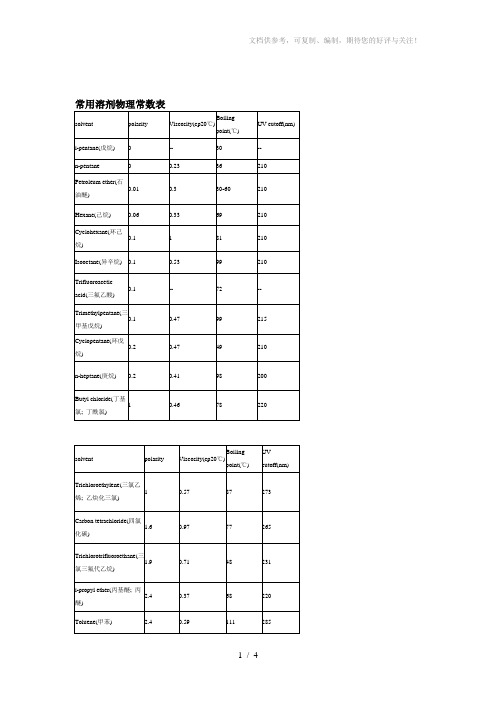
0.33
69
210
Cyclohexane(环己烷)
0.1
1
81
210
Isooctane(异辛烷)
0.1
0.53
99
210
Trifluoroacetic acid(三氟乙酸)
0.1
--
72
--
Trimethylpentane(三甲基戊烷)
0.1
0.47
99
215
Cyclopentane(环戊烷)
常用溶剂物理常数表
solvent
polarity
Viscosity(cp20℃)
Boiling point(℃)
UV cutoff(nm)
i-pentane(戊烷)
0
--
30
--
n-pentane
0
0.23
36
210
Petroleum ether(石油醚)
0.01
0.3
30-60
210
Hexane(己烷)
4.4
0.57
61
245
Methyl ethyl ketone(甲基乙基酮)
4.5
0.43
80
330
Dioxane(二恶烷;二氧六环;二氧杂环己烷)
4.8
1.54
102
220
Pyridine(吡啶)
5.3
0.97
115
305
Acetone(丙酮)
5.4
0.32
57
330
Nitromethane(硝基甲烷)
1
0.57
87
273
Carbon tetrachloride(四氯化碳)
常用溶剂的性质

常用溶剂的性质常用溶剂的性质常用溶剂的极性顺序:水(最大) >甲酰胺〉乙腈〉甲醇〉乙醇〉丙醇〉丙酮〉二氧六环〉四氢呋喃〉甲乙酮>正丁醇〉乙酸乙酯〉乙醚〉异丙醚〉二氯甲烷〉氯仿〉溴乙烷>苯〉四氯化碳〉二硫化碳〉环己烷〉己烷〉煤油(最小)。
甲酰胺分子式HCONH透明油状液体,略有氨臭,具有吸湿性,可燃。
能与水和乙醇混溶,微溶于苯、三氯甲烷和乙醚。
相对密度 1.133(20/4 C)。
沸点210C。
熔点2.55 °C。
闪点175C。
折射率n D(25°C)1.4468。
燃点〉500 E。
粘度(20C) 2.92 6mPa?s 莓性本品低毒。
对皮肤和粘膜有暂时刺激性。
小鼠经口LD50大于1000mg/kg。
乙腈;甲基氰结构式CHCN分子量41.05。
无色透明液体,有醚的气味。
相对密度(20 C/4 C )1. 7822,凝固点-43.8 C,沸点81.6 C、闪点5.6 C。
折射率1.3441 •粘度(20 C)0.35mPa?s,表面张力(20 C )19.10 X 10-3N/m,临界温度274. 7C,临界压力4.83MPa能与水、甲醇、醋酸甲酯、醋酸乙酯、丙酮、乙醚、氯仿、四氯化碳、氯乙烯以及各种不饱和烃相混溶。
与水形成共沸混合物。
易燃,爆炸极限3.0%-16%(vol)。
有毒人LD503800mg/kg空气中最高容许浓度3mg/nl贮存阴凉、通风、干燥的库房内,远离火种、热源,防止日光直射。
甲醇结构式为CHOH分子量32.04。
无色澄清易挥发液体,相对密度(20 C/4 C)0.7914,凝固点-97.49 C,沸点64.5 C.闪点(开口)16 C,燃点470C, 折射率1.3285 ,表面张力22.55 X 10 N/m,蒸气压(20 C )12.265kPa ,蒸气相对密度1.11,粘度(20C )0.5945mPa?s,溶解度参数3= 14.8,能与水、乙醇、乙醚、丙酮、苯、氯仿等有机溶剂混溶,甲醇对金属特别是黄铜有轻微的腐蚀性。
凝固点降低实验报告

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B =×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3) 若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
凝固点降低实验报告

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B =×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3) 若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
乙二醇的水溶液的凝固点

乙二醇的水溶液的凝固点乙二醇的水溶液是一种常见的溶液,它在工业和实验室中被广泛使用。
乙二醇是一种无色无味的液体,具有很强的溶解性,可以与许多物质相溶。
它的水溶液在一定条件下会发生凝固,这是因为乙二醇的水溶液在低温下会形成结晶。
乙二醇的水溶液的凝固点是指在一定的浓度下,溶液开始从液态转变为固态的温度。
乙二醇的水溶液的凝固点与溶液中乙二醇的浓度有关。
一般来说,乙二醇的浓度越高,凝固点就会越低。
这是因为乙二醇分子在溶液中的存在会干扰水分子的结构,降低水的冰点,从而使得溶液的凝固点降低。
乙二醇的水溶液的凝固点与溶液中溶质的浓度之间存在着一定的关系。
这个关系可以用冰点降低计算公式来描述。
冰点降低计算公式是根据溶液中溶质和溶剂的摩尔浓度来计算溶液的凝固点降低。
公式如下:△T=Kf×m其中,△T表示溶液的凝固点降低,Kf表示冰点降低常数,m表示溶质的摩尔浓度。
根据这个公式,可以计算出不同浓度的乙二醇水溶液的凝固点。
乙二醇的水溶液的凝固点降低是一种非常实用的现象。
在冬季,一些地区的气温会非常低,水的冰点会很低,如果直接使用纯水作为冷却剂,会造成冷却系统的冻结和损坏。
而添加适量的乙二醇水溶液,可以降低冷却液的凝固点,提高冷却系统的抗冻性能,从而保护冷却系统的正常工作。
此外,乙二醇的水溶液的凝固点降低还可以应用于其他领域。
比如在制冷技术中,乙二醇水溶液可以作为制冷剂使用,通过调节乙二醇的浓度,可以控制制冷剂的凝固点和蒸发点,从而实现对制冷系统的温度控制。
乙二醇的水溶液的凝固点还与环境温度和压力有关。
在高温高压条件下,乙二醇的水溶液的凝固点会有所升高。
这是因为高温和高压会增加溶质和溶剂之间的相互作用力,使得溶液的凝固点升高。
乙二醇的水溶液的凝固点是一个重要的性质,它不仅影响着乙二醇溶液的应用范围,还与乙二醇的浓度、温度、压力等因素密切相关。
通过研究乙二醇的水溶液的凝固点,可以更好地理解和掌握乙二醇溶液的性质和特点,为相关领域的应用提供理论基础和技术支持。
凝固点降低法测定物质的相对分子质量纯萘、环己烷

华南师X大学实验报告课程名称物理化学实验实验项目凝固点降低法测相对分子质量【实验目的】①明确溶液凝固点的定义及获得凝固点的正确方法。
②测定环己烷的凝固点降低值,计算萘的相对分子质量。
③掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
④掌握贝克曼温度计的使用方法。
【实验原理】1、凝固点降低法测分子量的原理化合物的分子量是一个重要的物理化学参数。
用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。
稀溶液有依数性,凝固点降低是依数性的一种表现。
稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中物质的摩尔分数的关系式为:ΔT f = T f*-T f = K f m(1) 式中,T f*为纯溶剂的凝固点,T f为溶液的凝固点,m为溶液的质量摩尔浓度,K f为溶剂的凝固点降低常数,它的数值仅与溶剂的性质有关。
表一给出了部分溶剂的凝固点降低常数值。
如环己烷的K f=20 K·kg/mol,萘的K f= 6.9K·kg/mol。
表1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则此溶液的质量摩尔浓度m B为:3AB BB 10W M W m ⨯=mol/kg (2)式中,M B 为溶质的相对分子质量,将(2)式代入(1)式,则:3Af Bf B 10W T W K M ⨯∆=g/mol (3)若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值ΔT f ,即可计算溶质的相对分子量M B 。
2、凝固点测量原理纯溶剂的凝固点是它的液相和固相共存时的平衡温度。
若将纯溶剂缓慢冷却,理论上得到它的步冷曲线如图中的 A , 但实际的过程往往会发生过冷现象,液体的温度会下降到凝固点以下,待固体析出后会慢慢放出凝固热使体系的温度回到平衡温度,待液体全部凝固之后,温度逐渐下降,如图中的B 。
图中平行于横坐标的CD 线所对应的温度值即为纯溶剂的凝固点 T f*。
1凝固点降低实验报告

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B = ×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3)若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
