强弱电解质的比较1资料
强电解质和弱电解质的同与不同

强电解质和弱电解质的同与不同河北省易县塘湖中学(074200) 李振民一、 强、弱电解质概念上的四大区别强电解质在水溶液中全部电离,电离不可逆,不存在电离平衡,溶液中不存在电解质的分子,只有电解质的离子;其电离方程式写等号,在离子方程式中可溶的强电解质写离子符号。
弱电解质在水溶液中只有很少部分电离,电离可逆,存在电离平衡,溶液中存在大量的电解质分子,少量的电解质离子;其电离方程式写可逆符号,在离子方程式中写分子式。
二、有关强、弱电解质的“同与不同”:1.溶液中粒子种类数目不同:强电解质:少;一元弱电解质:多;多元弱电解质:更多。
2.相同溶液浓度时(1) 离子浓度:强大弱小。
酸中α(H +):二元强酸>一元强酸>>一元弱酸;碱中α(OH -):二元强碱>一元强碱>>一元弱碱。
(2) pH :酸是强小弱大;碱是强大弱小。
(3) 导电能力:强大弱小。
(4) 强、弱酸与活泼金属反应时的速率:强大弱小。
3.相同浓度、相同体积时:(即相同物质的量)(1) 离子的物质的量:强多弱少。
(2) 同体积、同浓度的同价酸、碱具有相同的中和能力或反应能力(四同);反应后溶液的pH 值:强强为7。
(3) 同温、同压下,同价的强、弱非氧化性酸与足量的活泼金属反应时,所耗金属量相同,收集到的氢气体积相同(五同)。
4.pH 相同时: α(H +)=(1) H +、OH -的离子浓度相同;(2) 溶液浓度:一元弱酸>>一元强酸>二元强酸;一元弱碱>>一元强碱>二元强碱。
(3) 强、弱酸与同一金属反应时,初速相同。
(4) 同等程度稀释时,弱酸的pH 值比强酸的pH 值增加得少些;弱碱的pH 值比强碱的pH 值下降得少些。
5.pH 相同、溶液体积相同时:(1) 溶质的物质的量:弱酸>>一元强酸>二元强酸; 弱碱>>一元强碱>二元强碱。
(2) 强、弱酸与同一金属(足量)反应时,所耗金属量:弱多强少; 产生的氢气量:弱多强少。
若酸过量,产生H 2量同,则金属量同,反应终了时所需时间:强多弱小。
强弱电解质的判断方法

强弱电解质的判断方法电解质是指在溶液中能够电离成离子的化合物,它们在维持人体正常生理功能中起着重要作用。
根据电解质在水中的电离程度的不同,可以将电解质分为强电解质和弱电解质两种。
强电解质在水中能够完全电离,生成大量离子,而弱电解质在水中只能部分电离,生成少量离子。
正确判断电解质的强弱对于临床诊断和治疗具有重要意义。
下面将介绍几种判断电解质强弱的方法。
首先,可以通过观察电解质的化学性质来判断其强弱。
强电解质通常是酸、碱或盐,具有较高的电离度,如盐酸、氢氧化钠等。
而弱电解质则通常是酸、碱的部分酸或部分碱,电离度较低,如乙酸、碳酸氢钠等。
因此,通过化学性质的观察,可以初步判断出电解质的强弱。
其次,可以通过电导率来判断电解质的强弱。
强电解质在水中能够迅速电离,生成大量离子,因此具有较高的电导率。
而弱电解质在水中只能部分电离,生成少量离子,因此具有较低的电导率。
通过测定溶液的电导率,可以间接判断电解质的强弱。
另外,可以通过观察电解质在水中的溶解度来判断其强弱。
强电解质通常具有较高的溶解度,能够在水中溶解并完全电离,生成大量离子。
而弱电解质的溶解度较低,只能部分电离,生成少量离子。
因此,通过观察电解质在水中的溶解度,也可以初步判断出其强弱。
此外,可以通过测定电解质溶液的pH值来判断其强弱。
强电解质在水中完全电离,生成大量离子,会显著改变溶液的pH值。
而弱电解质在水中只能部分电离,生成的离子较少,对溶液的pH值影响较小。
通过测定电解质溶液的pH值,也可以初步判断出电解质的强弱。
综上所述,通过观察电解质的化学性质、测定电导率、观察溶解度和测定pH值等方法,可以初步判断电解质的强弱。
在临床实践中,正确判断电解质的强弱对于指导治疗和预防并发症具有重要意义。
因此,医护人员需要熟练掌握这些判断方法,以确保临床工作的准确性和科学性。
强弱电解质分类

强弱电解质分类今天来唠唠强弱电解质的分类。
这强弱电解质啊,在化学世界里那可是相当重要呢。
电解质就是在溶解于水或者熔融状态下能够导电的化合物。
就好比电线里的铜丝能让电流通过一样,电解质在特定状态下能让电荷流动起来。
那咋区分强弱电解质呢?这可有讲究了。
强电解质呢,在水溶液里或者熔融状态下能够完全电离。
啥叫完全电离呢?就是说这些电解质分子一进到水里或者被加热到熔融状态,就立马变成了离子,一点儿都不拖泥带水。
像强酸、强碱和大多数盐都是强电解质。
比如说盐酸,那家伙,一到水里,“唰”的一下就变成了氢离子和氯离子,一点儿不含糊。
再比如氢氧化钠,一遇水就变成了钠离子和氢氧根离子,速度快得很。
还有那些常见的盐,像氯化钠,在水里也是马上就变成钠离子和氯离子,导电能力杠杠的。
而弱电解质呢,在水溶液里或者熔融状态下只能部分电离。
就是说它们进到水里或者被加热后,只有一部分分子变成了离子,还有一部分分子还是原来的样子。
弱酸、弱碱和水都是弱电解质。
比如说醋酸,在水里只有一部分醋酸分子会电离成氢离子和醋酸根离子,大部分还是以醋酸分子的形式存在。
还有氨水,也是只有一部分氨分子会和水反应生成铵根离子和氢氧根离子。
水本身也是弱电解质呢,虽然它也能电离出氢离子和氢氧根离子,但是非常少,所以水的导电能力很弱。
为啥要分强弱电解质呢?这可关系重大啊。
在化学反应中,强弱电解质的表现可不一样。
强电解质因为能完全电离,所以在反应中往往比较剧烈。
比如强酸和强碱的反应,那速度可快了,一下子就生成了盐和水。
而弱电解质呢,由于只能部分电离,反应就会比较温和。
而且在溶液的导电性方面,强电解质溶液的导电能力通常比弱电解质溶液强得多。
这就好比一条宽阔的大马路和一条狭窄的小路,强电解质溶液里的离子就像在大马路上奔跑的车辆,多而且跑得快,导电能力自然就强。
而弱电解质溶液里的离子就像在小路上慢慢走的行人,少而且走得慢,导电能力就弱了。
在实际生活中,强弱电解质也有很多应用呢。
强弱电解质的判断与比较--2024年高考化学考点微专题(学生版)

微专题强弱电解质的判断与比较1(2023·浙江·统考高考真题)草酸(H2C2O4)是二元弱酸。
某小组做如下两组实验:实验I:往20mL0.1mol⋅L-1NaHC2O4溶液中滴加0.1mol⋅L-1NaOH溶液。
实验Ⅱ:往20mL0.10mol⋅L-1NaHC2O4溶液中滴加0.10mol⋅L-1CaCl2溶液。
[已知:H2C2O4的电离常数K al=5.4×10-2,K a2=5.4×10-5,K sp CaC2O4=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是A.实验I可选用甲基橙作指示剂,指示反应终点B.实验I中V(NaOH)=10mL时,存在c C2O2-4<c HC2O-4C.实验Ⅱ中发生反应HC2O-4+Ca2+=CaC2O4↓+H+D.实验Ⅱ中V CaCl2=4.0×10-8mol⋅L-1=80mL时,溶液中c C2O2-42(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。
其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。
下列说法不正确的是A.醋酸钠是强电解质B.醋酸钠晶体与冰都是离子晶体C.常温下,醋酸钠溶液的pH>7D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出一、判断弱电解质的三个思维角度1.弱电解质的定义,即弱电解质不能完全电离,如测0.1mol·L-1的CH3COOH溶液的pH>1。
2.弱电解质溶液中存在电离平衡,条件改变,平衡移动,如pH=1的CH3COOH加水稀释10倍后,1<pH<2。
3.弱电解质形成的盐类能水解,如判断CH3COOH为弱酸可用下面两个现象:(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。
现象:溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。
强弱电解质分析对比
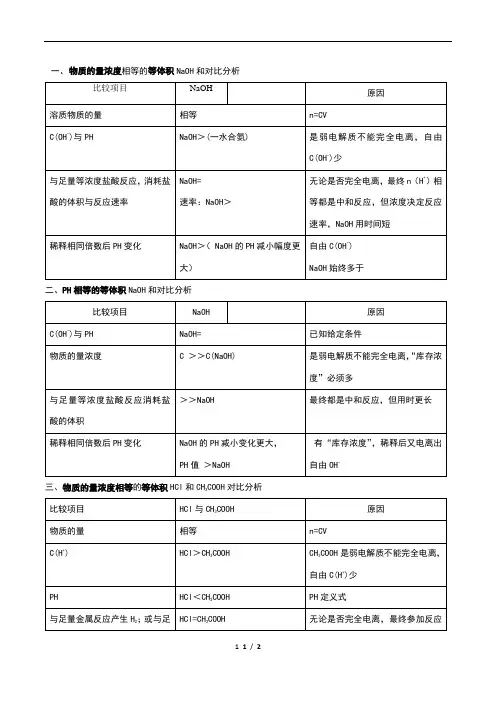
HCl<CH3COOH
PH定义式
与足量金属反应产生H2;或与足量Na2CO3反应产生CO2的量;
HCl=CH3COOH
无论是否完全电离,最终参加反应n(H+)相等
稀释相同倍数后PH变化
HCl<CH3COOH
自由C(H+) CH3COOH始终少于HCl
四、PH相等的等体积HCl和CH3COOH对比分析
比较项目
HCl与CH3COOH
原因
C(H+)与PH
HCl=CH3COOH
已知条件
物质的量浓度
C (CH3COOH)>>C(HCl)
CH3COOH是弱电解质不能完全电离,“库存浓度”必须多
与足量金属反应产生H2;或与足量Na2CO3反应产生CO2的量;
CH3COOH>>HCl
无论是否完全电离,最终参加反应n(H+)CH3COOH更多
稀释相同倍数后PH变化
NaOH>(NaOH的PH减小幅度更大)
自由C(OH-)
NaOH始终多于
二、PH相等的等体积NaOH和对比分析
比较项目
NaOH
原因
C(OH-)与PH
NaOH=
已知给定条件
物质的量浓度
C >>C(NaOH)
是弱电解质不能完全电离,“库存浓度”必须多
与足量等浓度盐酸反应消耗盐酸的体积
一、物质的量浓度相等的等体积NaOH和对比分析
比较项目
NaOH
原因
溶质物质的量
相等
n=CV
C(OH-)与PH
NaOH>(一水合氨)
是弱电解质不能完全电离,自由C(OH-)少
与足量等浓度盐酸反应,消耗盐酸的体积与反应速率
电解质的强弱认识

电离常数( 一定温度下, 2,一定温度下,等浓度的弱酸或弱碱可通过电离常数(电离 的大小来分析酸或碱的相对强弱! 度)的大小来分析酸或碱的相对强弱! 电离常数(25℃ 化学式 电离常数 ℃ ) HClO 3.0╳ 10-8 CH3COOH 1.8╳ 10-5
NH3 H2O 1.8╳ 10-5
★★识记: ★★识记:属于强电解质的物质 识记
相同的强酸和弱酸溶液中, 相同, ②pH相同的强酸和弱酸溶液中,其c(H+)相同,但 相同的强酸和弱酸溶液中 相同 物质的量浓度不同,弱酸的物质的量浓度大, 物质的量浓度不同,弱酸的物质的量浓度大,故等体 积的溶液中弱酸的物质的量较大,反应能力较强. 积的溶液中弱酸的物质的量较大,反应能力较强. pH相同的强碱和弱碱溶液中,其c(OH-)相同, 相同的强碱和弱碱溶液中, 相同, 相同的强碱和弱碱溶液中 相同 但物质的量浓度不同,弱碱的物质的量浓度大, 但物质的量浓度不同 弱碱的物质的量浓度大,等体积 弱碱的物质的量浓度大 的溶液中弱碱的物质的量较大,反应能力较强. 的溶液中弱碱的物质的量较大,反应能力较强. 弱碱的物质的量较大
考虑:下列物质中① 考虑:下列物质中①CH3COOH; ②HCl; ③NaOH;④ ④ Cu(OH)2; ⑤BaSO4; ⑥Na2CO3; ⑦C2H5OH; ⑧H2O ⑨SO2; ⑩Fe ;
①反应所需时间B> A 反应所需时间 > ②开始反应速率A > B 开始反应速率 ③参加反应的Zn的质量是 参加反应的 的质量是A=B ④整个反应阶段平均速率B > A 整个反应阶段平均速率 的质量是 ⑤ HCl里Zn有剩余 里 有剩余 ⑥ CH3COOH里Zn有剩余 里 有剩余
A.③ ④ ⑤ ③ C.② ③ ⑥ ②
强酸: HCl, H2SO4, HNO3, HI, HBr 等 HCl, HI, 强碱 :KOH ,NaOH, Ca(OH)2,Ba(OH)2等 KOH NaOH, 绝大多数盐: NaCl,NH4Cl ,BaSO4 ,CaCO3 等 绝大多数盐: NaCl, 金属氧化物:Al2O3,Na2O,MgO等 MgO等 金属氧化物:
强弱电解质的判断
强弱电解质的判断高中化学学到这里;大家对于化学的理解;应该已经摆脱了仅仅是五颜六色的瓶瓶罐罐了..是的;就像任何一门理科学科一样;化学也有自己的知识体系和理论基础..接下来我们要集中训练的章节就是高中化学又一块难啃的骨头——水解平衡..这一章节的难度比较大;在高考中当然也是重头戏;要求同学对以前学过的相关化学知识有牢固的基础..尽管同学们在刚刚接触这一块知识时可能会比较郁闷;但是;功夫不负有心人..只要我们脚踏实地一步步地来;抓住解题主要思路的同时反复地砸实基础知识;再复杂的题目也会迎刃而解..下面;我们就从这一章的基础——关于强弱电解质的判断开始;由基底到升华;一点点把这一章攻克下来..核心概念作答这一部分练习时;我们要抓住两个核心概念:第一、电解质的分类..大家要特别注意;分三类:强电解质、弱电解质和非电解质..哪些物质有资格踏进“电解质”家族呢电解质...是指在水溶液中或熔融状态下能够导电的化合物;例如酸、碱和盐等;非电..解质..则是在水溶液中或熔融状态下不能导电的化合物;如CO2、SO2、NH3等..像Cu;Cl2等非化合物的单质;根本就跟“电解质”搭不上边;所以它们既不是电解质也不是非电解质..考试中我们也曾经遇见过判断某物质属于电解质与否的类型题..我们只要记住; 强调能被称为电解质的物质:①一定是化合物;②该化合物在一定条件下有导电性;条件是指在溶液中或熔化状态下;以上两个条件缺一不可第二、判断强、弱电解质..大家要记住两者的本质区别:电离程度不同..在溶液中或熔融状态下;强电解质几乎完全电离;而弱电解质则部分电离且存在电离平衡..在这里大家也要清楚地知道;电解质溶液的导电能力的强弱取决于溶液里自由移动离子浓度的大小;和电解质的强弱不一定有关..抓住以上两个主线;同学们就能够有理可循进行判断了..下面我们就来实地体验一下;看看题目是怎样万变不离其中的..体验1下列物质中;属于强电解质的是ASO3BH3PO4CBaSO4DHI体验思路:这道题让我们选择强电解质..从我们总结的核心概念出发;寻找符合强电解质的两个条件:1、该物质是电解质;2、该物质是强电解质..体验过程:A:第一个选项就有一定的迷惑性..SO3溶于水;发生如下反应;SO3+H2O=H2SO4;H2SO4可以在水溶液中电离出自由移动的离子;可以导电;而SO3本身却不能电离出离子;所以SO3是非电解质..B:H3PO4在水溶液中能够导电;是化合物;属于电解质;但是H3PO4在水溶液中不能全部电离;仅能部分电离;所以H3PO4是弱电解质..C:大家要格外注意这个选项..虽然BaSO4的溶解度很小;但是其溶解在水中的部分;能全部电离..所以BaSO4是电解质;而且是强电解质..尽管BaSO4溶液的导电能力极弱;但是导电能力仅与溶液中可自由移动的离子浓度有关;不能作为强弱电解质的判断标准..D:经过以上分析;这最后一个选项就比较清楚了..HI在水溶液中能全部电离成自由移动的离子;所以它当然是强电解质啦..答案:C、D..体验2能说明醋酸是弱电解质的事实是A醋酸溶液的导电性比盐酸弱B醋酸溶液与碳酸钙反应;缓慢放出二氧化碳C醋酸溶液用水稀释后;氢离子浓度下降D0.1mol/L的CH3COOH溶液中;氢离子浓度约为0.001mol/L.体验思路:与上一道题目不同;第二题要求我们对弱电解质作出选择..依然把握住我们判断弱电解质的两个核心要点:1、是电解质;2、电离程度弱..相信你能够轻松给出答案..体验过程:我们已知醋酸在水溶液中能够导电;所以是电解质..在前三个选项中;溶液导电性的强弱;与碳酸钙反应放出二氧化碳的速度;以及稀释后某种离子浓度下降;都与溶液中自由移动的离子浓度的大小有关;不能说明CH3COOH在水溶液中仅能部分电离;不能够作为弱.电解质的判断标准..而在D选项中;0.1mol·的CH3COOH溶液中;氢离子浓度约为0.001mol/L;可以说明CH3COOH在水溶液中仅有部分电离成离子;是弱电解质..答案:D..体验3请将下列物质分类:①HCl②H2S③NaHCO3④CO2⑤Al2SO43⑥Cl2⑦NH3⑧CH4⑨BaSO4⑩FeOH3一属于强电解质的是_______二属于弱电解质的是______三属于非电解质的是______体验思路:经过了前两题的演练;相信你已经具备一定的眼力来分辨强弱电解质了..要记住抓住两个核心要点不放..看看你是否能够全部做对体验过程:解这道题分为三步..首先;对10个选项做第一轮的筛选:将没有“电解质”资格的物质剔出队伍..Cl2不是化合物;不属于电解质也不属于非电解质..第二步;从剩下的9个选项中分出非电解质..CH4水溶液和熔融状态均不导电;而CO2、NH3溶于水生成的H2CO3和NH3、H2O可以在水溶液中电离生成自由移动的离子;但是CO2、NH3本身不能够电离出离子..属于非电解质..第三步;在剩下的物质中;HCl 、NaHCO3、Al2SO43、 BaSO4无论溶解度如何;溶于水的部分能够全部电离;属于强电解质..剩下的自然就是弱电解质啰..记住哦弱酸和弱碱都是弱电解质答案:属于强电解质的是①③⑤⑨;属于弱电解质的是②⑩;属于非电解质的是④⑦⑧..怎么样;经过以上的练习;你对强弱电解质的区分应该没有问题了吧一定要记住我们总结的两点判断方法;再遇到这一类问题必定迎刃而解下面我们实践解决几道题目吧;擦亮你的眼睛哦实践1下列物质的水溶液能导电;但属于非电解质的是A. CH3CH2COOH B. Cl2C. NH4HCO3D. SO2指点迷津:如果用心领会了体验题;这是一道很简单的题目..实践略解:四个选项的水溶液都能够导电;但A属于弱电解质;B为单质;即不是电解质也不是非电解质;C是强电解质;只有D的水溶液能够导电而属于非电解质..答案:D..实践2在医院施行外科手术时;常用HgCl2稀溶液作为手术刀的消毒剂;已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2在熔融状态下不能导电;③HgCl2在水溶液中可发生微弱电离..下列关于HgC12的叙述正确的是:A.HgCl2属于共价化合物B.HgCl2属于离子化合物C.HgCl2属于非电解质D.HgCl2属于强电解质指点迷津:这是一道信息题..但是从我们的核心概念出发仍然可以轻松解题..实践略解:晶体熔点低、在熔融状态下不能够导电;这是共价化合物的特点;在水溶液中能够微弱电离;证明HgCl2属于弱电解质..答案:A..实践3在同一温度下;弱电解质溶液a;强电解质溶液b;金属导体c的导电能力相同..若升高温度后;它们的导电能力是A.a>b>c B.a=b=c C.c>a>b D.b>c>a指点迷津:这是一道高考题..考察同学们温度对物质导电能力的影响;也与电解质的概念的准确把握是分不开的..体验过程:弱电解质的电离平衡随温度的升高正向移动;溶液导电能力升高;强电解质在溶液中完全电离;温度对溶液的导电能力无影响;而金属随温度的升高电子的自由移动能力增强;导电能力下降..答案:A..课后练习1、下列关于强、弱电解质的叙述中正确的是A、强电解质都是离子化合物;弱电解质都是共价化合物B、强电解质都是可溶性化合物;弱电解质都是难溶性化合物C、强电解质的水溶液中无溶质分子;弱电解质的水溶液中有溶质分子D、强电解质的导电能力强;弱电解质的导电能力弱2.下列说法是否正确A.其水溶液能导电的物质一定是电解质..B.强电解质的水溶液导电能力一定强.C.石墨能导电;所以是电解质..D.BaSO4不溶于水;所以不是电解质..E.SO2、NH3、Na2O溶于水可导电;所以均为电解质3、下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是A、HCl、CaCO3、SO2B、HClO、H2S、C2H5OHC、KNO3、CH3COOH、NH3D、BaSO4、H3PO4、H2O4.下列物质中:①Fe;②Cl2;③CH3COOH;④BaSO4;⑤H2O;⑥SO3;属于电解质的是 A.①和② B.②、③、④ C.③、④、⑤D.全部5. 弱电解质和强电解质的本质区别在于A.物质的量浓度相同时;溶液的导电能力相同B.电离程度的大小C.水溶液中是否存在除水的电离平衡外电离平衡D.电离方程式的写法不同练习答案1、C;2、均不对;3、C;4、C;5、C..。
高中化学最基础考点系列考点强弱电解质的判断新人教选修
考点7 强、弱电解质的判断【考点定位】本考点考查强、弱电解质的判断,提升对电解质概念及电解质电离理论的理解,涉及电解质与非电解质、强弱电解质的判断及实验证明。
【精确解读】1.电解质和非电解质:非电解质:在熔融状态或水溶液中都不能导电的化合物.电解质:溶于水溶液中或在熔融状态下能够导电(自身电离成阳离子与阴离子)的化合物.可分为强电解质和弱电解质.电解质不一定能导电,而只有在溶于水或熔融状态时电离出自由移动的离子后才能导电.离子化合物在水溶液中或熔化状态下能导电;某些共价化合物也能在水溶液中导电,但也存在固体电解质,其导电性来源于晶格中离子的迁移2.强电解质和弱电解质:强电解质是在水溶液中或熔融状态中几乎完全发生电离的电解质,弱电解质是在水溶液中或熔融状态下不完全发生电离的电解质.强弱电解质导电的性质与物质的溶解度无关.强电解质一般有:强酸强碱,活泼金属氧化物和大多数盐,如:碳酸钙、硫酸铜.也有少部分盐不是电解质;弱电解质(溶解的部分在水中只能部分电离的化合物,弱电解质是一些具有极性键的共价化合物)一般有:弱酸、弱碱,如;醋酸、一水合氨(NH3•H2O),以及少数盐,如:醋酸铅、氯化汞.另外,水是极弱电解质。
3.弱电解质的判断方法(以盐酸和醋酸为例):(1)通过测定同浓度、同体积的溶液的导电性强弱来鉴别实验:等体积、浓度均为0.5mol•L-1的盐酸和CH3COOH溶液的导电性实验表明,盐酸的导电能力比CH3COOH 溶液的导电能力大得多.因为溶液导电能力的强弱是由溶液里自由移动离子的浓度的大小决定的.规律1:同物质的量浓度的酸溶液,酸越弱,其溶液的导电能力越弱;(2)通过测定同浓度溶液的pH大小来鉴别实验:在常温下,用pH试纸的测定0.1mol•L-1的盐酸和CH3COOH溶液的pH,盐酸的pH为1,CH3COOH 溶液的pH约为3.这就表明盐酸是完全电离的强酸,CH3COOH是部分电离的弱酸;规律2:同物质的量浓度的酸溶液,酸性越弱,溶液的pH越大.若两种酸溶液的pH相同,酸越弱,溶液的浓度越大;(3)通过比较同浓度、同体积的溶液与同一种物质反应的速率快慢来鉴别实验:分别用3.25g锌与体积都为200mL、浓度都为1mol•L-1的盐酸和CH3COOH溶液反应,观察到锌与盐酸反应剧烈,产生H2的速率快,锌很快反应完;锌与CH3COOH溶液反应慢,产生H2的速率缓慢,锌在较长一段时间内才消耗完.这表明盐酸是强酸,CH3COOH是弱酸.规律3:等物质的量浓度的酸,酸越弱,其c (H+)越小,反应速率越慢(4)通过测定同浓度的酸所对应的钠盐溶液的pH大小来鉴别实验:在常温下,用pH试纸测定0.1 mol•L-1的NaCl和CH3COONa溶液的酸碱性.实验表明,NaCl溶液的pH等于7,而CH3COONa溶液的pH大于7.这就表明盐酸是强酸,CH3COOH是弱酸;规律4:等物质的量浓度下,一元酸的钠盐溶液,其“对应的酸”越弱,溶液的pH越大;(5)通过比较体积相同、pH相同的酸溶液同倍数稀释后,溶液的pH变化大小来鉴别实验:将等体积、pH都为2的盐酸和CH3COOH溶液分别加蒸馏水稀释相同的倍数(如100倍).然后分别用pH试纸测定稀释后溶液的pH,其结果是盐酸稀释后pH变化幅度大(pH=4),CH3COOH溶液稀释后,pH 变化幅度小(pH≈3.30).这表明CH3COOH溶液在稀释过程中,除H+浓度减小外,还存在CH3COOH⇌H++CH3COO-,电离平衡向右移动,电离出更多的H+,由此说明盐酸是完全电离的强酸,CH3COOH 是部分电离的弱酸;规律5:在pH相同时,同体积的酸,酸越弱,抗稀释能力越强,即稀释相同倍数下,pH变化幅度越小;(6)通过比较同体积、同pH的溶液分别与同种物质发生完全反应时,消耗的物质的量的多少来鉴别实验:体积都为10mL、pH都为2的盐酸和CH3COOH溶液,分别同0.01mol•L-1的NaOH溶液进行中和滴定,结果CH3COOH溶液消耗的NaOH溶液的体积比盐酸大得多.这表明CH3COOH溶液与NaOH溶液中和时,随H+浓度的减少,电离平衡CH3COOH⇌H++CH3COO-向右移动,直至所有的CH3COOH分子被耗尽.这说明CH3COOH 是部分电离的弱酸;规律6:在pH相同的条件下,同体积的酸,酸越弱,其中和能力越强;(7)通过向酸溶液中加入与之相应的钠盐,引起溶液pH变化的大小来鉴别实验:在100mL0.01mol•L-1的盐酸里加入少许NaCl固体,用pH试纸测定溶液pH的变化,结果无明显变化.这表明盐酸里不存在电离平衡.另在100mL0.01mol•L-1 CH3COOH溶液里加入少许CH3COONa固体,用pH试纸测定溶液pH的变化,结果pH明显变大.这表明CH3COOH溶液中存在电离平衡CH3COOH,由于CH3COO-浓度的增大,使电离平衡向逆方向移动,H+浓度减小,pH增大;规律7:在等物质的量浓度的酸溶液中,分别加入相应的盐固体(电离出相同的酸根离子),引起pH变化越大,其相酸性越弱。
强电解质和弱电解质
C(HAC)
减小 增大 增大 增大 减小 减小 减小
增大 加冰醋酸 减小 加醋酸钠 加HCl 加NaOH 锌粒 减小 减小 增大 增大 增大
加水
增大 减小 增大 减小 增大 减小 减小 增大
减小
增大 增大 减小 增大 增大 减小 减小 增大 减小 增大 增大 增大
强弱电解质的区分依据不是看该物质水溶性的大 小,也不是看其水溶液导电能力的强弱,而是看电 离的是否完全.
高中化学交流群:51417113
思考并讨论 1.难溶物一定是弱电解质吗?
2.强电解质溶液的导电能力一定强吗?
3.强电解质溶液的导电能力一定强于弱电解质吗? 4.强酸的酸性一定比弱酸强吗?
高中化学交流群:51417113
高中化学交流群:51417113
③影响电离平衡常数大小的因素:
A.电离平衡常数大小是由物质的 本性决定的,在同一温度下,不 同弱电解质的电离常数不同。
B.弱电解质的电离平衡常数大小 受温度变化的影响,不受其浓度 变化的影响。
高中化学交流群:51417113
多元弱酸,分步电离,第一步电离大于第二步 电离,第二步电离远大于第三步电离.
(mol/L)
1.00
4.21×10 4.21×10
0.100
CH3COOH+
0.99579 0.09866 溶液越稀越易电离. -3
-3
1.34×10-3
-5
1.34×10-3
c (CH3COO-)· H+) c( c (CH3COOH)
已电离的醋酸浓度 醋酸初始浓度 ×100%
1.8×10
-5
1.8×10 1.34%
强、弱电解质的比较与判断
考点三强、弱电解质的比较与判断【过程与方法】[复习提要]一、强、弱电解质的比较以一元强酸(HCl)与一元弱酸(CH3COOH)的比较为例。
二、强、弱电解质的判断方法(以HA为例)1.从是否完全电离的角度判断2.从是否存在电离平衡的角度判断(1)从一定pH的HA溶液稀释前后pH的变化判断如将pH=3的HA溶液稀释100倍后,再测其pH,若pH=5,则为,若pH<5,则为。
(2)从升高温度后pH的变化判断若升高温度,溶液的pH明显减小,则是。
因为弱酸存在电离平衡,升高温度时,电离程度增大,c(H+)增大。
而强酸不存在电离平衡,升高温度时,只有水的电离程度增大,pH变化幅度小。
3.从酸根离子是否能发生水解的角度判断可直接测定NaA溶液的pH:若pH=7,则HA是;若pH>7,则HA是。
[自我检测]1.(2016·沈阳高三模拟)将c(H+)相同的盐酸和醋酸分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的c(H+)仍相同,则m和n的关系是()A.m>n B.m<nC.m=n D.不能确定2.(2016·东北师大附中模拟)已知HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是()A.对比等浓度的两种酸溶液的pHB.对比等浓度的两种酸溶液与相同大小镁条反应的初始速率C.对比等浓度、等体积的两种酸溶液与等量NaOH溶液反应后放出的热量D.对比等浓度、等体积的两种酸溶液与足量Zn反应生成H2的体积3.为了证明一水合氨是弱碱,甲、乙、丙三位同学分别设计以下实验进行探究。
(1)甲同学用pH试纸测得室温下0.10mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,理由是_______________________________________________________ _________________________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NaOH体积由大到小的顺序是 硫酸>盐酸= 醋酸
。
(5)三种酸的pH值由大到小的顺序是 醋酸>盐酸>硫酸。
讨论:强弱电解质的比较 (2)
请比较pH相同、体积相同盐酸、醋酸、硫酸:
c(H+)
c(酸)
中和碱能力
与足量Zn反应 产生H2的量
与Zn开始速率
加等量水稀释后 的pH
盐酸 醋酸 硫酸 盐酸 = 醋酸 = 硫酸 醋酸 > 盐酸 > 硫酸 醋酸 > 盐酸 = 硫酸
练习12:
导电能力
5.在一定温度下,冰醋酸加水稀释过
a
程中,溶液的导电能力随加入水的
体积V变化的曲线如右图所示。请回
答:
(1)“O”点导电能力为0的理由 是 在O点处醋酸未电离,无自由移动的。离子
O
b c
V
(2)a、b、c三点处,溶液的pH由小到大的
顺序为 b < a < c
。
(3)a、b、c三点处,电离程度最大的是 c点。
讨论:强弱电解质的比较(1) :
有0.1 mol/L的盐酸、醋酸、硫酸各50ml,试比较:
(1)三种酸里氢离子浓度由大到小的顺序是硫酸>盐酸。>醋酸
(2)三种酸与足量的锌反应,开始时产生H2的速率是 硫酸>盐酸>醋酸 。
(3)三种酸与足量的锌反应产生H2的体积是硫酸>盐酸。= 醋酸
(4)三种酸分别与0.1 mol/L的NaOH溶液中和反应,消耗
(4)若使c点溶液中c(Ac-)增大, pH也增大,可采取的措施是:
① 加入NaAc 固体 ② 加入NaOH固体
④ 加入Zn、Mg等金属
③加入Na2C。O3固体
的体积VX>VY D、稀释后,X溶液的碱性
Vml 10 1000
比Y溶液的碱性强
4.(09山东15)某温度下,
相同pH值的盐酸和醋酸溶液分 B
别加水稀释,平衡pH值随溶液 体积变化的曲线如右图所示。
据图判断正确的是 B
A.II为盐酸稀释时的pH值变化曲线 B.b点溶液的导电性比c点溶液的导电性强 C.a点KW的数值比c点Kw的数值大 D.b点酸的总浓度大于a点酸的总浓度
符合客观事实?( C )
3.pH=12的X、Y两种碱溶液各10ml, 分
别稀释至1000ml,其pH与溶液体积(V)的关系
如下图所示,下列说法正确的是( B )
A、X、Y两种碱的物质的量 PH
浓度一定相等
12
B、若10< a< 12,则X、Y 都是弱碱
C、完全中和X、Y两溶液, a
Y X
消耗同浓度盐酸
⑤测定同pH值HA与HCl稀释 pH值变化小的为弱酸 相同倍数前后pH值变化
1.现有PH相同的HCl和HAC分别稀释m倍和n 倍后, PH仍然相同,则m和n的关系是( )
A. mB> n B. m<n C. m=n D.无法确定
Байду номын сангаасPH
HCl HAC
加水体积
2.在体积都为1L,C(H+)= 0.01mol/L的盐酸 和醋酸溶液中,投入0.66g锌,则下列哪组比较
醋酸 > 盐酸 = 硫酸
盐酸 = 醋酸 = 硫酸 盐酸 = 硫酸 > 醋酸
实验设计:证明某酸(HA)为弱酸
实验方法
结论
①测0.01mol/L HA的pH值 若pH>2,HA为弱酸
②测NaA溶液的pH值
若pH>7,HA为弱酸
③相同条件下,测HA和HCl 导电性弱的为弱酸 (强酸)溶液的导电性
④往同浓度HA和HCl(强酸) 速率慢的为弱酸 中投入相同Zn粒或CaCO3固 体
