第四章-高等无机化学-课件
高等无机化学(课堂PPT)

1. 所有独立的对称操作构成一个具有封闭性的集合(完备集)
封闭性:集合中任意两个操作的乘积都属于该集合
2. 集合中对称操作乘法的结合律成立,如对于水分子:
(C2v)v = vv = E C2(vv) = C2C2 = E
3. 集合中任何一个操作A与恒等操作E的乘积等于该操作A本身:
AE = EA =A
4. 集合中任何一个操作都有逆操作在该集合中
逆操作:乘积为恒等操作的两个操作互称逆操作。 如C3 与C32
E和二次操作C2,,i 的逆操作为其本身
29
所有这些特征正好符合数学中群(group)的定义! 可以借助群论方法解决分子对称性问题!
30
1.3 群的定义
对于一个集合G{a,b,c,…},在其元素之间定义一种运算 (通常称为“乘法”),如果满足下面4个条件,则称 集合G为群.
➢ 前者是一种动作,后者是一种几何元素 ➢ 一个对称元素可产生一个或一组对称操作
22
分子中的对称操作与对称元素
(真)旋转(Cnm, m = 1-n)和旋转轴(对称轴,真轴 proper axis, Cn) ➢n次旋转轴 Cn:基转角:θ=3600/n ➢一个Cn轴对应n个旋转操作: Cn, Cn2,…,Cnn-1, Cnn, 转动角 度分别为 θ, 2θ, …,(n-1)θ, nθ(=3600)
➢ 对于周期性的晶体结构,平移及其与点操作的组合导致 整体位移,称为空间操作,对应的群称空间群。
对称元素(symmetry elements)
➢ 对称操作所依赖的几何要素(点、线、面等)
21
分子中的对称操作与对称元素
① 恒等操作(identity operation,E)
➢ 维持分子不动或使分子回复到原始构型的操作 ➢ 恒等操作的引入是数学上的需要。
无机化学课件第四章

第四章氧化还原与电化学离子—电子法酸性介质酸性介质))1)写出两个半反应写出两个半反应::MnO -Mn 2+ (MnO -Mn 2++ 8H ++ 4 H O +5e SO 3SO 4+ 2H + H 2O + 3H O3)氧化剂氧化剂、、还原剂得失电子数相等还原剂得失电子数相等,,求出最小公倍数配平规律:酸性介质酸性介质,,多氧加多氧加H H +,少氧加少氧加H H 2O碱性介质碱性介质,,多氧加多氧加H H 2O ,少氧加少氧加OH OH -中性介质中性介质,,反应物加反应物加H H2O ,生成物少氧加生成物少氧加OH OH -, , 多氧加多氧加多氧加H H+4.2 电极电势: 将化学能转变为电能的装置将化学能转变为电能的装置作用原理原反应可以组成原电池2+ ZnΔG ø= 212.25KJ/mol电子流出的电极—负极负极((-)Zn :Zn -2e = Zn 电子流入的电极—正极(+)Cu :电池反应电池反应::Zn + Cu 2+ = Cu + Zn原电池符号符号::(-)Zn | ZnSO4(c1) ‖CuSO4(c2) | Cu(+)/ Zn Cu/ Cu+ ne Cu 2+ + 2e Cu Zn 2++ 2e Zn + e Fe + 2e Fe 2+ 2e 2I Cu 2+ / Cu 2+ I 2/ I -1. 1. 金属金属—金属离子电极金属离子电极::电极符号:Zn | Zn 2+(c) Ag | Ag +(c)电极反应:Zn 2+ + 2e Zn Ag + e Ag2. 氧化还原电极氧化还原电极::电极符号电极符号::Pt | Sn 4+(c 1) , Sn 2+(c 2)电对电对::Sn 4+/ Sn 2+Sn 4++ 2e Sn2+3 . 3 . 气体气体—离子电极氢电极:Pt | H 2 ( p ) | H +(c) 电对电对::H+/ H 22H ++2e H 2氧电极:Pt | O 2( p ) | OH -(c) O 2/ OH -O + 4e + 2H O 4OH -4. 4. 金属金属—金属难溶盐—难溶盐离子电极(难溶盐电极难溶盐电极))Ag —AgCl (s) | Cl -(c) 或Ag | AgCl (s) | Cl -(c)电对电对::AgCl / AgAgCl + e Ag + Cl-Ag ++ e AgV :趋势4.2.2 电极电势的产生 E 1 1 产生产生V 溶解> V 沉积金属表面带负电带负电,,附近溶液带正电E(Cu 2+ / Cu ) > E(Zn 2+/ Zn)/ Cu) -E(Zn 2+/ Zn)标准氢电极Eø(H +/ H 2)= 0.0000V 将标准氢电极和标准锌电极组成原电池将标准氢电极和标准锌电极组成原电池,,测得电动势得电动势,,可算出锌电极的标准电极电势H ( 101325Pa )2H + (1mol/L) + 2e(-)Zn| Zn2+(1mol/L) ‖2e Zn+ 2e H 2Zn + H 2E= E+-E -= 0 -E -= 0.76V注标准电极电势只适用于溶液2 2 E Eø与得失电子数无关+e Fe= 0.77V + 2e 2Fe2+E = E(Cu/Cu) -E(Zn饱和甘汞电极饱和甘汞电极::金属金属Hg Hg Hg表面覆盖一层氯化亚表面覆盖一层氯化亚汞(Hg 2Cl 2),然后注入然后注入KCl KCl KCl溶液溶液E (Hg 2Cl 2/Hg )= 0.2415V+ e Hg (l) + Cl -2多孔物质导线绝缘体-----------------------------------….......Pt 丝汞汞和甘汞汞和甘汞混合物混合物KCl 加液口...a (a (氧化型氧化型氧化型))+ + ze zeb (b (还原型还原型还原型))][][ln还原型氧化型zF RT E E +=ΘZ:电极反应式中转移的电子数电极反应式中转移的电子数E (氧化型氧化型//还原型)= E ø+ ———lg —————氧化型]a [还原型]0.0592Z 4.2.3 4.2.3 影响电极电势的因素影响电极电势的因素例[Zn 2+] =0.01mol/L Eø(Zn2+/Zn ) =-0.76V ,求E (Zn2+/Zn)+ 2e Zn ] /Cø0.01/1 = -0.82 V < E ø0.05922例[H+] = 2mol/L , 求E (MnO 4-/ Mn 2+),其他浓度均为1 mol/L——————————= 1.491 + 0.0592 / 5 lg (2 )8= 1.519 V > Eø[Mn ]/C例实验室能否用二氧化锰与盐酸作用制取氯气MnO2+ 4HCl = MnCl2+ ClEø( MnO2/Mn2+) < Eø( Cl2/ Cl-) E < 0MnO 2+ 4H ++ 2e = Mn 2++ 2H 2O ([ H+Cl 2+ 2e = 2Cl-E = E (Cl / Cl -)= E ø+ 0.0592 / 2 lg——————= 1.29 V P Cl / P ø( [Cl -] / C ø)2例电对:Ag ++ e -AgEø(Ag +/Ag) = 0.779V在溶液中加入NaCl ,使[Cl -] = 1mol·L -1,计算E (Ag +/Ag) 为多少多少??[Ag ] = ———= 1.6 ×10[Cl -]E = Eø+ 0.0592 lgK spø= 0.221VAg +/Ag 后,形成新的AgCl/Ag 电极E ø(Ag +/Ag)E ø(AgCl/Ag)Eø(AgBr/Ag)E ø(AgI/Ag)K ø减小减小减小浓度对E 的影响:(1)对与酸度无关的电对对与酸度无关的电对,,如:M + e M , ————[M (3)电对中氧化型和还原型物质生成沉淀(弱电解质或配合物弱电解质或配合物),),),对对E 的影响4.2.4 电极电势的应用2 Fe3++ Sn2+2Fe2+ + Sn4+E ø(Sn 4+/ Sn 2+ ) = 0.15 V氧化还原反应总是自发地由较强氧化剂与较强还原剂相互作用较强还原剂相互作用,,向生成较弱还原剂和较弱氧化剂方向进行和较弱氧化剂方向进行。
高等无机化学第四章 金属原子簇

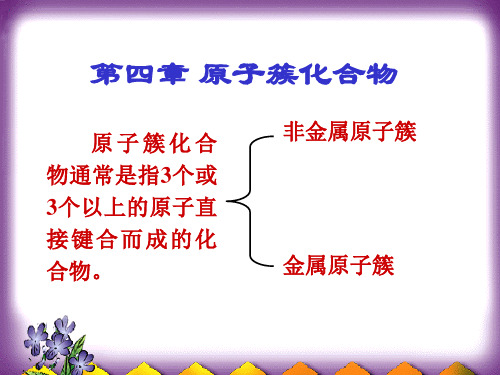
金属原子簇化合物分三类:
1.多核金属羰基,亚硝酰配合物
2.低价卤化物和羧酸配合物 3.无配体原子簇 Hg2Cl2可看作最简单的金属原子簇化合物. 1907,法,美分别报道Ta6Cl14· 2O. 7H 上世纪20年代Linder(Ger.)合成了[Mo6Cl8]Cl4. 1935,Brosset(Swed.)报道了K3W3Cl4···. ···
可被其它配体取代,这类簇化合物及其衍生物是数量最大, 发展最快,又是最重要的一类金属簇化合物: Fe: [Fe3(CO)11]-1, Fe3(CO)12, [Fe6(CO)16C]2-··· ·· Co: Co3(CO)9CR (R=H.Cl.Me.Ph等), Co4(CO)12
[Co6(CO15C]12, [Co13(CO24C2H]4-·· ·,
第四章 金属原子簇
目前,金属原子簇化学已成为无机化学前沿领域
之一. 因其电子结构特殊,成键方式新颖,成为结构化
学新课题,也是对化学键理论的新挑战.
金属原子间形成以多面体骨架为特征的金属原子
簇(metal cluster),最基本的共同点是含金属-金属 键,超越了经典Werner型配和物的范畴(仅考虑金属 与配体间化学键).
210o C 12 h
研究结果表明:随温度升高,原子簇增大,极端情况 下可形成金属Os.由于很大的金属羰基簇合物可以看
作是金属表面吸附了CO,因此金属多核羰基化合物反
应性能可能与Os表面吸附了一氧化碳分子有关,这对
多相催化研究提供了一个模型.
此外还有光化学缩合等方法. 3.金属-羰基原子簇反应
此类反应具有其自身的特殊性和复杂性.
25 C,CO, KPa 100 THF
o
[Rh5(CO)15]+CO
《高等无机化学》课件

课程介绍
探索无机化学的奇妙世界,介绍本课程的目标、内容和学习方法,为学生建 立起强有力的基础。
有机化学和无机化学的区别
1 结构差异
有机化合物以碳为主要构成元素,而无机化合物则包括其他元素。
2 反应类型
有机化合物的反应通常涉及碳的共有键断裂和形成,无机化合物则涉及金属和非金属之 间的反应。
催化剂
分析催化剂和机化学知识的核心内容和应用。
氢氧化物
研究水和碱金属氢氧化物的性质和应用。
氧化物
探索金属和非金属氧化物的产生和反应。
配合物
1
配位键
介绍中心金属离子和配体之间的配位键。
2
配合物命名
学习命名和表示法。
3
配合物反应
研究配合物的合成和反应机制。
无机反应与材料应用
酸碱中和
讨论酸碱反应和其在化学分 析中的应用。
氧化还原
探索氧化还原反应和其在电 池和腐蚀中的重要性。
3 应用领域
有机化学应用广泛于生命科学、药物研发和有机合成领域,无机化学则应用于催化剂、 材料科学和能源等。
无机化学基础
离子键
揭示离子化合物的结构和性质。
共价键
探讨共用电子对的形成和单双 三键。
金属键
解析金属离子化合物的特殊化 学键。
周期表和元素周期性
了解元素的分类和周期趋势。
氢氧化物和氧化物
无机化学课件:第四章(应化专业)

电池反应
Cu2+ + Zn →Cu + Zn2+
氧化还原电对:
氧化还原电对表示方法 氧化型物质/还原型物质
如 Cu2+/Cu、Zn2+/Zn、H+/H2、Sn4+/Sn2+
氧化型物质,还原型物质 如 Cu2+,Cu、Zn2+,Zn、H+,H2、Sn4+,Sn2+
(-)Pt, Cl2(p) Cl-(c) Cr2O72-(c1), H+(c2), Cr3+(c3) Pt(+)
原电池的表示方法课堂练习
2H2 + O2 → 2H2O
H2 - 2e- → 2H+ 氧化 O2 + 4H+ + 4e- → 2H2O 还原
(-) Pt, H2(p1) | H+(c1) || H+(c1), H2O | O2(p2), Pt(+)
而伽伐尼的朋友伏打则认为 他可以用任意两个金属和一 种潮湿的物质(食盐水)重 复上述现象,用伏打自己的 话来说:金属是真正的电流 激发者,而神经是被动的。 从而发明了伏打堆。 这一发现引起了极大地震动, 因为这是第一个可以产生持 续电流的装置。
公元1799年,伏打发明伏打電池。
一种利用两种不同的金属夹着盐水湿过的纸张、布片 的多种构造。相当于数个电池串联,故又称为伏打电 堆。
= 0V- 0.7626 V= -0.7626 V
3. 标准电极电势的意义
待测电极处于标准态时
物质皆为纯净物 有关物质的浓度为1mol·L-1 涉及到的气体分压为100kPa 此时测得的电极电势即为标准电极电势
高等无机化学生物无机化学课件

生物无机化学在农业中的应用
1 2 3
植物营养与施肥
生物无机化学研究植物对矿质元素的吸收、转运 和利用机制,为合理施肥提供科学依据,提高农 作物的产量和品质。
植物抗逆性与抗病性
通过研究植物体内金属离子和金属蛋白的调控机 制,提高植物的抗逆性和抗病性,发展抗逆抗病 作物新品种。
农产品安全与质量控制
利用生物无机化学的方法和技术,对产品中的 重金属和有害物质进行检测和控制,保障农产品 安全和质量。
生物无机化学中的配位键理论
配位键的定义
配位键是一种共价键,其中一方原子或基团提供电子,另一方原 子或基团接受电子。
配位键的形成条件
配位键的形成需要满足一定的几何构型和电子配对条件,通常涉及 一个中心原子和多个配位体之间的相互作用。
配位键在生物体系中的作用
配位键在生物体系中发挥着重要作用,如维持生物分子的结构和稳 定性、参与生物分子的反应和催化等。
03 酸碱反应和氧化还原反应
这两种反应是无机化学中最为常见的反应类型, 深入理解其反应机理对于理解无机化学十分重要 。
无机化学键理论
共价键理论
解释了共价键的形成和性 质,以及共价键在分子中 的表现。
金属键理论
解释了金属键的形成和性 质,以及金属晶体中的金 属键表现。
离子键理论
解释了离子键的形成和性 质,以及离子晶体中的离 子键表现。
高等无机化学生物无 机化学课件
汇报人:
202X-12-29
目录
• 绪论 • 无机化学基础知识 • 生物无机化学基本原理 • 生物无机化学的应用 • 高等无机化学生物无机化学前沿研
究
01
绪论
高等无机化学生物无机化学的定义与重要性
《无机化学》课件——第4章第2节化学平衡

1.NH4Cl(s)
NH3(g)+HCl(g)
2.3H2(g)+N2(g)
2NH3(g)
3.N2H4(l) 4.H2O
N2(g)+2H2(g) H++O15H-
5.Ag2S(s)+H2(g)
2Ag(s)+H2S(g)
15
二、化学平衡常数
❖ 化学平衡常数是可逆反应的特征常数,它表示在 一定条件下,可逆反应进行的程度。K值越大,表 明在一定条件下反应物转化为生成物的程度越大 ; K值越小,表明在一定条件下反应物转化为生 成物的程度越小。所以,从K值的大小,可以推断
❖ 由于催化剂能同等程度地改变正反应和逆反应的 速率,因此它对化学平衡的移动没有影响。但因
34
为它能大大缩短反应达到平衡的时间,所以在工 业生产中广泛使用催化剂来提高生产效率。
34
【课堂互动】
1.N2与H2反应合成NH3是一个可逆反应,其热化学方 程式为:
N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ·mol-1
A. 升高温度 B. 增大体系压强
C. 增大c(N2) D. 容器体3积6 增大
36
【课堂互动】
1. 压强变化不会使下列化学反应的平衡发生移动的 是( A )
A. H2(g)+I2(g) 2HI(g)
B. 3H2(g)+N2(g) 2NH3(g)
C. 2SO2(g)+O2(g) D. C(s)+CO2(g)
❖1. 可逆反应 ❖ 只能向一个方向进行到底的反应叫做不可逆反应. ❖ 如:
2KClO3 MnO2 2KCl + 3O2↑
❖像这种实际上只能向一个6 方向进行到底的反应叫 做不可逆反应。
高等无机化学学习ppt第四章 原子簇化合物
(3)与氧化剂反应: 几乎所有硼烷都对氧化剂极为敏感(如B2H6和B5H9在室温下 遇空气即激烈燃烧, 放出大量的热, 温度高时可发生爆炸, 只有分 子量较大的B10H14在空气中稳定)。 (4)与水反应: 除B10H14不溶于水且几乎不与水作用外, 其他所有硼烷在室
温下都与水反应而产生硼酸和氢。
(3)每个B-H键贡献两个电子、额外 H原子贡献一个电子 、C-H键贡献三个电子用于骨架成键, 如果分子中还含 有骨架原子S、P和N,则各贡献4个、3个和3个电子。 (4) 多面体骨架成键电子数M可按下式计算: M=3a+2p+q+c 骨架成键电子对数 b=(3a+2p+q+c)/2
例题判断BnHn2-、 B10H15-、, B3C2H7、 B10CPH11、 B11SH11 的结构,并给出命名。
三、 硼烷的化学键
1. 多中心定域键理论
硼的价电子构型为2s22p1, 它的价电子层有一条2s三条
2p轨道。3个价电子, 4条价轨道, 价轨道数多于价电子数。
(1) B:sp3杂化轨道 (2) 两个价电子和2条sp3杂化轨道和两个H 成键
(3) 还剩下2条sp3杂化轨道和1个价电子。 2个硼原子各用一条
sp3杂化轨道和氢原子的1s轨道相互作用: 三个原子、三条原子 轨道组合成3条分子轨道, 其中一条成键, 一条非键, 一条反 键。2个电子充填在成键分子轨道 上, 形成三中心两电子的(3C-2e) 氢桥键。 在B2H6分子中存在 2种硼氢键 , 即 4 条2C-2e端梢B-H键 、2条3C-2e桥式硼氢键。
例4, 对B10CPH11, 写作(CH)(BH)10P, a=1, p=10, q=0, c =0, 一个P原子, n=a+p+(P原子数)=1+10+1=12, b= (3×1+2×10+ 3)/2=13=12+1, 属闭式结构
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
引言
有机金属化学包括了为数众多的一大类化合物,它 是有机化学、无机化学、配位催化及量子化学等化学分 支学科相互渗透的边缘领域,同时又是无机化学极其活 跃的新兴领域之一。
配位化合物
原子簇 化合物
有机金属 化合物
引言
金属有机化学和有机金属化学是同一概念不
同的说法,直译英文为有机金属化学(Organometallic Chemistry),中文习惯称为金属有机化学。
第一节 有机金属化学概述
1.3 有机金属化合物的分类 按金属元素的种类分类
有机主族金属化合物 有机过渡金属化合物
按有机金属化合物的配体分类 配体:碳原子与金属形成键,配体大都为有机基团的
阴离子,如烷基、苯基等。 酸配体:碳原子与金属形成-反馈键,配体一般为中
性分子,如CO等。 配体:碳原子与金属形成键,其配体是烯烃和炔烃;
第一节 有机金属化学概述
1.1 有机金属化学及有机金属化合物的定义
即使有金属-碳键存在的化合物,有些显然属于无机 物,如金属碳化物(CaC2, Mg2C3, Al4C3) 和氰化物(KCN)。 但是,带有羰基(CO)的金属化合物显示出有机物的性质, 则列入有机金属化合物;金属氢化物属于有机金属化合物; B或Si-C化合物是有机金属化合物。周期表位于P以下的As, Sb, Bi的化合物通常按有机金属化合物处理。
事实上,化学物质的分类只是为了研究方便,并没有 非常严格的界定,通常是除了依据定义,还应根据物质的 性质进行分类。
电负性也用作定义标准,一般将电负性在2.0(含) 以下 元素与C成键的化合物称为有机金属化合物。
第一节 有机金属化学概述
1.2 有机金属化学发展历史
纵观有机金属部充满意外 发现的历史。
获得1912年诺贝尔化学奖
1951年Pauson和Miller合成 著名的“夹心饼干”—— 二茂铁
1950年初有机金属化学 飞速发展,是有机金属 化学新纪元的开端
有机金属化学是一个 闪烁着诺贝尔光环的 前沿领域!!
1953年末Ziegler(齐格勒) 领导的西德MaxPlank煤炭 研究所发现了Ziegler催化 剂。随后,Natta(纳塔) 发现Natta催化剂,合称 Ziegler-Natta催化剂
Ziegler, Natta(1963年) Wilkison, Fischer(1973年) 等由于这些研究获得了诺贝 尔化学奖。
2000年Alan J. Heeger, Alan G. MacDiarmid, Hideki Shirakawa因 Ziegler-Natta催化合成导电高分 子—聚乙炔而获得诺贝尔奖。
物。有机金属化合物中与金属键合的原子绝大多数是碳,但也有 其他原子,如二乙硫基汞(C2H5S)2Hg中乙硫基通过硫和汞键合; 四丙氧基钛(C3H7O)4Ti中丙氧基和钛键合。
广义地说,上述非M-C键的化合物,甚至准金属和非金属(B, P, Si等)与有机基团形成的化合物都归属有机金属化学范畴;但 狭义地说,有机金属化合物是指金属和一个或多个碳原子之间直 接键合的化合物。金属与有机基团的键合不是通过碳,而是通过 其他元素的原子所形成的化合物可称为金属有机化合物。
4 第 章 有机金属化学
目标&要求
掌握有机金属化合物的基本概念 掌握有机金属化合物配体类型及键合方式 掌握有效原子序数规则(18电子规则)及应用 了解典型有机金属化合物的结构及性质
过渡金属羰基化合物、类羰基过渡金属化合物 不饱和链烃配合物、夹心型配合物等
了解有机金属化合物的催化性质及应用
最早的有机金属化合物是 1827年由丹麦药剂师Zeise用乙醇 和氯铂酸盐反应而合成的
金属与烷基以键直接键合的 化合物是1849年由Frankland 在偶然的机会中合成的
1890年Mond发现了羰基镍的 合成方法
1900年Grignard发现了 Grignard试剂
Frankland是He的发现人。他设计的是一个获 取乙基游离基的实验: 实验中误将C4H10当成 了乙基游离基;但是这却是获得 二乙基锌的 惊人发现。所以人们称这个实验为“收获最多 的失败”。直到1900年Grignard试剂发现前, 烷基锌一直作为是重要的烷基化试剂使用。
或者是具有离域键的环状体系,如环戊二烯基、苯等。
第一节 有机金属化学概述
1.3 有机金属化合物的分类
按有机基团分类 烷基 羰基 氮分子 亚硝基 氰基 异氰基 不饱和烃(烯烃 炔烃) 环多烯 (环戊二烯 苯) 卡宾 卡拜
第一节 有机金属化学概述
1.1 有机金属化学及有机金属化合物的定义 1.2 有机金属化学发展历史 1.3 有机金属化合物的分类 1.4 主族金属和过渡金属有机金属化合物的不同特点 1.5 有机金属化合物配体类型及与过渡金属键合方式
第一节 有机金属化学概述
1.1 有机金属化学及有机金属化合物的定义 有机金属化学研究金属与有机基团直接相键合的一类化合
引言
研究有机金属化学具有重要的理论意义。如有机金属化合物 具有新颖的结构(如二茂铁、二苯铬的夹心结构),独特的化学 成键(如-协同成键)。
有机金属化合物在有机合成和化工生产中可以用作均相催化 剂,因此具有实际应用价值。如1955年Ziegler-Natta(齐格勒-纳 塔)发明的催化剂(R3Al+TiCl3)用于催化乙烯-丙烯均相聚合反应, 使聚乙烯、聚丙烯工业得以迅速发展,成为世界年产量高达几千 万吨的高分子工业中最大的产品。又如使用[RhI2(CO)2]-催化剂 可实现甲醇中插入CO的反应,即甲醇经羰基化生成乙酸,产率 高达99%,经济效益很高,美国采用该方法每年生产乙酸约45万 吨。
引言
此外,有机金属化合物还是烯烃的氢醛基化反应、同分 异构化以及氧化加成等反应的催化剂。
二烷基锡是聚氯乙烯和橡胶的稳定剂,用以抗氧和过滤 紫外线。
利用形成四羰基镍可以达到精炼镍的目的。 在半导体研制中,利用有机金属化合物的热解,已经成 功地制备了一系列III-V族和III-VI族的半导体化合物。
一、有机金属化学概述 二、有机金属化合物简介 三、有机金属化合物的应用
