应用5种荧光素同时标记24条人染色体-显微镜
-细胞凋亡的检测方法-

细胞凋亡的检测方法细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。
细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。
一、细胞凋亡的形态学检测二、磷脂酰丝氨酸外翻分析(Annexin V法)磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。
Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。
将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。
因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
方法1 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10ul,室温避光30min,再加入PI(50ug/ml)5ul,避光反应5min 后,加入400ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1h),同时以不加AnnexinV-FITC及PI的一管作为阴性对照。
2 贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。
3 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。
结果(图4、图5)注意事项1. 整个操作动作要尽量轻柔,勿用力吹打细胞。
2. 操作时注意避光,反应完毕后尽快在一小时内检测。
核型与带型分析

35
显带染色体:用特殊的染色方法使染色体沿其长轴 显示出明暗交替或染色深浅不同的横纹——带。
3 2
p
1
1 2
q3
4
6 5 4321
21
31 2
1 2
12 3 5 4 12 13 24
1p31
36
4 光谱核型分析(Spectral karyotyping, SKY)
12
等臂染色体
46,X, i (Xq) 46, X, i (X) (qter→ cen→ qter)
女性核型,有一条正常的X染色体和一 条X染色体长臂形成的等臂染色体(在细胞 分裂期间,染色体的着丝粒区在水平方向上 发生断裂,使染色体的两个臂分开,从而形 成两条等臂染色体 )。
13
pp
着丝点横裂
17
2 染色体染色技术
2.1 普通染色
普通染料直接染色在染色体标本上。由于整条 染色体都均匀着色,在显微镜下只能看到染色体的 外形,看不清其内部结构,只能根据染色体的相对 长度和着丝粒位置等外形体征来识别染色体。
这种染色方法只能正确地识别出第1、2、3、16、 17、18号及Y染色体,不能正确地识别出其他染色体 及染色体上的不同片段。对各条染色体的微小结构 变化,如缺失、易位等也不能检出。所以,对许多 染色体异常,特别是染色体结构变化的研究,受到 很大的限制。
3
2 染色体核型分析的意义:
◆不同物种的染色体都有各自特定的形态结构 (包括染色体的长度、着丝点位置、臂比、随体 大小等)特征,而且这种形态特征是相对稳定的。 因此,染色体核型分析是生物种质资源遗传性研 究的重要内容,在动植物分类和生物进化研究中 也得到广泛的应用;
实验二 荧光显微镜的基本使用方法

实验二荧光显微镜的基本使用方法荧光显微术是在细胞或组织水平上对生物大分子进行定位和动态观察的最常用的实验方法。
它广泛地应用于核酸、蛋白质、细胞器、细胞骨架、激素、离子等多种细胞结构或物质的定位和功能分析。
很多生命科学的研究工作都需要频繁地使用荧光显微镜。
比如,采用荧光探针的原位分子杂交用于确定某个基因在组织中的表达或在染色体上的定位(Polak et al. 1999; Andreeff and Wiley-Liss 1999),绿色荧光蛋白基因(gfp)用于了解某个基因产物在组织和细胞中的特异性分布(Chalfie et al. 1994; Haseloff and Amos 1995)等等。
然而,在我们接触的一些低年级研究生中,一些同学并没有很好地掌握荧光显微镜的基本原理和使用方法。
他们拍摄的荧光显微照片往往不能满足国际性高水平学术刊物的要求。
这种状况既不利于科研效率的提高,也限制了研究成果的发表。
因此,了解荧光显微术中的一些基本原理和注意事项、掌握荧光显微镜的基本使用方法是非常重要和有意义的。
本实验讲解荧光显微镜的基本结构和使用方法。
要求学生通过细胞核、细胞质DNA的荧光显微显示以及转绿色荧光蛋白基因拟南芥根、茎、叶细胞的观察掌握荧光显微术的基本原理和注意事项,熟练掌握荧光显微镜的使用方法。
实验目的:1. 了解荧光显微镜的基本结构;2. 掌握荧光显微术的基本原理和注意事项;3. 掌握核酸的荧光显示技术,直观地认识细胞质DNA的存在;4. 了解绿色荧光蛋白(GFP)在蛋白质定位等研究中的应用,直观地认识GFP的荧光显微效果。
实验内容:1.荧光显微镜的基本原理和结构荧光显微镜的放大成像原理与普通透射光显微镜完全相同。
不同的是荧光显微镜需要另外的激发光光源和光路。
因此,只要加上激发光光源和光路,再换上允许激发光通过的目镜(荧光显微镜的目镜在透镜玻璃的材质上与普通透射光显微镜不同),一台普通的透射光显微镜就可以被升级成一台荧光显微镜了。
免疫荧光抗体技术

免疫荧光抗体技术摘要:免疫荧光抗体技术是指用荧光素对抗体或抗原进行标记,然后用荧光显微镜观察荧光以分析示踪相应的抗原或抗体的方法。
其中,最常用的是以荧光素标记抗体或抗抗体,用于检测相应的抗原或抗体。
本文主要对他们的原理、特点的介绍,并对其前景进行了探讨。
关键字:免疫荧光抗体技术研究进展Abstact Immunofluorescence antibody technology refers to an antigen or antibody labeled with fluorescein, then observed by fluorescence microscopy and fluorescence analysis in tracing the corresponding antigen or antibody . The most commonly used is labeled with fluorescein antibody or antibody, used to detect the corresponding antigen or antibody 。
This paper mainly introduces the principle, characteristics of them, and their prospects were discussed . Key words immuno ,Immunofluorescence, research progress1.免疫荧光抗体标记技术荧光抗体技术示意图免疫荧光标记技术(immunofluorescence technique)是将已知的抗体或抗原分子标记上荧光素,当与其相对应的抗原或抗体起反应时,在形成的复合物上就带有一定量的荧光素,在荧光显微镜下就可以看见发出荧光的抗原抗体结合部位,检测出抗原或抗体。
免疫荧光标记技术始创于20世纪40年[1]代初,1942年Coons等首次报道用异氰酸荧光素标记抗体,检查小鼠组织切片中的可溶性肺炎球菌多糖抗原。
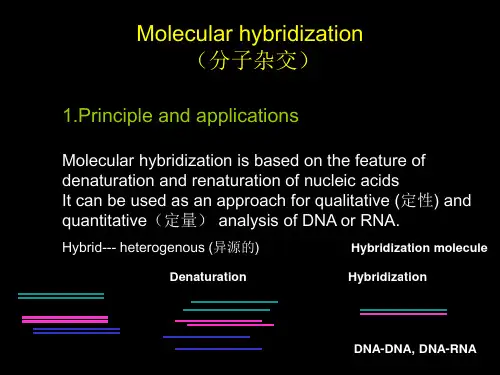
Molecular hybridization 分子杂交
仪器
Dot blot-DNA chip (芯片)
• Development and combination of multiple fields The specific array (阵列)of related genes. e.g.,
Oncogenes (癌基因) Tumor suppressor genes (抑癌基因) thousands,10 thousands of genes
原理 -- 通过杂交检测信息
一组寡核苷酸探针 TACGTTAG ATACGTTA 由杂交位置确定的一组 核酸探针序列 ATACGTTA TACGTTAG ACGTTAGA CGTTAGAT GTTAGATC
杂交探针组
ACGTTAGA
—TATGCAATCTAG
CGTTAGAT GTTAGATC
Aቤተ መጻሕፍቲ ባይዱACGTTAGATC
重组的互补序列
TATGCAATCTAG
靶序列
荧光标记的样品
共聚焦显微镜
基因芯片 获取荧光图象
杂交
探针设计 杂交结果分析
(2)基因芯片制备
• 基因芯片的制备主要有两种基本方法: • 一是在片合成法,
– 在片合成法是基于组合化学的合成原理,它通过一组 定位模板来决定基片表面上不同化学单体的偶联位 点和次序。在片合成法制备DNA芯片的关键是高空 间分辨率的模板定位技术和固相合成化学技术的精 巧结合。
• How a DNA probe bind with an unkown sequence
Base pairing indicates the gene of interest
3. Ways of Molecular Hybridization
核型与带型分析

人染色体光谱核型分析
乳腺癌细胞染色体复杂的畸变
5.分子细胞遗传学与核型分析 5.1 原位杂交(In situ hybridisation)
标记的核酸探针变性后与已变性的 靶核酸在退火温度下复性,在不改变被 分析对象,即维持其原位的前提下对靶 核酸进行分析。
5.2 荧光原位杂交 ( Fluorescent in situ hybridisation ,FISH) 核酸探针用荧光染料标记,荧光信号 通过显微镜观察。 荧光原位杂交,据标记物不同可分为: • 间接法:用生物素或地高辛标记探针, 通过与荧光染料结合的抗生物素或抗 地高辛抗体将信号放大而进行检测。 • 直接法:直接用荧光素标记,如Vysis 公司的FISH探针。
h)高分辨显带(high-resolution banding):
分裂中期一套单倍染色体一般显示320条带。70年代后 期,采用细胞同步化方法和改进的显带技术,获得细 胞分裂前中期、晚前期或早前期的分裂相,可以得到 带纹更多的染色体,能显示550-850条带,甚至2000条
带以上。高分辨显带技术,对染色体的分析达到了亚
pp qq
着丝点横裂
pp p
q
p qq q
ห้องสมุดไป่ตู้
等臂染色体
5 人类染色体的核型分析 染色体分组 A,B,C,D,E,F,G七组 A:1~3;最大,中(1,3号),亚中(2号),1号常 见副缢痕,可鉴别 B:4~5;次大,亚中,难鉴别 C:6~12,X,中等,亚中,9号常见副缢痕,难 鉴别 E:17~18;小,中(16号),亚中(17,18号), 16号可鉴别,17、18难鉴别 F:19~20,次小,中,难鉴别 G:21~22,Y,最小,近端,21,22号有随体,Y 无,难鉴别
DNA重排的检测方法
马欣荣 高方远 康海歧
完整版ppt
1
一、形态学观察 二、细胞遗传学
如:染色体核型分析、染色体显带等 三、分子细胞遗传学
如:荧光原位杂交 四、分子生物学
如: Southern杂交,PCR及相关技术等
完整版ppt
2
一、形态学观察
例子:
• 上个世纪40年代科学家B.McClintock 观察研究玉米籽粒和叶子时发现有颜色 变化。 这种颜色变化是由遗传结构的基 本改变引起的,从而导致转座子的发现。
10、11号染色体易发生 断裂的基因(MLL)位点
完整版ppt
16
小麦-簇毛麦F1 代染色体间易位
染色体涂染显示人染色体组
荧光标记探针
• 不对环境构成污染 • 灵敏度能得到保障 • 可进行多色观察分析,可同时使用多个
探针,缩短因单个探针分开使用导致的 周期过长和技术障碍。
完整版ppt
19
4. 比较基因组杂交
Comparative Genomic Hybridization (CGH)
原理:在荧光原位杂交基础上,结合消减杂 交技术而发展起来的技术,主要用于 肿瘤的检测及其基因组分析
是由Kallioniemi等在1992年首先提出的,是检 测整个肿瘤基因组DNA增加或减少的强有力的 工具
完整版ppt
20
• 肿瘤DNA和对照DNA 在染色体上的相对结 合量取决于两种DNA 标本中相应杂交序列 的多少
完整ห้องสมุดไป่ตู้ppt
4
光谱核型分析原理(Spectral karyotyping, SKY)
1996 年 Schroch等首次描述了SKY技术。 应用5种荧光素同时标记24条人染色体,制成染 色体涂染探针,应用Fourier光谱仪,CC成像 和荧光显微镜进行检测分析,经计算成像处理, 46条染色体形成具有不同颜色的核型影像,可用 以分析各种染色体异常。
核型与带型分析
括号内为结构异常的染色体
重排中用于分开染色体 嵌合体中用于分开不同的细胞系 易位 末端 从....到
4.2 核型描述方法 4.2.1 染色体数目异常的核型描述
首先是书写染色体总数,加一个逗号,接 着写出性染色体的组成,然后写出染色体的异 常。“+”和“-”号当其放在相应的符号之 前,表示增加或丢失了整条染色体;当其放在 相应符号之后,则表示染色体长度的增加或减 少。 例如:47,XX,+21为一个女性先天愚型 的核型,有一条额外的21号染色体; 46,XY,5p-表示一个5号染色体短臂长度 减少的男性核型。
人染色体组型模式图
是鉴别染色体进行配对分类的基木技术,是 在对染色体进行测量计算的基础上, 进行分组、 排队、配对, 并进行形态分析的过程。
2 染色体核型分析的意义: ◆不同物种的染色体都有各自特定的形态结构 (包括染色体的长度、着丝点位置、臂比、随体
大小等)特征,而且这种形态特征是相对稳定的。
因此,染色体核型分析是生物种质资源遗传性研 究的重要内容,在动植物分类和生物进化研究中 也得到广泛的应用;
带(subband)的水平。使我们能够确认那些更为
微小的染色体结构改变了。
i)SCE(sister chromatid exchange)显示方法:
5-BrdU→T
5-BrdU
优缺点:染色体显带技术能够识别不同 的染色体,从染色体水平上了解许多疾病的 遗传变异,但是受到分辨率(超过3Mb的DNA 才会识别)的影响,检测出像染色体微缺失 的综合症的微小染色体变异可能性较小;只 能分析中期分裂相细胞;而且,由于许多肿 瘤是实体,染色体重组非常复杂,无法通过 显带技术得到全部的核型。
1996 年 Schroch等首次描述了SKY技术。应用5 种荧光素同时标记24条人染色体,制成染色体涂染探 针,应用Fourier光谱仪,CC成像和荧光显微镜进行检 测分析,经计算成像处理,46条染色体形成具有不同 颜色的核型影像,可用以分析各种染色体异常。
5免疫荧光技术(修改后)-2解析
生物素 生物素
亲和素
生物素 生物素
亲和素— 生物素在ELISA中使用:
三.ELISA结果的判定
(一)肉眼判定
与阳性、阴性对照颜色比较:
结果判定
1.若待检孔显色浅于阴性对照则判定为阴性;
2.若待检孔显色深于或等于阳性对照孔则判 定为阳性;
3.若待检孔显色介于阴性对照孔和阳性对照 孔之间则判定为弱阳性。
(二)片子的制作:
1.常做切片、涂片、印片,要求薄、 均匀,并与玻片充分固定。固定后不 能被洗脱。
2.注意保持抗原完整性
3.不同材料固定方法不同(无水已醇、 丙醇、聚甲醛等)
(三)荧光抗体染色法
1.直接法
待测标本固定(Ag?)
洗涤,
AgAb
+ Ab
• 快、直接、干扰因素少
• 用于检测抗原
• 每检测一种抗原需标记相应的荧光抗 体,较麻烦
固相载体 聚苯乙烯
Ag 或 Ab 吸 附 到 固 相 载体上的过程,称为 包被
实验中所需酶标抗体的制备方法 同荧光抗体制备:
纯化后的抗体+酶 透析去除游 离酶 测定酶标抗体工作浓度
试验中有关术语及试剂:
包被(coat):将Ag或Ab吸附在固相
载体上的过程,又称固相化或吸附。包被后, 不能被洗脱。包被缓冲液:PH9.6 CB
C.显微镜:普通的光学显微镜。
光路程序:
白炽光源 —— 发射紫外光or兰紫 光 —— 激发滤板 ——紫外光
——被检物(荧光染色标本)——紫 外光+荧光 —— 抑制滤板——荧光 (显微镜下可见)
隔
光 源
热 滤 片
目镜 阻挡滤镜
激 发 滤 载玻片 片
物镜 聚光器
激光共聚焦显微镜的原理与应用范围
激光共聚焦显微镜的原理与应用范围激光扫描共聚焦显微镜是采用激光作为光源,在传统光学显微镜基础上采用共轭聚焦原理和装置,并利用计算机对所观察的对象进行数字图象处理的一套观察、分析和输出系统。
把光学成像的分辨率提高了30%~40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代的研究工具。
1 激光扫描共聚焦显微镜(LSCM)的原理从基本原理上讲,共聚焦显微镜是一种现代化的光学显微镜,它对普通光镜从技术上作了以下几点改进:1.1用激光做光源因为激光的单色性非常好,光源波束的波长相同,从根本上消除了色差。
1.2采用共聚焦技术在物镜的焦平面上放置了一个当中带有小孔的挡板,将焦平面以外的杂散光挡住,消除了球差;并进一步消除了色差1.3采用点扫描技术将样品分解成二维或三维空间上的无数点,用十分细小的激光束(点光源)逐点逐行扫描成像,再通过微机组合成一个整体平面的或立体的像。
而传统的光镜是在场光源下一次成像的,标本上每一点的图像都会受到相邻点的衍射光和散射光的干扰。
这两种图像的清晰度和精密度是无法相比的。
1.4用计算机采集和处理光信号,并利用光电倍增管放大信号图在共聚焦显微镜中,计算机代替了人眼或照相机进行观察、摄像,得到的图像是数字化的,可以在电脑中进行处理,再一次提高图像的清晰度。
而且利用了光电倍增管,可以将很微弱的信号放大,灵敏度大大提高。
由于综合利用了以上技术。
可以说LSCM是显微镜制作技术、光电技术、计算机技术的完美结合,是现代技术发展的必然产物。
2 LSCM在生物医学研究中的应用目前,一台配置完备的LSCM在功能上已经完全能够取代以往的任何一种光学显微镜,它相当于多种制作精良的常用光学显微镜的有机组合,如倒置光学显微镜、紫外线显微镜、荧光显微镜、暗视野显微镜、相差显微镜(PH)、微分干涉差显微镜(DIC)等,因此被称为万能显微镜,通过它所得到的精细图像可使其他的显微镜图像无比逊色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Figure 5._Southern blot analysis of the T-cell receptor -chain gene. Three specimens are shown, each digested with Eco RI, Bam HI, and Hin dIII restriction enzymes, run in agarose gels, transferred to a nylon membrane, and hybridized with a radioactively labeled J probe. Two specimens, one (negative control) in lanes 2, 5, and 8, and the second in lanes 3, 6, and 9, reveal only germline bands and are polyclonal. The third specimen, in lanes 4, 7, and 10, has evidence of gene rearrangement in all 3 lanes and is monoclonal. Lane 1 shows the markers. Lane 11 is a 5% sensitivity control
原理:在荧光原位杂交基础上,结合消减杂 交技术而发展起来的技术,主要用于 肿瘤的检测及其基因组分析
是由Kallioniemi等在1992年首先提出的,是检 测整个肿瘤基因组DNA增加或减少的强有力的 工具
• 肿瘤DNA和对照DNA 在染色体上的相对结 合量取决于两种DNA 标本中相应杂交序列 的多少 • 因此可根据不同荧 光強度的比率而定量 分析肿瘤基因組中 DNA的增加或丟失
人染色体光谱核型分析
乳腺癌细胞染色体复杂的畸变
2.染色体显带技术: • C-banding 主要染异染色质 • R-banding 与C-banding 相反,主要染 常 染色质区域 • G-banding 是Giemsa 染色结果,产生深 浅不同的条带 • Q-banding 是用喹丫因(quinacrine) 染 色得到的荧光条带,带型与G带相似
等比混合
比较基因组杂交原理示意
比较基因组杂交过程
DAPI 4’,6-二联脒-2吲哚苯
FITC 异硫氰酸酯
TRITC 硫氰酸四甲基罗丹明
人染色体不同荧光素染色结果
数 字 化 图 像
FITC/TRITC 荧光强度比率分析图 Ratio image FITC/TRITC
应用: • 主要应用在检测肿瘤细胞的遗传变化 • 物种间染色体同源性比较 优势: • 可快捷检测中期、间期基因组 • 不需预先知道DNA发生改变的部位 • 一次实验即可检出待测样本整个基因 组拷贝数的增减
荧光原位杂交,据标记物不同可分为: • 间接法:用生物素或地高辛标记探针, 通过与荧光染料结合的抗生物素或抗 地高辛抗体将信号放大而进行检测。 • 直接法:直接用荧光素标记,如Vysis 公司的FISH探针。
荧光原位杂交原理示意
荧光原位杂交过程
急性骨髓白血病 10、11号染色体间易位
10、11号染色体易发生 断裂的基因(MLL)位点
G-带 c. 正常染色体 a. 末端缺失 d. 末端倒位 b. 末端单向易位 e. 着丝粒周倒位
G-带显示人急性骨髓白血病异常染色体 9、10、11染色体间易位,右为异常染色体
三、分子细胞遗传学
1. 原位杂交(In situ hybridisation) 标记的核酸探针变性后与已变性的靶核 酸在退火温度下复性,在不改变被分析 对象,即维持其原位的前提下对靶核酸 进行分析。 2. 荧光原位杂交
小麦-簇毛麦F1 代染色体间易位
染色体涂染显示人染色体组
荧光标记探针
• 不对环境构成污染 • 灵敏度能得到保障 • 可进行多色观察分析,可同时使用多个 探针,缩短因单个探针分开使用导致的 周期过长和技术障碍。
4. 比较基因组杂交
Comparative Genomic Hybridization (CGH)
1996 年 Schroch等首次描述了SKY技术。 应用5种荧光素同时标记24条人染色体,制成 染色体涂染探针,应用Fourier光谱仪,CC成 像和荧光显微镜进行检测分析,经计算成像处 理,46条染色体形成具有不同颜色的核型影像, 可用以分析各种染色体异常。
优势: • 特异性和分辨率比传统的显带技术高,它 可以检测到 1.5mb 碱基的转位 • 一次杂交即可分辨人的24条染色体
Fluorescent in situ hybridisation (FISH)
核酸探针用荧光染料标记,荧光信号通 过显微镜观察。
3. 染色体涂染(Chromosome painting)
又称为多重荧光原位杂交(multiplexfluorescence in situ hybridisation, M-FISH) • 可同时检测多个染色体,一次杂交即可检 测人的24条染色体 • 可检测简单及复杂的染色体重排
二、细胞遗传学
染色体核型分析、染色体显带 一个物种的染色体核型及带型是稳定的 1. 染色体核型分析:观察中期染色体,初步 分析染色体有无较大片段的缺失、断裂、 易位、及附加 • 常规核型分析 • 荧光核型分析 • 光谱核型分析(Spectral karyotyping, SKY)
பைடு நூலகம்
光谱核型分析原理(Spectral karyotyping, SKY)
DNA重排的检测方法
马欣荣
高方远
康海歧
一、形态学观察 二、细胞遗传学 如:染色体核型分析、染色体显带等 三、分子细胞遗传学 如:荧光原位杂交 四、分子生物学 如: Southern杂交,PCR及相关技术等
一、形态学观察 例子:
• 上个世纪40年代科学家B.McClintock 观察研究玉米籽粒和叶子时发现有颜色 变化。 这种颜色变化是由遗传结构的基 本改变引起的,从而导致转座子的发现。 • 肿瘤细胞与正常细胞 肿瘤细胞中基因重排现象非常普遍,遗 传结构的改变引起表型的改变。因此从 形态学上可以鉴定肿瘤。
四、分子生物学技术
1. Southern-blotting • 应用于基因重排检测是1981年Korsmeyer等 首先进行的。 • 淋巴瘤DNA重排:将细胞DNA抽提出来,用限 制 性内切酶进行酶切,胚系DNA就会产生特征 性片段。但发生过基因重排的细胞DNA的酶 切位点有所改变,会产生有别于胚系的DNA 酶切片段。转膜后,与标记的DNA探针杂交, 如有一定数量的克隆性增殖的淋巴细胞存 在 (>1 ~ 5% ),克隆性的基因重排条带就 可显示出来。对于正常或多克隆性的淋巴 细胞增生,由于重排片段大小各异而显弥
