蛋白质免疫印迹实验(Western Blot
免疫印迹实验注意事项

免疫印迹实验注意事项一、实验概述免疫印迹(Western blot)是一种重要的蛋白质检测技术,在生物医学研究中被广泛应用。
该实验通过将蛋白质样品经电泳分离,并将其转移到膜上,最终使用特异性抗体探测目标蛋白质。
然而,为了确保实验结果的准确性和可靠性,实验过程中需要注意以下事项。
二、实验仪器和试剂准备在进行免疫印迹实验之前,需要准备合适的仪器和试剂。
以下是一些注意事项:1. 仪器准备•确保电泳仪、转印仪和成像仪等仪器的功能正常,并进行必要的校准和测试。
•清洁仪器,避免污染和干扰实验结果。
2. 试剂准备•使用优质的试剂,并根据说明书正确配制试剂溶液。
•为避免批次差异,建议每次实验使用同一批试剂。
•试剂保存在适当的温度和条件下,以保证其稳定性。
3. 溶液准备•使用无菌、纯净的水和试剂配制实验所需的溶液。
•确保溶液的 pH 值正确,并进行必要的调整。
•溶液保存在适当的温度和条件下,避免污染和变质。
三、实验操作注意事项在进行免疫印迹实验时,需要注意以下操作事项:1. 样品处理•样品的制备和处理应严格按照实验要求进行,以确保样品的完整性和稳定性。
•样品处理过程中应尽量避免使用可能影响蛋白质结构和功能的试剂和条件。
2. 蛋白质的电泳分离•样品电泳前,必须对电泳胶进行适当的处理和准备,确保其质量和性能。
•样品电泳条件的选择要考虑样品性质和目标蛋白质的分子量等因素。
•电泳过程中,要严格控制电流和电压,避免产生异常结果。
3. 转膜过程•使用合适的滤纸和膜材料,并按照正确的方法和条件进行转膜操作。
•转膜时间和电压的选择要根据蛋白质的分子量和转膜效率进行调整。
4. 抗体探测和成像•使用具有较高亲和力和特异性的抗体进行探测,以提高结果的准确性和可靠性。
•抗体的浓度和反应时间应根据需要进行调整,避免产生过度或不足的信号。
•成像过程中,要确保暗室环境的光线充足、胶片或成像仪的参数设置正确。
5. 数据分析和结果解读•在进行数据分析和结果解读时,应使用合适的软件和方法,确保结果的准确性和可靠性。
蛋白质免疫印迹杂交实验 -

蛋白质免疫印迹杂交实验实验目的:1. 了解制备中抗原与抗体杂交显色的原理2. 初步掌握蛋白质印迹杂交实验的操作方法3. 观察和分析着色后的蛋白质的特点和含量实验原理:蛋白质印迹法(Western Blot)是一种蛋白质学中常用的检测方法,是将蛋白质从聚丙烯酰胺凝胶转移到固相载体上,再用探测反应和底物着色,从而检测在所分析的细胞或组织中目的基因表达的蛋白质情况。
大致过程:Western Blot法采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE(聚丙烯酰胺凝胶电泳)分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
实验材料:1.配置SDS-PAGE凝胶相关材料及各种缓冲溶液2.蛋白质样品:可以使用适当的裂解液,裂解细胞获得。
测定每个蛋白质样品浓度?实验步骤:蛋白质印迹法主要分三个阶段进行1、SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)2、电转移,又称为转膜3、酶联免疫显色检测第一阶段:在这个阶段,经过变性处理的蛋白质样品经SDS处理后会带上阴性电荷,在聚丙烯酰胺凝胶中在电场的作用下从阴极向阳极泳动,且分子量越小,泳动速度就越快。
所以在此阶段,根据蛋白的泳动速度可以将样品中的蛋白质根据其分子量的大小进行分离,此阶段分离效果肉眼不可见。
如果想观察蛋白的电泳情况,可以在电泳完成后进行考马斯亮蓝染色进行观察。
第二阶段:即将在凝胶中已经分离的蛋白质条带通过电场的作用转移至硝酸纤维素膜上, 一般选用恒流300 mA,通电90 min即可将凝胶中的用恒流300 mA,通电90 min即可将凝胶中的蛋白条带转移到醋酸纤维素膜载体上。
蛋白质印迹分析(WesternBlotAnalysis)

蛋⽩质印迹分析(WesternBlotAnalysis)【实验⽬的】了解蛋⽩质印迹法的基本原理及其操作和应⽤。
【实验原理】蛋⽩质印迹法⼜称为免疫印迹法,这是⼀种可以检测固定在固相载体上蛋⽩质的免疫化学技术⽅法。
待测蛋⽩既可以是粗提物也可以经过⼀定的分离和纯化,另外这项技术的应⽤需要利⽤待测蛋⽩的单克隆或多克隆抗体进⾏识别。
如图所⽰,可溶性抗原,也就是待测蛋⽩⾸先要根据其性质,如分⼦量,分⼦⼤⼩,电荷以及其等电点等采⽤不同的电泳⽅法进⾏分离;通过电流将凝胶中的蛋⽩质转移到聚偏⼆氟⼄烯膜上;利⽤抗体(⼀抗)与抗原发⽣特异性结合的原理,以抗体作为探针钓取⽬的蛋⽩。
值得注意的是在加⼊⼀抗前应⾸先加⼊⾮特异性蛋⽩,如⽜⾎清⽩蛋⽩对膜进⾏“封阻”⽽防⽌抗体与膜的⾮特异性结合。
经电泳分离后的蛋⽩往往需再利⽤电泳⽅法将蛋⽩质转移到固相载体上,我们把这个过程称为电泳印迹。
常⽤的两种电转移⽅法分别为:1.半⼲法: 凝胶和固相载体被夹在⽤缓冲溶液浸湿的滤纸之间,通电时间为10分钟~30分钟。
2.湿法:凝胶和固相载体夹⼼浸放在转移缓冲溶液中,转移时间可从45分钟延长到过夜进⾏。
由于湿法的使⽤弹性更⼤并且没有明显浪费更多的时间和原料,因此我们在这⾥只描述湿法的基本操作过程。
对于⽬的蛋⽩的识别需要采⽤能够识别⼀抗的第⼆抗体。
该抗体往往是购买的成品,已经被结合或标记了特定的试剂,如辣根过氧化物酶。
这种标记是利⽤辣根过氧化物酶所催化的⼀个⽐⾊反应,该反应的产物有特定的颜⾊且固定在固相载体上,容易鉴别。
因此可通过对⼆抗的识别⽽识别⼀抗,进⽽判断出⽬标蛋⽩所在的位置。
其他的识别系统包括碱性磷酸酶系统和125I标记系统。
蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项

蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项1.收集蛋白样品(Protein sample preparation)可以使用适当的裂解液。
收集完蛋白样品后,为确保每个蛋白样品的上样量一致,需要测定每个蛋白样品的蛋白浓度。
根据所使用的裂解液的不同,需要采用适当的蛋白浓度测定方法。
因为不同的蛋白浓度测定方法对于一些去垢剂和还原剂等的兼容性差别很大。
BCA法。
2. 电泳(Electrophoresis)(1) SDS-PAGE凝胶配制(2) 样品处理在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
100℃或沸水浴加热3-5分钟,以充分变性蛋白(根据蛋白分子的大小,煮沸时间可适当变化,一般不低于5min。
煮沸只是变性蛋白,而不是分解,一般加了抑制酶不会分解。
煮沸对于SDS-PAGE凝胶电泳是必须的,只有煮沸,才能消除蛋白质的立体二级结构,伸展为一维线性结构,所以一般来讲二聚体都会解体,才能完全按照分子量跑电泳,加的蛋白Marker才有指示分子量的意义。
蛋白样品变性后与SDS充分结合,SDS使每个氨基酸带相同的电荷,使整个蛋白呈线性结构. 抗体因为要是线性表位结合的,100度煮10min 后13000,离心5分钟,取上清电泳,因为沉淀会导致拖尾.也可以取上清到另一管,4度可以放一周备再次电泳)。
(3)电泳i.清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
ii.灌胶与上样(1)玻璃板对齐后放入夹中卡紧。
然后垂直卡在架子上准备灌胶。
(操作时要使两玻璃对齐,以免漏胶。
)(2)配10%分离胶,加入TEMED后立即摇匀即可灌胶。
灌胶时,可用10 ml枪吸取5 ml胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
Western blot实验步骤

1.9/ 4× 分 离 胶 缓 冲 液 3.61 (mL) 10% 过硫酸氨( L ) 112/
168
TEMED(L) 分离范围(kDa)
5.0/7.5 36-150
3.7/5.5 5 1.9/ 3.61 112/ 168 5.0/7.5
SDS-PAGE 蛋白电泳试剂
1. 丙烯酰胺和甲叉双丙烯酰胺单体溶液(Acr和Bis):
丙烯酰胺30g ,甲叉双丙烯酰胺0.8g,加水100ml ,滤 纸过滤后储存于棕色瓶中,4℃避光保存,pH不得超过 7.0。(光催化或碱催化其发生脱氨基反应)
• 2. 4x分离胶缓冲液 :Tris 18.17g, 10% SDS 4ml, HCl调pH至8.8, 定容到100ml。
• 7.染色液:称取考马斯亮蓝R-250 2.5g,加入
甲醇450ml,冰乙酸100ml、水650ml。
• 8.脱色液 :甲醇100ml,冰乙酸700ml,加水 830ml。 • 9.十二烷基硫酸钠(SDS)溶液:10%(w/v) 1g SDS,10ml去离子水配制,室温保存。
SDS-PAGE 电泳采用 Tris- 甘氨酸系统,即按分子克隆 中Sambrook等的方法(Sambrook, 1989)进行
• PVDF膜( 聚偏二氟乙烯,polyvinylidene fluoride)的预处理 : 在甲醇浸泡10秒湿润膜,转移缓冲液浸泡10-15 分钟,除去甲醇。PVDF是疏水性的,在转膜缓冲 液里很难浸透,甲醇处理后使更容易浸润,且甲 醇处理活化PVDF膜上面的正电基团,使它更容易 跟带负电的蛋白质结合; • PVDF膜是一种高强度、耐腐蚀的物质,PVDF膜 可以结合蛋白质,而且可以结合小片段的蛋白质, 最初是将它用于蛋白质的序列测定,虽然PDVF膜 结合蛋白的效率没有硝酸纤维素膜高,但由于它 的稳定、耐腐蚀使它成为蛋白测序理想的用品;
蛋白质免疫印迹Western Blot

Western Blot实验方法原理Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测的方法。
对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。
与Southern或Northern杂交方法类似,但Western Blot 采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
实验步骤一、试剂准备1. SDS-PAGE试剂:见聚丙烯酰胺凝胶电泳实验。
2. 匀浆缓冲液:1.0 M Tris-HCl(pH 6.8) 1.0 ml;10%SDS 6.0 ml;β-巯基乙醇0.2 ml;ddH2O 2.8 ml。
3. 转膜缓冲液:甘氨酸2.9 g;Tris 5.8 g;SDS 0.37 g;甲醇200 ml;加ddH2O定容至1000 ml。
4. 0.01 M PBS(pH7.4):NaCl 8.0 g;KCl 0.2 g;Na2HPO4 1.44 g;KH2PO40.24 g;加ddH2O至1000 ml。
5. 膜染色液:考马斯亮兰0.2 g;甲醇80 ml;乙酸2 ml;ddH2O118 ml。
包被液(5%脱脂奶粉,现配):脱脂奶粉1.0 g 溶于20 ml的0.01 M PBS中。
6. 显色液:DAB 6.0 mg;0.01 M PBS 10.0 ml;硫酸镍胺0.1 ml;H202 1.0 μl。
二、蛋白样品制备1. 单层贴壁细胞总蛋白的提取(1)倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
WesternBlot蛋白免疫印迹法

3 Western blot3.1试剂配制1)30%聚丙烯酰胺储备液(Acr/Bis):丙烯酰胺(Acr), 29g;N,N-亚甲基双丙烯酰胺(Bis), 1g,去离子水溶解,37℃ 水浴助溶,定容至100mL。
0.45M m滤器过滤,棕色瓶4℃避光保存。
2)10%十二烷基硫酸钠(5口5):SDS,10g;H2O,80mL。
68℃加热溶解,浓HCl 调pH 至7.2,定容至100mL,室温保存。
3)10%过硫酸铵(AP):AP,1g;H2O,10mL。
避光,4℃保存。
(4℃2 周)4)分离胶缓冲液(1.5MTris-HCl pH8.8):Tris,18.17g;H2O 80mL。
用浓HCl 调pH 至8.8,定容至100mL,4℃保存。
5)浓缩胶缓冲液(1.0MTris-HCl pH6.8):Tris,12.11g;H2O 80mL。
用浓HCl 调pH 至 6.8,定容至100mL,4℃保存。
6)电泳缓冲液(10X):甘氨酸(Glycine),188g;Tris 30.2g;SDS,10g;H2O, 800mL。
调节pH 至8.3, 定容至1L,4℃保存(用时稀释为1义)。
7)5X SDS-PAGEloadingBuffer (5mL):1MTris-HCl(pH6.8),1.25mL;SDS,0.5g;澳酚蓝(BPB),25mg;甘油,2.5mL;加去离子水定容至5mL。
充分混匀,分装成500M L/份,室温保存。
使用前每份加入25M L p -巯基乙醇(2-ME),加入2-ME的loading buffer可在室温下保存一个月左右。
8)考马斯亮蓝染色固定液:40%双蒸水,10%醋酸,50%甲醇,室温保存9)考马斯亮蓝染色液:考马斯亮蓝R-250,250mg;甲醇,45ml;冰醋酸,10ml;H2O,定容至100ml。
室温保存。
10)考马斯亮蓝染色脱色液:醋酸,100ml;乙醇,50ml;dH2O 850ml,充分混合,室温保存11)膜转移缓冲液:甘氨酸,2.9g;Tris,5.8g;SDS,0.37g;力口H2O 600mL 充分溶解,加200mL 甲醇,混匀,定容至1匕,室温保存。
蛋白质免疫印迹实验
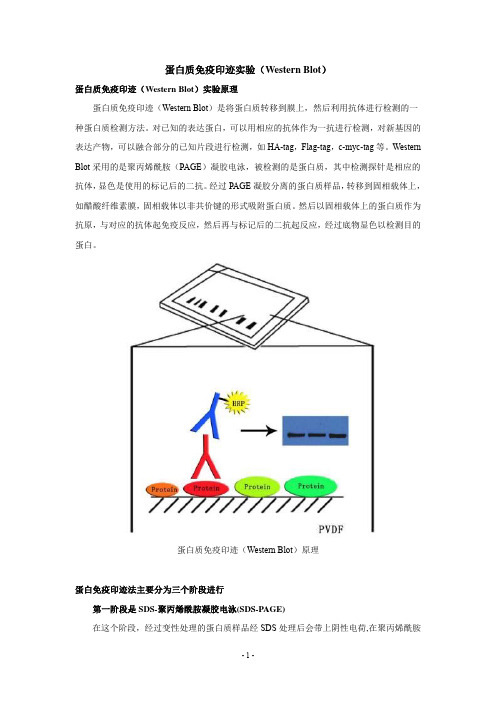
蛋白质免疫印迹实验(Western Blot)蛋白质免疫印迹(Western Blot)实验原理蛋白质免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测的一种蛋白质检测方法。
对已知的表达蛋白,可以用相应的抗体作为一抗进行检测,对新基因的表达产物,可以融合部分的已知片段进行检测,如HA-tag,Flag-tag,c-myc-tag等。
Western Blot采用的是聚丙烯酰胺(PAGE)凝胶电泳,被检测的是蛋白质,其中检测探针是相应的抗体,显色是使用的标记后的二抗。
经过PAGE凝胶分离的蛋白质样品,转移到固相载体上,如醋酸纤维素膜,固相载体以非共价键的形式吸附蛋白质。
然后以固相载体上的蛋白质作为抗原,与对应的抗体起免疫反应,然后再与标记后的二抗起反应,经过底物显色以检测目的蛋白。
蛋白质免疫印迹(Western Blot)原理蛋白免疫印迹法主要分为三个阶段进行第一阶段是SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)在这个阶段,经过变性处理的蛋白质样品经SDS处理后会带上阴性电荷,在聚丙烯酰胺凝胶中在电场的作用下从阴极向阳极泳动,且分子量越小,泳动速度就越快。
所以在此阶段,根据蛋白的泳动速度可以将样品中的蛋白质根据其分子量的大小进行分离,此阶段分离效果肉眼不可见。
如果想观察蛋白的电泳情况,可以在电泳完成后进行考马斯亮蓝染色进行观察;第二阶段为电转移,又称为转膜。
即将在凝胶中已经分离的蛋白质条带通过电场的作用转移至硝酸纤维素膜上, 一般选用恒流300 mA,通电90 min即可将凝胶中的蛋白条带转移到醋酸纤维素膜载体上。
转移到载体上的蛋白条带也是肉眼不可见的,如果想观察转移的效果,可以在转移后对载体进行丽春红染液染色。
第三阶段为酶联免疫显色检测将印有蛋白质条带的硝酸纤维素膜(相当于包被了抗原的固相载体)依次与特异性抗体和酶标第二抗体作用后,加入能形成不溶性显色物的酶反应底物,使目的条带蛋白显色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二试剂和器材
1.试剂
PBS: NaCl 8g,KCl 0.2g,Na2HPO4 1.44g,KH2PO4 0.24g 加双蒸水800ml,用HCl调pH到pH7.4,再加水到1000ml, 分装后,15磅20分钟灭菌。 4-氯萘酚显色液:用30mg 4-氯萘酚(简称4-CN)溶 于1ml无水乙醇中制成母液。将50μ14-CN对母液和 5μ130%的H2O2加入到5ml 0.05M/L Tris-Cl(pH7.6)中。 氨基黑染色液:0.1%氨基黑10-B、45%甲醇、10%冰 乙酸 氨基黑脱色液:90%甲醇、2%冰乙酸、8%水
三 操作步骤
2显色反应 首先进行分子量标记的氨基黑染色。切 下转有分子量标记的硝酸纤维素薄膜, 用含有0.3%吐温20的PBS缓冲液漂洗三 次后(每次15分钟),再将其浸入氨基 黑染液中,室温染色5分钟,然后置于 氨基黑脱色液中脱去背景,水中漂洗后 景干备用。
三 操作步骤
转有样品的硝酸纤维素薄膜用含有5%脱脂牛奶的PBS 缓冲液在室温下封闭2小时,同时1:100加入兔抗GST 第一抗体,平缓摇动,室温保温1小时。然后用PBS缓 冲液将硝酸纤维素薄膜漂洗4次,每次 30分钟。将辣 根过氧分物酶标记的羊抗兔免疫球蛋白第二抗 体用封 闭液稀释50倍后,加入吐温20至终浓度为0.05%,然 后与上述漂洗的硝酸纤维素薄膜进行反应,将膜浸于 其中,平放在平缓摇动的摇床平台上,室温温育 1小 时后,用PBS缓冲液将硝酸纤维素薄膜漂洗4次,每次 5 分 钟 , 再 加 入 4- 氯 萘 酚 显 色 液 , 加 入 5μ1 的 30%H2O2,将硝酸纤维素薄膜置于其中缓慢摇动,待 所检测的蛋白带显色达到最深程度后,将硝酸纤维素 薄膜转入 PBS 溶液中停止显色反应。取出硝酸纤维素 薄膜,自然晾干后拍照保存结果。
二试剂和器材
2.器材 电转移仪器 恒温摇床 硝酸纤维素薄膜 Whatman 3MM滤纸 电泳仪 裁纸刀 φ25cm培养皿
玻璃棒
三 操作步骤
1蛋白质电转移 戴上手套,取下SDS-PAGE凝胶,小心剥离凝胶。裁剪与凝胶同样大的 硝酸纤维素薄膜和六层Whatman 3MM滤纸,在硝酸纤维素薄膜左下角 剪去一角作为标记。将硝酸纤维素薄膜漂浮于去离子水的表面,使水从 膜的下部浸透以去除其间气泡,将Whatman 3MM滤纸在电转移缓冲液 中浸湿,用蒸馏水淋洗石墨电极,先将三层浸湿的滤纸放在阳极上,在 滤纸表面滚动玻璃棒以除去其间的气泡,再将浸湿的硝酸纤维素薄膜小 心平铺在滤纸上,用玻璃棒小心去除气泡。随后将12%SDS-PAGE凝胶 舒展平铺在硝酸纤维素薄膜上,用玻璃棒小心去除气泡,再将三层浸湿 的滤纸平铺在凝胶上,沁心去除气泡,最后加上石墨电极板,接通电源 进行电转移,电流的大小由凝胶的大小决定,为0.65mA/平方厘米。电 转移2小时后,停止通电,卸掉电转移装置,取下凝胶进行考马斯亮兰 染色,以检测电转移是否完全。小心取下硝酸纤维素薄膜,放在一张干 滤纸上,吸干30-60分钟后,开始进显色反应。
其定量关系符合以下公式: Ve=Vo+KV1 Ve:某一溶质的洗脱体积 Vo:层析柱的外水体积 Vi:层析柱的内水体积 K:某一溶质的分配系数
二试剂和器材
1.试剂
电转移缓冲液 pH8.3 39mM甘氨酸 4.8mM Tris碱 0.037% SDS 20% 甲醇 混合2.9克甘氨酸,5.8克Tris,0.37克SDS,加200ml甲醇, 定容到1000ml. 封闭缓冲液:5%(W/V)脱脂奶粉溶于PBS中
蛋白质免疫印迹实验
(Western Blotting)
一 实验原理
Western Blotting 是用来检测蛋白质的一种技术。 首先将含有待测蛋白的蛋白质混合物进行凝胶电泳分离, 然后将已经分离的蛋白质通过电泳技术从凝胶转移到固 体支持物上,这一固体支持物目前常为硝酸纤维素薄膜。 随后以待测蛋白质上抗原决定簇特异性的抗体(称为第 一抗体)为探针,与固体支持物上的蛋白质进行免疫反 应,最后用偶联有辣根过氧化物酶或碱性磷酸酯酶的抗 第一抗体的抗体(第二抗体)与第一抗体进行免疫反应, 只有与第一抗体特异性结合的待测蛋白才能与第二抗体 发生免疫反应。在有辣根过氧化物酶的底物用显色剂存 在时就会出现颜色反应,结合有第一抗体、第二抗体的 待测蛋白,通过颜色反应即能显现出来。
一 实验原理
电泳将蛋白质从凝胶转移到固体支持物 上是通过电转移仪器完成的。它是将固 体支持物面对阳极、凝胶面对阴极,二 者结合在一起,然后将外面二侧用 Whatman 3MM滤纸结合,形成“三明治” 结构,放入电转移仪器上,加入电泳缓 冲液,通上电源后,蛋白质即可从凝胶 上转移到固
1. 为什么裁剪的滤纸必须与凝胶大小 完全一致?若不是这样结果会怎样? 2. 电转移时为什么都必须带手套小心 操作并除去气泡, 否则结果会怎样? 在进色后应时应注意哪些问题? 请简述免疫印迹实验的原理,并将之与 免疫学相关概念联系起来。
