免疫印迹介绍及实验过程
实验报告三--免疫印迹

实验三:免疫印迹1 原理免疫印迹又称Western印迹(Western blotting),与DNA的Southern印迹技术相对应,两种技术均把电泳分离的组分从凝胶转移至一种固相载体(通常为NC膜),然后用探针检测特异性组分。
不同的是,Western blotting所检测的是抗原类蛋白质成分,所用的探针是抗体,它与附着于固相载体的靶蛋白所呈现的抗原表位发生特异性反应。
该技术结合了凝胶电泳分辨力高和固相免疫测定特异敏感等诸多优点,具有从复杂混合物中对特定抗原进行鉴别和定量检测,以及从多克隆抗体中检测出单克隆抗体的优越性。
该技术的灵敏度能达到标准的固相放射免疫分析的水平而无需对靶蛋白进行放射性标记。
目前,Western blotting广泛用于蛋白质研究、基础研究和临床医学的研究。
免疫印迹可分成两个步骤:蛋白质由凝胶转移至固相基质;特异性抗体检测。
蛋白质转移通常由电泳实现,现常用的方法有二:1 半干法:将凝胶和固相基质似三明治样夹在缓冲液湿润的滤纸中间,通电10-30分钟可完成转移;2 湿法:将凝胶和固相基质夹在滤纸中间,浸在转移装置的缓冲液中,通电45分钟或过夜课完成转移。
本试验采用湿法转移。
免疫印迹用膜通常有硝酸纤维素膜和尼龙膜两种。
大多数应用前者。
本实验也用硝酸纤维素膜进行转移。
转移结束后,蛋白质的检测可分成三个步骤进行:首先,将膜同特异性抗体孵育数小时或过夜,然后将膜同可特异性识别上述抗体(一抗)的第二抗体(二抗)孵育,通常二抗连接有如辣根过氧化物酶等标记物。
目的蛋白可由该酶催化的显色反应在膜上形成有色产物加以检测。
本实验用的是酶标抗IgG,故不加一抗。
2 试剂与仪器2.1 试剂(所有试剂均供两组用)2.1.1 转移缓冲液Tris 3.025g甘氨酸14.413g甲醇20mL加蒸馏水约800mL,调pH至8.3,定容1000mL2.1.2 Tris缓冲盐溶液(TBS)Tris 2.42gNaCl 27.750g加蒸馏水约800mL,调pH至7.5,定容1000mL2.1.3 TTBSTBS 800mLTween-20 400μl2.1.4 封闭液及抗体稀释液脱脂奶粉0.3gTBS 100mL2.1.5 底物溶液二氨基联苯胺(DAB) 5.0mgTBS 18mLH2O220μl 临用前配2.1.6 丽春红总蛋白质染色液丽春红1g4%乙酸100mL2.1.7 5%小牛血清生理盐水小牛血清7.5mL0.85%生理盐水定容至150mL2.1.8 酶标抗IgG(1:1500)酶标抗IgG 0.1mL5%小牛血清生理盐水定容至150mL2.2 仪器夹心式电泳槽,电泳仪,硝酸纤维素膜,直径9cm培养皿,剪刀,镊子,刀片,微量移液枪,普通滤纸3 试验步骤3.1 SDS-PAGE电泳分离所需试剂、仪器以及分离步骤完全与实验六相同,故此处从略。
immunoblotting免疫印迹法

immunoblotting免疫印迹法免疫印迹法(Immunoblotting)免疫印迹法是一种常用的实验技术,用于检测和分析蛋白质的存在与表达水平。
它结合了免疫学和电泳技术,能够帮助研究者确定特定蛋白质的分子量、定量和免疫反应性。
本文将对免疫印迹法的原理、操作流程和应用范围进行探讨。
一、免疫印迹法的原理免疫印迹法的原理基于抗原抗体反应。
首先,待检样品经过电泳分离,然后将蛋白质从凝胶转移到聚丙烯酰胺膜上。
接着,利用一系列步骤将目标蛋白质与特异性的一抗和二抗结合,形成特异性的免疫复合物。
最后,通过酶促发色反应,将免疫复合物标记出来,产生相应的信号。
二、免疫印迹法的操作流程1. 样品制备:待检样品应首先经过蛋白提取、浓缩和纯化处理,以保证分析的准确性。
其中关键的步骤是蛋白质的电泳分离,常用的方法有SDS-PAGE和聚丙烯酰胺凝胶电泳。
2. 转印:将分离的蛋白质从凝胶转移到聚丙烯酰胺膜上,常用的方法有湿式和半湿式转印。
湿式转印适用于小分子量蛋白质,而半湿式转印适用于大分子量蛋白质。
3. 阻断:将转印膜放入含有蛋白质的阻断缓冲液中,防止非特异性结合。
通常使用的阻断缓冲液有牛奶粉、鸡蛋清或BSA。
4. 孵育:将特异性一抗加入阻断缓冲液中,与目标蛋白质发生特异性结合。
一抗的选择应该根据具体的研究目的来确定。
5. 洗涤:将转印膜反复洗涤以去除非特异性结合的抗体和杂质。
洗涤缓冲液的选择应该根据一抗的种类来确定。
6. 结合:加入特异性的二抗,与一抗结合形成免疫复合物。
二抗通常是由小鼠或兔子制备的抗小鼠或反兔子的抗体。
7. 洗涤:再次洗涤以去除未结合的二抗和杂质。
8. 检测:利用酶标技术将免疫复合物标记出来。
常用的酶标方法有辣根过氧化物酶和碱性磷酸酶。
酶标反应产生的信号可以使用荧光、发光或显色来检测。
9. 分析:通过分析免疫印迹结果,可以确定目标蛋白质的存在与表达水平。
常用的分析方法有荧光成像、蛋白质印迹仪和密度分析软件。
免疫印迹步骤
2.6 免疫印迹(Western blot)(1)裂解细胞,提取细胞总蛋白:收集细胞(约2×106),离心洗涤2次,加入100µL RIPA裂解液,置冰上反应30min,4℃12,000r/min离心15min,取上清,蛋白定量后分装,-80℃冻存备用;(2)蛋白定量:Bradford法测定蛋白质含量[35]:①分别在微量离心管中各加入0.5mg/mL BSA 5µL、10µL、15µL及20µL,以0.15mmol/L的NaCl补足至100µL,同时以两管100µL的0.15mmol/L的NaCl作空白对照。
②每管各加入900μL考马斯亮蓝G-250溶液,振荡混匀,室温放置2min。
③用1cm光径的微量比色杯测A595吸光值,取A595吸光值对标准蛋白浓度作图,画出标准曲线,并测量待测样品的A595吸光值,从BSA标准曲线中确定待测样品的浓度。
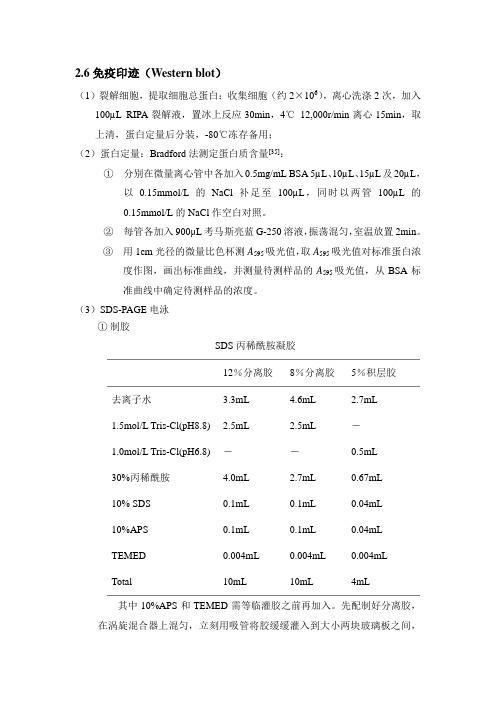
(3)SDS-PAGE电泳①制胶SDS丙稀酰胺凝胶12%分离胶8%分离胶5%积层胶去离子水 3.3mL 4.6mL 2.7mL1.5mol/L Tris-Cl(pH8.8)2.5mL 2.5mL -1.0mol/L Tris-Cl(pH6.8) --0.5mL30%丙稀酰胺 4.0mL 2.7mL 0.67mL10% SDS 0.1mL 0.1mL 0.04mL10%APS 0.1mL 0.1mL 0.04mLTEMED 0.004mL 0.004mL 0.004mLTotal 10mL 10mL 4mL其中10%APS和TEMED需等临灌胶之前再加入。
先配制好分离胶,在涡旋混合器上混匀,立刻用吸管将胶缓缓灌入到大小两块玻璃板之间,至胶的最上缘距玻璃板顶端3cm左右。
再用去离子水覆盖在分离胶的上层,封闭空气使胶易于凝固。
室温静置1h左右可看到去离子水和胶之间由于折射率不同而出现一条界限,说明胶已经凝好,可用注射器小心吸出上层的去离子水。
免疫印迹技术原理

免疫印迹技术原理
免疫印迹技术(Western blot)是一种常用的蛋白质检测方法,它可以检测特定蛋白质在样品中的存在和表达水平。
该技术的原理是利用抗体与特定蛋白质结合的特异性,将蛋白质从复杂的混合物中分离出来,并通过电泳将其分离成不同大小的蛋白质片段,最后通过蛋白印迹技术检测目标蛋白质。
免疫印迹技术的步骤包括:蛋白质样品的制备、SDS-PAGE电泳分离、转膜、阻断、一抗结合、二抗结合和检测。
首先,需要将蛋白质样品进行制备,通常是将细胞或组织裂解并提取蛋白质。
然后,将蛋白质样品加入SDS-PAGE凝胶中进行电泳分离,根据蛋白质的大小将其分离成不同的片段。
接着,将分离后的蛋白质转移到聚丙烯酰胺凝胶(PVDF)或硝酸纤维素膜上,形成蛋白质印迹。
为了防止非特异性结合,需要用牛血清白蛋白或非脂类奶粉等物质进行阻断。
然后,加入一抗,即特异性抗体,与目标蛋白质结合。
接着,加入二抗,即与一抗结合的酶标记抗体,使其与一抗结合的蛋白质形成复合物。
最后,通过酶标记物的反应,检测目标蛋白质的存在和表达水平。
免疫印迹技术具有高灵敏度、高特异性和广泛的应用范围。
它可以用于检测蛋白质的表达水平、鉴定蛋白质的分子量、检测蛋白质的修饰状态等。
在生物医学研究中,免疫印迹技术被广泛应用于疾病诊断、药物研发、基因表达分析等领域。
免疫印迹技术是一种重要的蛋白质检测方法,其原理是利用抗体与特定蛋白质结合的特异性,将蛋白质从复杂的混合物中分离出来,并通过电泳将其分离成不同大小的蛋白质片段,最后通过蛋白印迹技术检测目标蛋白质。
免疫印迹(WB)实验操作具体步骤及详细说明

免疫印迹(WB)实验操作具体步骤及详细说明免疫印迹(WB)实验操作具体步骤及详细说明一、试剂和溶液转印缓冲液:0.025M Tris base , 0.187 M 甘氨酸, 25%甲醇氨基黑溶液:0.1% 酸性黑10B 1×TBST:25mM Tris-HCl ( pH 8.0 ) , 0.2 M NaCl , 0.1%Tween 20 封闭液:TBST 配制的5%牛奶抗体稀释液:TBST 配制的5%牛奶显色系统:ECL 显色二、实验步骤1.电泳:将裂解液进行SDS-PAGE 电泳,80v,30 分钟,120v,90 分钟;2.转膜:PVDF 膜在甲醇中浸泡约30 秒左右,滤纸浸泡在转印缓冲液预湿,半干法转印到PVDF 膜上,10v,150 分钟;3.染色:氨基黑染色5 分钟,甲醇褪去背景色,观察条带;4.膜活化:将PVDF 膜置于甲醇活化1min,用纯水洗膜2 次后再用TBST 洗涤3 次;5.封闭:将膜条置于5%牛奶或2% BSA 中,室温混摇2h;6.一抗孵育:将待检抗体用3%牛奶或2% BSA 稀释到合适浓度(参照抗体说明书,根据客户预实验结果,稀释度上下浮动一个数量级都为正常),将膜放入对应的已稀释待检样品中,置4℃混摇孵育过夜;7.洗涤:取出膜放在TBST 中洗涤3×5min;8.二抗孵育:将膜取出放入稀释好的HRP 标记的二抗(参照二抗说明书进行稀释)中,室温混摇2h;9.洗涤:取出膜放在TBST 中洗涤3×5min;10.ECL 显色:将膜取出放入混匀的ECL 显色液中,孵育3min,将膜取出贴在有荧光角标的胶片上,迅速用保鲜膜包好;11.曝光:把底片放在暗盒中,根据荧光强度分别对X 光胶片作不同时间段的曝光,曝光结束后,将底片取出,1min 显影,30s 清洗,1min 定影,30s 清洗,晾干;12.结果分析:用扫描仪将曝光后的X 光胶片扫描,做后续结果分析。
免疫印迹(immunoblotting)

免疫印迹(immunoblotting)免疫印迹(immunoblotting)又称蛋白质印迹(Western blotting),是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。
该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种新的免疫生化技术。
由于免疫印迹具有SDS-PAGE 的高分辨力和固相免疫测定的高特异性和敏感性,现已成为蛋白分析的一种常规技术。
免疫印迹常用于鉴定某种蛋白,并能对蛋白进行定性和半定量分析。
主要实验步骤如下:1.蛋白质抽提a.实验对象为组织样品,取适量(250~500mg)新鲜组织样品或正确保存的组织样品,加1ml含蛋白酶抑制剂的总蛋白抽提试剂(或核蛋白抽提试剂),匀浆后抽提总蛋白(或核蛋白)。
b.实验对象为细胞样品,每份样品取1×106~1×107细胞,PBS清洗细胞,去PBS加0.1ml~1ml含蛋白酶抑制剂的总蛋白抽提试剂(或核蛋白抽提试剂)抽提总蛋白(或核蛋白)。
2.蛋白质定量:按KCTMBCA蛋白质定量试剂盒操作说明操作,测定样品浓度。
3.变性聚丙烯酰胺不连续凝胶电泳(SDS-PAGE)将准备好的样品液和生物素标记的蛋白质分子量标准分别上样,标准加进第一个孔中,电泳分离蛋白。
4.蛋白质转移到硝酸纤维膜或PVDF膜按Bio-Rad蛋白转移装置说明组装滤纸凝胶纤维素夹层,30mA恒流条件下,4°C转移过夜。
5.膜的封闭和抗体孵育a.膜在5%BSA溶液中室温孵育1小时以封闭膜上的非特异结合。
b.封闭过的膜加入一级抗体室温孵育1.5小时,抗原抗体结合。
c.加入HRP标记的二级抗体以结合一级抗体及HRP标记的抗生物素抗体以结合分子量标准,室温孵育膜1小时。
加入HRP标记的GAPDH抗体可同时检测GAPDH含量。
6.结果检测:化学发光法检测,膜与化学发光底物孵育,经X胶片曝光显影。
图片扫描保存为电脑文件,并用ImageJ分析软件将图片上每个特异条带灰度值的数字化。
免疫印迹实验操作具体步骤及详细说明

免疫印迹实验操作具体步骤及详细说明免疫印迹(Western Blotting,简称WB)是一种常用的分子生物学技术,主要用于检测和鉴定蛋白质的存在以及其在不同样本中的表达水平。
下面将详细介绍WB实验的具体步骤。
1.细胞裂解和蛋白质提取:首先将待检测的组织样本或细胞样本通过离心将其收集,并添加适量的裂解缓冲液。
使用超声波或机械破碎手段将细胞打乱,使蛋白质溶解在裂解缓冲液中。
再通过离心去除细胞碎片和细胞核等。
2.蛋白质浓度测定:根据实验需要,采用BCA法、Lowry法或Bradford法等方法测定蛋白质浓度,以确定后续实验的载体中待加载的蛋白质量。
3.蛋白质电泳:将相同量的蛋白质样品加入SDS-凝胶槽中,进行电泳。
电泳时蛋白质在凝胶中向阴极迁移,分子量小的蛋白质迁移速度较快,分子量大的较慢。
电泳结束后,将凝胶转移到膜上。
4.膜上瞬时染色:在转移至膜上后,可以使用Ponceau S染色或其他瞬时染色方法,以确认蛋白质在膜上的存在和转移效果。
5.阻断:在膜上的蛋白质检测之前,需要对膜进行阻断处理,以防止非特异性结合。
常用的方法是在膜上加入牛血清蛋白或脱脂奶粉的溶液,进行阻断。
6.一抗反应:加入已稀释好的一抗抗体,与目标蛋白质特异性结合。
一抗的选择要根据待检测蛋白的特异性来确定。
7.清洗:一抗反应后,用TBST或PBS等缓冲液进行多次清洗,以去除未结合的一抗抗体。
8.二抗反应:9.清洗:二抗反应后,用TBST或PBS等缓冲液进行多次清洗,以去除未结合的二抗抗体。
10.显色和成像:使用显色剂(如ECL)使膜上的蛋白质发生化学发光反应,然后将膜放入X射线片中,进行曝光。
最后使用化学显影废片机或Gel Doc System等设备进行成像。
11.数据分析:使用专业的成像软件分析成像结果,计算蛋白质的相对表达水平,并与内参蛋白进行比较。
需要注意的是,在进行WB实验的过程中,要严格操作,避免污染和交叉反应的出现。
同时,应根据实验需求选择适当的试剂和抗体,并进行标记、保存和储存等操作。
实验七蛋白质免疫印迹实验WesternBlotting

一 实验原理
电泳将蛋白质从凝胶转移到固体支持物 上是通过电转移仪器完成的。它是将固 体支持物面对阳极、凝胶面对阴极,二 者结合在一起,然后将外面二侧用 Whatman 3MM滤纸结合,形成“三明治” 结构,放入电转移仪器上,加入电泳缓 冲液,通上电源后,蛋白质即可从凝胶 上转移到固体支持物上。
一 实验原理
二试剂和 NaCl 8g,KCl 0.2g,Na2HPO4 1.44g,KH2PO4 0.24g 加双蒸水800ml,用HCl调pH到pH7.4,再加水到1000ml, 分装后,15磅20分钟灭菌。 4-氯萘酚显色液:用30mg 4-氯萘酚(简称4-CN)溶 于1ml无水乙醇中制成母液。将50μ14-CN对母液和 5μ130%的H2O2加入到5ml 0.05M/L Tris-Cl(pH7.6)中。 氨基黑染色液:0.1%氨基黑10-B、45%甲醇、10%冰 乙酸 氨基黑脱色液:90%甲醇、2%冰乙酸、8%水
二试剂和器材
2.器材 电转移仪器 恒温摇床 硝酸纤维素薄膜 Whatman 3MM滤纸 电泳仪 裁纸刀 φ25cm培养皿
玻璃棒
三 操作步骤
1蛋白质电转移 戴上手套,取下SDS-PAGE凝胶,小心剥离凝胶。裁剪与凝胶同样大的 硝酸纤维素薄膜和六层Whatman 3MM滤纸,在硝酸纤维素薄膜左下角 剪去一角作为标记。将硝酸纤维素薄膜漂浮于去离子水的表面,使水从 膜的下部浸透以去除其间气泡,将Whatman 3MM滤纸在电转移缓冲液 中浸湿,用蒸馏水淋洗石墨电极,先将三层浸湿的滤纸放在阳极上,在 滤纸表面滚动玻璃棒以除去其间的气泡,再将浸湿的硝酸纤维素薄膜小 心平铺在滤纸上,用玻璃棒小心去除气泡。随后将12%SDS-PAGE凝胶 舒展平铺在硝酸纤维素薄膜上,用玻璃棒小心去除气泡,再将三层浸湿 的滤纸平铺在凝胶上,沁心去除气泡,最后加上石墨电极板,接通电源 进行电转移,电流的大小由凝胶的大小决定,为0.65mA/平方厘米。电 转移2小时后,停止通电,卸掉电转移装置,取下凝胶进行考马斯亮兰 染色,以检测电转移是否完全。小心取下硝酸纤维素薄膜,放在一张干 滤纸上,吸干30-60分钟后,开始进显色反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫印迹免疫印迹免疫印迹(immunoblotting)又称蛋白质印迹(Western blotting),是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。
该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种新的免疫生化技术。
由于免疫印迹具有SDS-PAGE 的高分辨力和固相免疫测定的高特异性和敏感性,现已成为蛋白分析的一种常规技术。
免疫印迹常用于鉴定某种蛋白,并能对蛋白进行定性和半定量分析。
结合化学发光检测,可以同时比较多个样品同种蛋白的表达量差异。
免疫印迹法的基本原理将混合抗原样品在凝胶板上进行单向或双向电泳分离, 然后取固定化基质膜与凝胶相贴。
在印迹纸的自然吸附力、电场力或其它外力作用下, 使凝胶中的单一抗原组份转移到印迹纸上, 并且固相化。
最后应用免疫覆盖液技术如免疫同位素探针或免疫酶探针等, 对抗原固定化基质膜进行检测和分析。
免疫印迹法的基本步骤免疫印迹法(以抗原分析为例)基本上可分为抗原分离、抗原印迹和抗原检定三个步骤。
在每一步中因采用的具体实验方法不同, 可构成多种免疫印迹分析系统。
免疫印迹法的优点免疫印迹法是一项分析抗原、抗体的技术。
它具有下列优点:1、湿的固定化基质膜柔韧, 易于操作;2 、固定化的生物大分子可均一的与各种免疫探针接近, 不会象凝胶那样受孔径阻隔;3、免疫印迹分析只需少量试剂;4、孵育、洗涤的时间明显减短;5、可同时制作多个拷贝, 用于多种分析和鉴定;6、结果以图谱形式可长期保存;7、免疫探针可通过降低PH值等方法, 象抹去录音磁带一样将探针抹掉, 再换用第二探针进行分析检测。
免疫印迹法的应用范围及优点不仅局限于此, 它必将随着这一方法的深入研究而不断发展和完善。
免疫印迹免疫印迹又常称Western blot,是一综合性的免疫学检测技术。
它利用SDS-PAGE技术将生物样品中的蛋白质分子按分子量的大小在凝胶上分离开,然后用电转移的方法将蛋白转移到固相膜上(NC、尼龙或PVDF膜),最后进行免疫学检测。
由于免疫学检测敏感性高,并且通过SDS-PAGE样品中的待检蛋白得到了浓缩,因此,Western blot的灵敏度特别高,可达到放射免疫的分析水平。
而使用一般的免疫学检测技术(如ELISA、放射免疫沉淀)检测时,由于要求被检测蛋白可溶、要求抗体效价高、亲和力高和特异性强,往往并不容易达到目的。
而Western blot却没有这些缺点。
因此,Western blot广泛应用于生物样品中是否存在某一蛋白质(抗原)的检测。
也可用于粗略测定抗原蛋白的相对含量和抗原多肽链的相对分子量。
一、原理是SDS-PAGE电泳与免疫检测相结合的一种蛋白质检测方法。
强阴离子去污剂SDS与还原剂并用,通过加热使蛋白质解离,大量的SDS结合蛋白质,使其带相同密度的负电荷,在聚丙烯酰胺凝胶电泳(PAGE)时,不同蛋白质的迁移率仅取决于分子量。
然后将蛋白质转移到膜上,继而用抗体进行检测。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
二、实验材料诱导与未诱导的带有口蹄疫病毒保护性抗原VP1与LTB融合蛋白基因的工程菌。
三、仪器、耗材与试剂(一)仪器、耗材DYY-6C电泳仪、DYCZ-24D垂直板电泳槽、封口机、DYCP-40C半干式转移电泳槽、5ml、1ml、200μl、50μl、10μl移液器及相应的Tip、50ml烧杯。
新华滤纸、PVDF 膜。
剪刀、刀片,直尺、铅笔、一次性手套。
(二)试剂1.30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲双丙烯酰胺(Bis)1.0g,混匀后加ddH2O,37O C溶解,定容至100ml, 棕色瓶存于4O C。
2. 1.5M Tris-HCl(pH 8.8):Tris 18.17g加ddH2O溶解, 浓盐酸调pH至8.8,定容至100ml。
3.1M Tris-HCl(pH 6.8):Tris 12.11 g加ddH2O溶解, 浓盐酸调pH至6.8,定容至100ml。
4.10% SDS:电泳级SDS 10.0 g加ddH2O 68℃助溶,浓盐酸调至pH 7.2,定容至100ml。
5.10⨯电泳缓冲液(pH 8.3):Tris 3.02 g,甘氨酸18.8 g,10% SDS 10ml加ddH2O溶解, 定容至100ml。
6.10%过硫酸铵(AP):1gAP加ddH2O至10ml。
7.14.4-97.4kDa低分子量蛋白质标准(Marker)8.2⨯SDS电泳上样缓冲液:1M Tris-HCl (pH 6.8)2.5ml,β-巯基乙醇1.0ml,SDS 0.6 g,甘油 2.0ml,0.1%溴酚兰 1.0ml,ddH2O 3.5ml。
9.考马斯亮兰染色液:考马斯亮兰0.25 g,甲醇225ml,冰醋酸46ml,ddH2O 225ml。
10.脱色液:甲醇、冰醋酸、ddH2O以3∶1∶6配制而成。
11.转膜缓冲液:48mM Tris-Cl, 39mM甘氨酸、0.037%SDS 、20%的甲醇,pH8.3。
甘氨酸 2.9g;Tris 5.8g;SDS 0.37g;甲醇200ml;加ddH2O定容至1000ml。
12.0.01M PBS(pH7.4):NaCl 8.0g;KCl 0.2g;Na2HPO4 1.44g;KH2PO40.24g;加ddH2O至1000ml13.显色液:DAB 6.0mg;0.01M PBS 10.0ml;硫酸镍胺0.1ml;H202 1.0μl。
或增强型HRP-DAB底物显色剂盒14.FMDV阳性猪血清15.兔抗猪IgG-HRP酶酶结合物(俗称酶标抗体),购自Sigma公司,产品编号A5670四、操作步骤(一)SDS-PAGE先安装好DYCZ-24D垂直板电泳槽,然后如下操作1、聚丙烯酰胺凝胶的配制①分离胶(15%)的配制:ddH2O 2.3ml 10% SDS 0.1ml30%储备胶 5.0ml 10% AP 0.1ml1.5M Tris-HCl2.5ml TEMED 4μl小心将上述溶液混匀,注意摇起气泡。
迅速将丙烯酰胺溶液灌注到DYCZ-24D电泳槽的两玻璃板的间隙中,留出灌注积层胶所需的空间(梳子的齿长再加1cm)。
然后,再在丙烯酰胺溶液上小心要覆盖一层水(可灌满)。
将电泳槽垂直放置于室温下。
分离胶聚合完全(约30分钟),将分离胶上的水倒去,并将残存的水珠用滤纸条吸去。
②积层胶(5%)的配制:ddH2O 1.4 ml 10%SDS 0.02 ml30%储备胶0.33 ml 10%AP 0.02 ml1M Tris-HCl 0.25 ml TEMED 2 μl将上述混合液灌注到分离胶上面的两玻璃板的间隙中,并立即将梳子插入玻璃板间,完全聚合需30min。
2、样品处理:将样品加入等量的2×SDS上样缓冲液,100℃加热3-5min,离心12000g×1min,取上清作SDS-PAGE分析,同时将SDS低分子量蛋白标准品作平行处理。
3、上样: 取10μl诱导与未诱导的处理后的样品加入样品池中,并加入20μl低分子量蛋白标准品作对照。
4、电泳:在电泳槽中加入1 电泳缓冲液,连接电源,电泳时,积层胶电压60V,分离胶电压100V,电泳至溴酚兰行至电泳槽下端停止(约需3hr)。
5、染色:将胶从玻璃板中取出,考马斯亮兰染色液染色,室温4hr。
6、脱色:将胶从染色液中取出,放入脱色液中,多次脱色至蛋白带清晰。
7、凝胶摄像和保存:在图像处理系统下将脱色好的凝胶摄像,结果存于软盘中,凝胶可保存于双蒸水中或7%乙酸溶液中。
SDS-PAGE注意事项1、实验样品孔与各对照孔所加总蛋白含量要相等:。
2、为达到较好的凝胶聚合效果,缓冲液的pH值要准确,10%APS在一周内使用。
室温较低时,TEMED的量可加倍。
3、未聚合的丙烯酰胺和亚甲双丙烯酰胺具有神经毒性,可通过皮肤和呼吸道吸收,应注意防护。
(二)电转移1、电泳结束后将胶条割至合适大小,用转膜缓冲液平衡,5min×3次。
2、膜处理:预先裁好与胶条同样大小的6张滤纸和PVDF膜,将膜在甲醇中浸泡15秒,然后再在蒸馏水中浸泡2min,最后在转膜缓冲液中最少平衡5min。
3、转膜:转膜装置从下至上依次按阴极碳板、3层滤纸、凝胶、PVDF膜、3层滤纸、阳极碳板的顺序放好,滤纸、凝胶、PVDF膜精确对齐,每一步去除气泡,上压500g重物,将碳板上多余的液体吸干。
接通电源,恒流1mA/cm2,转移1.0hr 或3mA/cm2,转移30min。
(三)免疫反应:1、用0.01M PBST洗膜(pH7.4, 0.02%吐温20),5min ×3次。
2、封闭:将纤维素膜置于一塑料袋中,加封闭液(1%BSA于PBS(pH7.4)中, 0.02%吐温20),室温下轻轻振荡2-3小时或4℃过夜。
3、封闭液,用0.01M PBS洗膜,5min×3次。
4.加FMDV阳性猪血清,用PBS稀释50倍,37℃作用2hr。
4、加入抗猪酶标抗体(按合适稀释比例用0.01M PBS稀释,液体必须覆盖膜的全部),4℃放置12hr或37℃,1hr。
5、将膜从酶标抗体液中取出,用0.01M PBST洗膜,5min×3次。
6、加入显色液,避光显色至出现条带时放入双蒸水中终止反应。
或按试剂盒说明书进行注意事项1、一抗、二抗的稀释度、作用时间和温度对不同的蛋白要经过预实验确定最佳条件。
2、显色液必须新鲜配置使用,最后加入H2O2。
3、DAB有致癌的潜在可能,操作时要小心仔细。
五、结果观察A:未诱导的工程菌(对照)B:诱导的工程菌C:诱导工程菌的包涵体D:Marker,从上至下分子量分别是94.4、66.2、43、31、20.1、14.4 kDaE: 诱导工程菌的免疫印迹F:未诱导工程菌的免疫印迹(对照)上图左侧A、B、C为SDS-PAGE结果,右侧E、F为印迹,B、C 与A相比较,在约40kDa 处有明显的蛋白条带,而E在相应的相位有阳性染色,而F却没有,说明该分子量大约40kDa的蛋白质分子是FMDV特异性。
