水环境化学(3)-4-22
环境化学第三章水

二节 气体在水中的溶解性
水的质量特征:
• 酸度和碱度
第一节 概述
• 盐度和氯度:1千克水中碳酸盐转变为氧化物、溴化物 和碘化物转变为氯化物、有机物完全氧化后所含固体 的总克数。
• 硬度 • 溶氧量:25℃时的饱和浓度
[O2 (aq)] = 2.6×10-3 mol/L = 8.32 mg/L
• 清度和色度
化合物直接与 pH值有关,实际涉及到水解和羟基配合物的平
衡过程,该过程往往复杂多变,这里用强电解质的最简单关 系式表述: Me(OH)n(s) → Men+ + nOH根据溶度积表达式 可导出金属离子浓度 等号两边取负对数: Ksp = [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn -lg[Men+] =-lgKsp-nlg[H+] + nlgKw (3-21)
HS- → H+ + S2则总反应: H2S →2 H+ + S2-
K2= 1.3×10-15
K1,2=K1K2=1.16×10-22
三、溶解沉淀平衡
在饱和水溶液中,H2S浓度总是保持在0.1mol/L,则 [H+]2[S2-] = K1,2×[H2S] = 1.16×10-22×0.1 = 1.16×10-23 由于在水溶液中 H 2 S 的二级电离甚微,故可近似认为 [H+] = [HS-],因此可求得溶液中[S2-]浓度:
三、溶解沉淀平衡
第二节 天然水中的平衡
溶解和沉淀是污染物在水环境中迁移的重要途径,一般金
属化合物在水中迁移能力,直观地可以用溶解度来衡量。
溶解度小者,迁移能力小; 溶解度大者,迁移能力大。 在固—液平衡体系中,需用溶度积来表征溶解度。
三章-水环境化学2省名师优质课赛课获奖课件市赛课一等奖课件
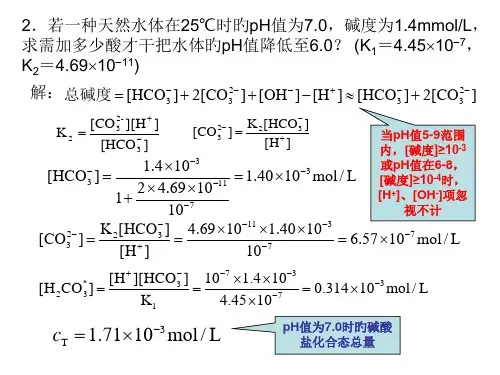
4.69 1011 1.40 103 107
6.57 107 mol / L
[H2CO*3 ]
[H ][HCO3 ] K1
107 1.4 103 4.45 107
0.314103 mol / L
cT 1.71103 mol / L
pH值为7.0时旳碱酸 盐化合态总量
pH为6.0时碳酸盐化合物态总量=pH为7.0时旳总量
加入的酸量为碱度降低值 (1.4 0.526) 103=0.873103 mol / L
解题旳要点:在碳酸总量不变前提下, 碱度旳降低值即为加入旳酸量。
环节 : 1 求碳酸总量; 2 求碱度; 3 求差。
解法二(书上旳解法):
pH值不同步旳各碳酸 化合物旳百分数为已知
解:总碱度 [HCO3 ] 2[CO32 ] [OH ] [H ] cT (1 22 )
存在形式:镉人是因食水用迁含移镉旳性大元米素和饮,用除含了镉旳硫水化而镉中毒外,,全其身疼他痛旳,化合物
均能溶于水。故在称“水骨体痛中症”镉。主据要统计以,C在d129+6状3年态至存19在68年。5还月,可共与有无机和 有机配位体生成多种确可诊溶患者性25配8人合,物死。亡人天数然达水128中人镉。 旳溶解度受碳
了目前人们所说旳神经毒
事故。在世界许多地方,
气(如:沙林,甲氟磷酸
对硫磷造成旳死亡率是令
异丙酯)。另某些同属构
人震惊旳:1958年在印度
造成为农药。
有l00起致命旳病例,叙利
亚有67起;在日本,每年
平都有336人中毒致死。
2、多氯联苯(polychlorinated biphenlys)
——米糠油事件。1968年,日本九州爱知县一带在生产米糠 油过程中,因为生产失误,米糠油中混人了多氯联苯(作脱 臭工艺中旳热载体 ),致使1400多人食用后中毒,4个月后, 中毒者猛增到5000余人,并有16人死亡。与此同步,用生产 米糠油旳副产品黑油做家禽饲料,又使数十万只鸡死亡。
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化

对于其他金属碳酸盐则可写为: -lg[Me2+] =0.5p Ksp -0.5pα2 由2 [Me2+] + [H+] = [HCO3-] + 2[CO32-] + [OH-]得: (Ksp/α2)1/2 (2 – α1- 2α2) + [H+] – Kw/[H+] = 0
当pH > pK2 时,α2≈1,CO32-为主,lg[Ca2+] = 0.5 lg KSP
四、氧化还原
氧化-还原平衡对水环境中无机污染物的迁移转化 具有重要意义。水体中氧化还原的类型、速率和平衡, 在很大程度上决定了水中主要溶质的性质。例如,厌 氧型湖泊,其湖下层的元素都将以还原形态存在;碳 还原成-4价形成CH4;氮形成NH4+;硫形成H2S;铁 形成可溶性Fe2+。其表层水由于可以被大气中的氧饱 和,成为相对气体性介质,如果达到热力学平衡时, 则上述元素将以氧化态存在:碳成为CO2;氮成为 NO3-;铁成为Fe(OH)3沉淀;硫成为SO42-。显然这种 变化对水生生物和水质影响很大。
发生吸附的表面净电荷的符号 - 金属离子所起的作用 吸附时所发生的反应 发生吸附时要求体系的pH值 吸附发生的位置 对表面电荷的影响 反离子
阳离子交换 配位体交换 >零电位点 任意值 扩散层 无 内层 负电荷减少 正电荷增加
(2)吸附等温线和等温式:在固定温度下,当吸附达到平 衡时,颗粒物表面的吸附量(G)与溶液中溶质平衡浓度
达到临界状态,就可以发生快速凝聚。
三、溶解和沉淀
溶解与迁移 实际溶解沉淀过程的复杂性 1、氧化物和氢氧化物:氧化物可以视作氢氧化物的脱水产物 Me(OH)n (s) Men+ + n OH根据溶度积: Ksp= [ Men+ ] [ OH- ]n 可转化为: [ Men+ ] = Ksp / [ OH- ]n = Ksp[ H+] / Kwn -lg [ Men+ ] = -lgKsp – n lg [ H+ ] + n lgKw pc = pKsp- n pKw + n pH = pKsp – n pOH 可以做 pc-pH 图,斜率等于 n,即金属离子价; 截距是 pH = 14 - (1/n)pKsp。
(完整版)第三章水环境化学答案

第三章水环境化学1、请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。
解: 开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)] = lg K H + lg Pco 2 = - 4.9lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH= -11.3 + pHlg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH= -21.6 + 2pH*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H KK CO CO H CO H K K +--+⋅==⋅][][][233*32--++=CO HCO CO H C T 是常数。
的总和为各种碳酸化合态浓度假设,T C TC HCO ⎥⎦⎤⎢⎣⎡-=31αTC CO ⎥⎦⎤⎢⎣⎡-=232αTC CO H ⎥⎦⎤⎢⎣⎡*=320α122122][][1(-+++=K H K K H α1211)][][1(-++++=H K K H α122110][][1(-++++=H K K H K α*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+⋅==⋅][][][][21233*32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --eg oo d 2、请导出总酸度、CO 2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数。
环境化学重点

= 4.69×10-11×1.00×10-3 /1.00×10-8
例2
(p156)
4.69 10 0.469 , 10 [ HCO3 ] 1.00 10 [CO3 ]
若水体 pH升高到10.00, 碱度仍保持1.00×10-3 mol/L,再计算 该水体中各碱度成分的浓度。 碱度 = [ HCO3-] + 2[CO32-] + [OH-] [OH-] = 1.00×10-4 mol/L 1.00×10-3 = [HCO3-] + 2[CO32-] + 1.00×10 -4
= 2 酚酞碱度 – 总碱度
B、酸度(Acidity):指水中能与强碱发生中和作用的全 部物质,亦即放出 H+ 或经过水解能产生 H+ 的物质总 量。组成水中酸度的物质可归纳为三类:强酸弱酸和 强酸弱碱盐。
无机酸度:以甲基橙为指示剂滴定到 pH = 4.3
无机酸度 = [H+] - [HCO3-] - 2 [CO32-] - [OH-]
试计算25度,标准大气压下,水中有机物浓 度是多少时, 可基本消耗全部的氧气?
(3)气体在水中的溶解性
氧气溶解度随着温度的变化,要求会计算。
Lg(C2/C1) = △H / (2.303R) ( 1/T1 - 1/T2 )
当温度从0 ℃升到35 ℃时,氧在水中的溶解度将从 14.74mg/L降低到7.03mg/L。
水资源
地球上水贮量13,9亿,其中97%为海洋淡水, 不能直接利用。 水是人类发展不可缺少的自然资源,是人类 和一切生物赖以生存的物质基础。人类对水 资源的开发和利用包括: A直接利用,数量和质量会发生变化; B水能的利用,发展水运等,无量的消耗。
水环境化学讲义精选全文完整版

可编辑修改精选全文完整版水环境化学讲义水圈包括海洋水、大气水、陆地水。
陆地水包括:地下水:潜水,承压水,冻土水,岩石、土壤分子水。
地表水:冰帽水、径流水、湖泊水、沼泽水。
生物水。
从分子与溶液的角度看水与天然水作为分子的水的组成、结构、特性:易作溶剂:氢键、异性相吸、六边形、较大分子间隙。
作为溶液的天然水的物理化学性质粘度:流体运动过程中,分子之间形成的剪切应力的物理量,水的粘度相对较大且随温度升高而急剧减少。
离子活度(ɑ)及离子强度(L)离子活度系数:反映溶液体系中某离子表现活性的物理量。
当量数:相当于1摩尔氢离子所含电子量的物理化学量。
当量浓度:1L溶液中所有某种物质的当量数的量。
当量=【M Zi】/|Zi| ,摩尔浓度【M Zi】=|Zi|*当量。
一切化学反应都是当量平衡。
离子缔合体。
范德华力包括静电力、诱导力、色散力。
溶液体系中因分子与分子间碰撞作用形成的离子束称为离子缔合体。
第二章天然水化学成分最早形成于大气层(凝结核),成分的直接影响因素包括生物、土壤、岩石。
生物是最大来源;成分的间接影响因素包括气候、地貌(接触时间)、水文要素(容量、流速等)天然水主要离子化学水化学反应回顾:(1)中和反应(2)沉淀-溶解反应:CaCO3<==>Ca2++CO32-(3)氧化还原反应(4)水解反应Fe3++3OH-<==>Fe(OH)3↓Fe(OH)3+3OH-<==>Fe(OH)63-未脱水而先形成配位体(配位反应特例)(5)配位反应Fe3++CN-<==>Fe(CN)63-氰化物处理(6)置换反应(7)吸附-解吸反应:2Na++Mg(胶体)2+<==>(Na胶体Na)2++Mg2+ 2Na++Cd(胶体)2+<==>(Na胶体Na)2++Cd2+骨痛病(8)缔和反应:在离子强度很高的条件下发生。
AgCl+Cl -<==>AgCl2-标准海水矿化度35.5g/L ,碱金属一般不发生配位反应。
水文地球化学课后思考题
复习题与思考题1. 名词解释(1)阳离子交换容量;(2)弥散通量;(3)水文地球化学;(4)水动力弥散;(5)弥散问题数学模型;(6)大陆效应;地下水污染;(7)碱度;(8)酸度;(9)硬度;(10)永久硬度;(11)暂时硬度;(12)碳酸盐硬度;(13)非碳酸盐硬度;(14)生化耗氧量(BOD);(15)化学耗氧量(COD)(16)物理吸附;(17)化学吸附;(18)离子交替吸附作用;(19)阳离子交换容量;(20)同位素效应;(21)同位素分馏;(22)同位素交换反应;(23)射性同位素的半衰期;(24) TDS;(25)全等溶解;(26)非全等溶解;2.思考并回答下列问题绪论(1)试说明水文地球化学的含义。
(2)试说明水文地球化学作为一个独立学科的发展历史。
(3)说明水文地球化学的研究意义。
第一章地下水的化学成分(1)试说明水的结构特征。
(2)水有那些特异性质,试分别对其予以说明。
(3)地下水的化学成分有那几类,分别予以简要说明。
(4)通常有哪些方法可用来对水质分析结果进行检验?(5)地下水化学成分的图示方法有哪些?试分别予以简要说明。
第二章地下水化学成分的形成作用(1)怎样根据化学反应的自由能资料计算反应的平衡常数?(2)水溶液中组分活度系数的计算方法主要有哪些?试说明其适用条件。
(3)试说明影响矿物在水中溶解度的因素。
(4)试分别说明纯水中石膏、萤石、石英、三水铝石溶解度的计算方法。
(5)试说明矿物稳定场图的绘制方法。
(6)试定性地说明为什么在CO2-H2O系统中水溶液显酸性,而在CaCO3-H2O系统中水溶液显碱性。
(7)已知H2CO3的一、二级电离常数分别为K a1和K a2,试导出CO2──H2O系统中:溶解碳总量为C T、氢离子浓度为[H+]时,H2CO3、HCO3-和CO32-含量的计算公式。
若25℃时,K a1=10-6.35、K a2=10-10.33,试分析说明上述组分中那一种组分在什么样的pH区间内含量最大?(8)在CO2分压(p)已知的CO2—H2O系统中,已知下述反应的平衡常数分别为CO2分压为10-3.5(atm),水的离子积为10-14,且上述反应均已达到平衡状态。
水环境化学知识点总结
15
27、天然水体中重要的无机配体有:OH-、Cl-、 CO32-、HCO3-、F-、S2-、CN-、NH3
28、不易水解的有机污染物:烷烃 烯烃 芳香烃 硝基苯 杂环化合物 PCBs醇类 醚类 羧酸
易水解的有机污染物:卤代烷烃 酰胺 胺 羧酸酯 氨基甲酸盐 环氧化物 腈类 有机磷酸酯 尿素类 磺 酸酯 酐
22、金属污染物 :Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、Be
2021/10/10
14
23、环境中某一重金属的毒性与其 游离金属离子 浓度 、 配合作用 、和 化学性质 有关。
24、TN 、 TP 总磷、总氮和 COD常衡量水体富 营养化的指标。
25、水体的自净作用可分为 物理作用、化学作用 和生物作用。
2021/10/10
7
14、沉淀物中重金属重新释放诱发因素:①盐浓 度升高:碱金属和碱土金属阳离子可将被吸附在 固体颗粒上的金属离子交换出来。②氧化还原条 件的变化:有机物增多,产生厌氧环境,铁猛氧 化物还原溶解,使结合在其中的金属释放出来。 ③pH值降低:氢离子的竞争吸附作用、金属在低 pH值条件下致使金属难溶盐类以及配合物的溶解。 ④增加水中配合剂的含量:天然或合成的配合剂 使用量增加,能和重金属形成可溶性配合物,有 时这种配合物稳定性较大,以溶解态形式存在, 使重金属从固体颗粒上解吸下来。
3、水体中可能存在的碳酸组分 CO2、 CO32-、HCO3-、H2CO3 ( H2CO3*)
2021/10/10
2
4、天然水中的碱度和酸度:碱度:水中能与强酸 发生中和作用的全部物质,即能够接受质子H+的 物质总量;酸度:凡在水中离解或水解后生成可 与强碱(OH-)反应的物质(包括强酸、弱酸和 强酸弱碱盐)总量;即水中能与强碱发生中和作 用的物质总量。
养殖水环境化学实验
或
{V样 }mL
1000
{Cl- }mg/L 35.45 1000 {V样}mL 式中: 硝酸银标准溶液对氯离子的滴定度; TAgNO / Cl cAgNO3 准溶液浓度。
3
({V1}mL {V0 }mL ) {cAgNO3 }mol/L
为硝酸银标
思考题
滴定过程中为何要剧烈摇荡? 滴定过程中为何要控制酸度在一定范围? 铬酸银沉淀为砖红色,滴定终点的颜色为什么定为淡砖红色,而不是 砖红色?
主要仪器
150mL锥形瓶、25mL棕色酸式滴定管、50mL和25mL移液管等。
试剂
1.氯化钠标准溶液(cNaCl = 0.01410mol/L):称取0.4121g,溶于 纯水中,在容量瓶中稀释至500mL。此标准溶液1mL含0.5000mg 氯化物(以Cl-表示)。 2.硝酸银标准溶液:称取2.40g硝酸银,溶于纯水并稀释至1000mL, 贮于棕色瓶中。准确浓度需要标定。 3.铬酸钾溶液(50g/L):称取5.0g铬酸钾溶于少量纯水中,再稀释至 100mL。
HCO3
50.00
• 当VT<2VP时: 1000 (2V c
2
{c1 CO2- }mmol/L
3
1000 {cHCl }mol/L 2{VP }mL 5cHCl mol/L 50.00
OH-
mmol/L
c
1 CO23 2
实验一、氯离子及盐度的测定
氯离子的测定原理
在中性至弱碱性范围内(pH6.5~10.5),以铬酸钾为指示剂, 用硝酸银溶液滴定氯化物时,由于氯化银的溶解度小于铬酸银, 当氯离子被完全沉淀后,银离子就与铬酸根离子生成砖红色铬酸 银沉淀,使白色混浊溶液中出现稳定的砖红色成分,便指示终点 到达。沉淀滴定反应如下: Ag++ClAgCl 2Ag++ CrO42Ag2CrO4 (砖红色)
环境化学复习题库(含答案)
环境化学复习题库(含答案)环境化学复习题库第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_。
2、环境化学研究的对象是: 环境污染物。
3、环境中污染物的迁移主要有机械、物理-化学和生物迁移三种方式。
4、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。
5、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。
二、选择题1、属于环境化学效应的是 AA热岛效应 B温室效应 C土壤的盐碱化 D噪声A _污染水体后引起的 2、五十年代日本出现的痛痛病是由___A CdB HgC PbD As 3、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As 三、问答题1、举例说明环境效应分为哪几类,2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空题1、写出下列物质的光离解反应方程式:(1)NO + hν NO + O 2(2)HNO+ hν HO + NO 或HNO+ hν H + NO 2 2 2(3)HNO+ hν HO + NO 3 2(4)HCO + hν H + HCO 或HCO + hν H + CO 222(5)CHX + hν CH + X 332、大气中的NO可以转化成 HNO 、 NO和 HNO 等物质。
23333、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O的反应机理如下: 3CH(O)CH 232第 1 页共 10 页环境化学复习题库+ CH == CH HCO+HCOO O322225、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有和湿沉降两种。
干沉降6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + ClCl + O O + ClO 32ClO +O O + Cl 27、当今世界上最引人瞩目的几个环境问题中的____温室效应_____、___臭氧层破坏_______、光化学烟雾___等是由大气污染所引起的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
迁移过程中,大部分重金属在水体 中的可溶态都是配合形态,随环境条件 改变而运动和变化。
至于毒性,自由铜离子的毒性大于 配合态铜;甲基汞的毒性大于无机汞。
1、天然水体中配合作用的特点
(Character of Complexation in Natrual Water Bodies)
(1)大多数配合物稳定地存在于水中;
(2)羟基、卤素配体的竞争配位作用, 影响金属难溶盐的溶解度; (3)重金属离子与不同配体的配位作用, 改变其化学形态和毒性。
2、分类 (Classification)
天然水体中常见的配位体可分为 无机和有机两类。 其中重要的无机配体有:OH-、Cl-、 CO32- 、 HCO3- 、 F- 、 S2- ,其中最重要的 无机配体是OH-、Cl-。
3、腐殖质形成的螯合物
腐殖质对环境中几乎所有金属离子都有螯合作用,尤其是对过渡金 属 螯 合 性 更 强 。 对 金 属 螯 合 能 力 强 弱 一 般 符 合 欧 文 - 威 廉 ( Irving-
Willian)次序,即
Mg<Ca<Cd<Mn<Co<Zn≈Ni<Cu<Hg
从海洋沉积物中分离出的腐殖质,其对金属的总螯合容量约97-150mg/g; 对于不同金属其螯合能力不同,Cu、Zn、Ni、Co、Mn,螯合容量分别为
无机螯合剂较少,如聚合磷酸盐,由相 邻的PO43-基团中的氧原子同金属离子形成环 状配位结构。
聚合磷酸盐最基本结构形式为:
(二) 配合物在溶液中的稳定性
稳定常数是衡量配合物稳定性大小的尺度,例如Zn(NH3)2+ 总反应 Zn2+ + 4NH3 = Zn(NH3)42+
可由下面反应生成
Zn2+ + NH3 = ZnNH32+ Zn2+ + NH3 = ZnNH32+
2、腐殖质的化学结构
腐殖质具有非常复杂的化学结构,而 且结构还随其来源(如土壤、淡水、海 水、褐煤、沉积物)而异。腐植酸分子 核心是一个含有大量有机杂原子基团的 高分子化合物,核心外围联结很多功能 基团。
腐殖质三种分子间的区别在于分子量 和官能团含量的不同。如腐植酸和胡敏 质比富里酸有更高的分子量和较少的亲 水官能团。总的来说,腐殖质的结构中 还有羧基、酚基、醇基、羰基等官能团.
络合物的特性。
人们利用这种特性将一些重金属盐类用作混
凝剂进行废水处理,取得了很好效果。
表
类别 名称 硫酸铝 氯化铝 含铁硫酸铝 硫酸铝钾 聚硫酸铝 聚氯化铝 硫酸亚铁 硫酸铁 三氯化铁 聚合硫酸铁 聚氯化铁 消石灰 氧化镁 碳酸镁
常用无机混凝剂
分子式 Al2(SO4)3·18H2O AlCl3 Al2(SO4)3+ Fe2(SO4)3 Al2(SO4)3·K2SO4·24H2O [Al2(OH)n(SO4)3-n/2]m [Al2(OH)nCl6-n]m FeSO4·7H2O Fe2(SO4)3·2H2O FeCl3·6H2O [Fe2(OH)n(SO4)3-n/2]m [Fe2(OH)nCl6-n+]m Ca(OH)2 MgO MgCO3 略记号 AS AC MIC KA PAS PAC FSS FS FC PFS PFC CHO MO MC 使用 pH
海水中腐殖质含量约占有机物总量的6%-30%, 一般在 100-300ug/l 范围内。海水中腐殖质经高分子 多孔聚合物 XAD-2 吸附浓集后,再用酸碱处理,即 可获得腐殖质的三种重要组分:
其中: (1)腐植酸,是能溶于碱而沉积于酸的组分; (2)富里酸,是兼能溶于酸和碱的组分; (3)胡敏质,是酸碱皆不溶的组分。
一类是简单配位化合物,包括单核配位化合物(如 Cu(NH3)42+)和多核配位化合物,如
OH ( H 2 O) 4 Fe OH Fe( H 2 O) 4
4
配位化合物的另一大类螯合物,是由多基配位体 与金属离子同时生成多齿配位键,构成环状螯合结构的 产物。 大多数螯合剂都是有机配体;
课后思考与作业
1.腐殖质的环境化学意义 ;腐殖质与金属离子间的螯 合方式有哪几种?
低分子 铝盐 高分子
6.0~8.5
6.0~8.5 8.0~11 4.0~11 4.0~11 4.0~11 4.0~11 9.5~14 9.5~14
低分子 铁盐 高分子
其他
低分子
(四) 腐殖质的配合作用 (Complexation of Humic Substances) 腐殖质是带负电荷的高分子弱电解质。 是生物体物质在土壤、水和沉积物中转化 而成。 多含有–COOH、–OH等。 分子量300-30000。
ZnNH32+ + NH3 = Zn(NH3)22+
Zn(NH3)22+ + NH3 = Zn(NH3)32+ Zn(NH3)32+ + NH3 = Zn(NH3)42+ K1 K2 K3 K4
Zn2+ + 2NH3 = Zn(NH3)22+
Zn2+ + 3NH3 = Zn(NH3)32+ Zn2+ + 4NH3 = Zn(NH3)42+ β1 β2 β3 β4
络离子的电荷降低,并且羟基数目增多, 都有利于羟基桥联,生成更高级的多核络合 物。
这里的水解和羟基桥联两种反应交替进行,其最 终结果则是生成难溶的氢氧化铝沉淀。
[Aln(OH)3n] → [Al(OH)3]n
除Fe3+和Al3+外,许多金属离子如Zn2+、Cu2+、
Mg2+ 、 Pb2+ 、 Hg2+ 、 Sn2+ 等,也都具有生成多核
为累积稳定常数(或累积生成常数):
[Zn( NH 3 ) 2 4 2 ] 2 K K 8 . 2 10 1 2 2 2 [Zn ][NH 3 ]
概括起来配合物反应的逐级生成常数和累积生成常数可 表示如下:
L L L M ML ML2 MLn
有机配体又可分为两大类:一类是水体 中动物、植物、微生物的新陈代谢产物或他 们残骸的分解物,其中最重要的是腐殖质, 此外还有泥炭、厩肥、植物残体、微生物的 代谢产物、动植物生活分泌物等; 另一类属于人为污染物,包括洗涤剂、 清洁剂、农药、表面活性剂如 NTA(氨基三 乙酸)、EDTA等。
天然水体中常见的配位化合物可分为两类:
2 [ Zn ( NH ) 2 2 2 ] 生成常数K2为 : K 2 . 1 10 2 [ZnNH3 ][NH 3 ]
这里 K1 、 K2 、 K3 、 K4 称为逐级生成常数(或逐级稳定 常数),表示NH3加至中心Zn2+上是一个逐步的过程。
累积稳定常数是指几个配位体加到中心金属离子过 程的加和。例如,Zn(NH3)22+的生成可用下面反应式表 示: Zn2+ + 2NH3 = Zn(NH3)22+
第三章 水环境化学
(Water Environmental Chemistry)
第一节
天然水的基本特征及污染物的存在形态
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化 第四节 废水处理技术概述
《环境化学》 第三章 水环境化学
第二节
水中无机污染物的迁移转化 (Transport and Transformation of inorganic Pollutants)
(1)在pH较高的碱性溶液中或离子强度低的条件 下,羟基和羧基大多离解,使高分子呈现的负电 荷相互排斥,构型伸展,亲水性强,因而趋于溶 解。 ( 2 )在 pH 降低而呈酸性溶液中,或有较高浓度的 金属阳离子时,各官能团难于离解而电荷减少, 高分子趋于卷缩成团,亲水性弱,因而趋于沉淀 或凝聚。
1、腐殖质的生成及其主要成分
腐殖质的化学结构特征
( 1 )以碳链为骨架,以 —O— , —N— 为交联 基团; (2)含氢键,带有很多含氧功能基; (3)分子量大,如胡敏质、腐植酸分子量可达 几万; (4)分子内多处带有电荷,高度极性; (5)分子内蛋白质类和碳水化合物类的部分很 容易发生水解;芳香核部分不易发生化学降 解和生物降解。
一、污染物在颗粒物与水之间的迁移 (吸附-解吸) 二、溶解和沉淀
三、氧化-还原
四、配合作用
(一)概述
污染物特别是重金属大部分以配合物形 态存在于水体,其迁移、转化及毒性等均与 配合作用有密切关系。
例如,许多污染物就是以配合物的形式 排放,像无氰镀镉和有氰镀镉的废水中,镉 分别以氨羧酸配合物和氰络离子 Cd(CN)42- 的 形式排入水体中。生活污水中的洗涤剂也是 良好的配位体。
Zn2+ + NH3 = ZnNH32+
生成常数K1为:
[ ZnNH32 ] 2 K1 3 . 9 10 [ Zn 2 ][NH 3 ]
在上述反应中为了方便起见,把结合水省略了。 然后ZnNH32+继续与NH3反应,生成Zn(NH3)22+:
ZnNH32+ + NH3 = Zn(NH3)22+
67.4、26.1、17.4、9.6、5.6mg/g。
腐殖质与金属形成的螯合物一般都不溶于水; 富里酸与金属生成的螯合物相对易溶些,当 [FA]/[Me]>2时,倾向于易溶。
金属离子与富里酸生成螯合物的可溶程度
在pH=6-8范围内,天 然水中各金属离子与富里酸 生成螯合物的可溶程度如图 所示。 一般地说Fe3+、Cr3 + 、 Al3 + 、Pb2+、Cu2 +的螯合 物更为难溶,所以这些螯合 物容易在土壤或沉积物中富 集累积。
